胃癌組織中組織蛋白酶D的表達及與侵襲基因和預后的關系
彭昌能 (郴州市第四人民醫院,湖南 郴州 423000)
胃癌是起源于胃黏膜上皮的惡性組織增生腫瘤,具有明顯的組織浸潤和侵襲特性,表現為細胞黏附能力下降、穿破基底膜進入血液循環、逃避免疫監視及在遠隔部位生長等[1-2]。目前已發現的胃癌侵襲轉移基因中基質金屬蛋白酶(MMP)屬于重要的一類,可高效促進腫瘤的侵襲轉移能力[3-4]。而胃癌組織在浸潤遷移過程中,轉移蛋白酶水平會出現相應變化,其中包括組織蛋白酶。組織蛋白酶是半胱氨酸蛋白酶家族的主要成員,人體中包含11 種,與腫瘤疾病、骨質疏松、關節炎等多種重大疾病的進展和惡化密切相關。組織蛋白酶D(CTSD)屬于蛋白水解酶,其水解基質特性可加速破壞基底膜、促進基質溶解,在腫瘤組織的浸潤、轉移過程中發揮重要作用[5]。但CTSD在胃癌組織中的表達意義,以及其胃癌患者預后之間是否存在聯系仍屬于目前的研究薄弱方向。基于此,本研究納入92胃癌患者進行分析,探討CTSD與胃癌組織侵襲轉移和預后的關系,旨在為控制胃癌組織浸潤轉移、提高胃癌預后質量提供新思路。
1 資料與方法
1.1研究對象:選取我院2018年2月~2021年2月收治的92例胃癌患者腫瘤組織標本作為觀察組,以上述標本內的非腫瘤胃黏膜組織作為對照組。其中男52例,女40例;年齡50~72歲,平均年齡(61.65±6.25)歲;組織標本包括41例胃竇腺癌,27例胃體,24例胃角。所有患者胃癌組織均來自原發病灶,患者未合并有其他腫瘤疾病,且均未接受放化療。本次研究經過本院醫學倫理委員會同意。
1.2方法:本研究試劑及儀器包括olympus顯微鏡,CTSD試劑盒(北京中山生物技術有限公司),S-P試劑盒(美國Maxim公司)。所取胃癌組織標本均經甲醛溶液固定、脫水,采用S-P 法處理取片:5 μm連續切片,脫石蠟,采用酒精水化一次阻斷組織氧化,經微波抗原修復后以羊血清封存。研究時,先取出加入一抗(CTSD單克隆抗體),置入-4 ℃冰箱留置一夜;取出后再滴入二抗和三抗,DAB顯色處理,再采用酒精梯度脫水、取片[6-7]。本研究在染色流程中設置對照組,以PBS液替代一抗作為陰性對照。
1.3CTSD結果判定:實驗所得結果由同一位專業醫師評估,以顯微鏡觀察每張切片3~5個熱點區視野內的陽性細胞比例、著色強度。陽性細胞比例>75%計為4分,51%~75%計為3分,26%~50%計為2分,1%~25%計為1分,陰性計為0分。著色強度根據視野內棕色顆粒強度判斷,棕褐色計為3分,棕黃色計為2分,淡黃色計為1分,無明顯顯色計為0分。陽性細胞比例分數與顯色強度分數相乘,總分12 分,>6分為陽性,反之則為陰性[8]。
1.4統計學方法:本實驗數據采用SPSS22.0軟件分析,計數數據組間行χ2檢驗;計量數據組間比較采用t檢驗;采用Kaplan-Meier分析胃癌患者生存率,組間比較行log-rank檢驗。P<0.05為差異有統計學意義。
2 結果
2.1兩組標本組織中的CTSD、侵襲基因表達情況比較:觀察組中CTSD、MMP-3陽性表達率顯著高于對照組,二者組間比較差異有統計學意義(P<0.05)。 見表1。

表1 兩組標本組織中的CTSD及MMP-3表達情況比較[n(%),n=92]
2.2CTSD與MMP-3的關系:在MMP-3陽性表達中,CTSD陽性表達率為85.11%(40/47),在MMP-3陰性表達中,CTSD陽性表達率為62.22%(28/45),二者比較差異有統計學意義(P<0.05)。見表2。
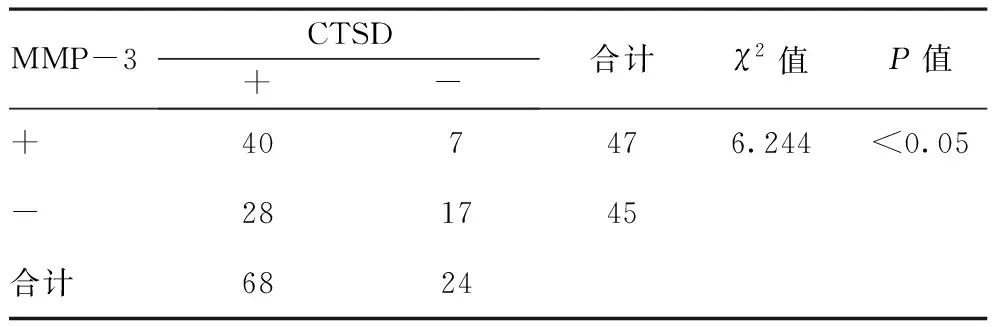
表2 CTSD與MMP-3的關系(n=92)
2.3CTSD與胃癌浸潤轉移的關系:觀察組中不同胃癌組織學類型、病理分化程度中的CTSD陽性和陰性表達差異無統計學意義(P>0.05);在不同浸潤程度、有無淋巴結轉移中CTSD陽性和陰性表達率差異有統計學意義(P<0.05)。見表3。
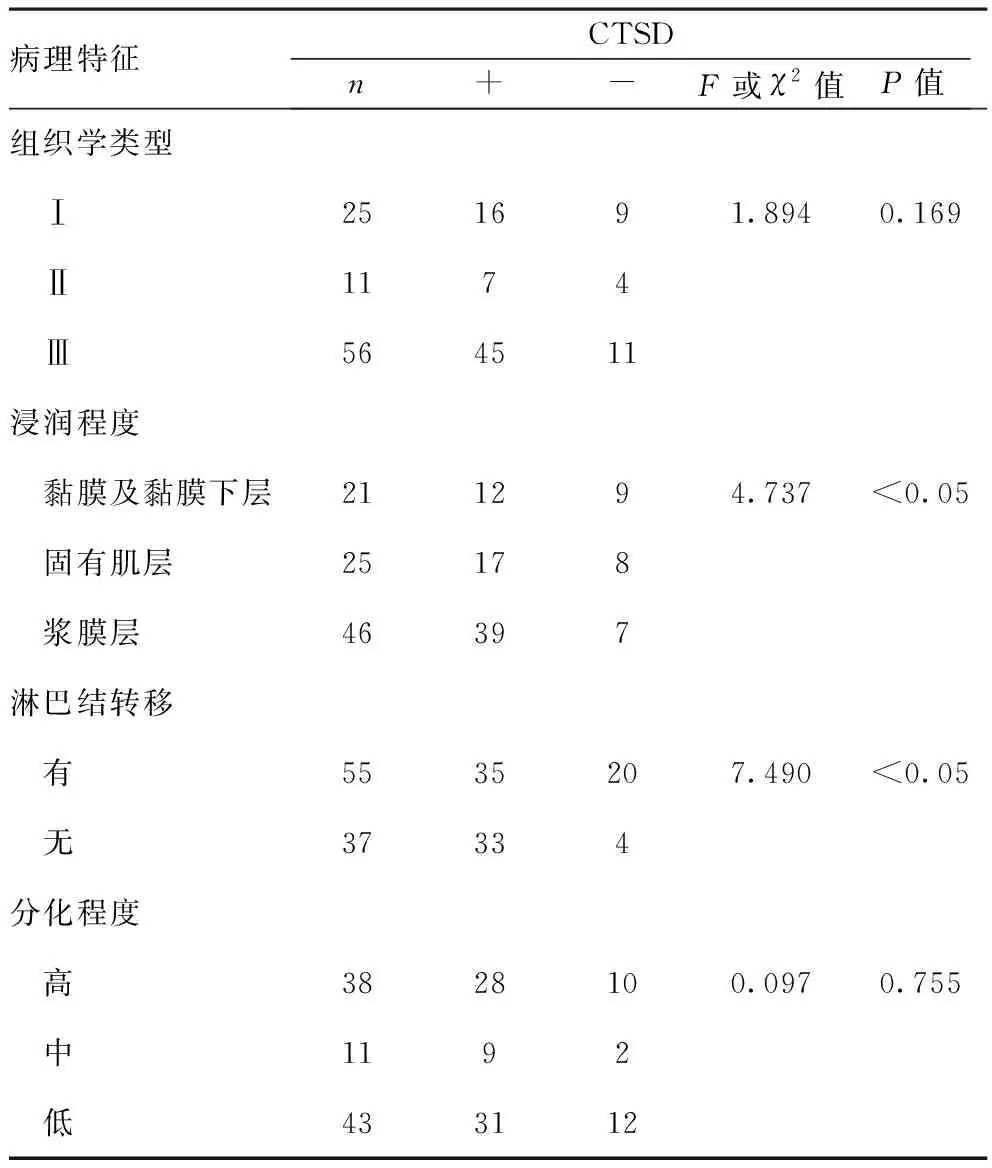
表3 各病理因素間的CTSD表達情況(n,n=92)
2.4CTSD表達與預后的關系:本研究隨訪10~40個月,平均隨訪(24.55±10.02)個月。術后胃癌CTSD陽性表達生存24例(35.29%),陰性表達生存15例(62.50%)。經Kaplan-Meier分析,CTSD陽性表達者平均無進展時間為(27.86±1.40)個月,CTSD陰性表達者平均無進展時間為(35.17±3.11)個月,二者比較差異有統計學意義(t=20.558,P<0.05)。見圖1。
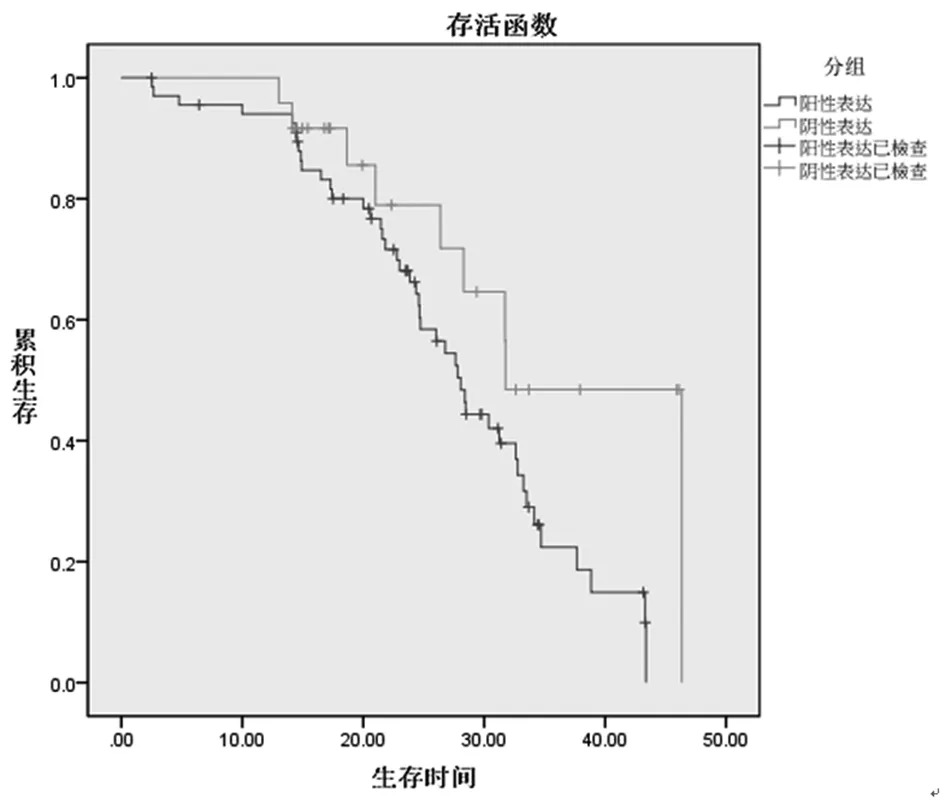
圖1 CTSD表達與預后的關系
3 討論
胃癌不斷惡化發展的主要機制在于胃黏膜上皮的惡性組織浸潤侵襲及轉移,其中包含多個復雜的惡性腫瘤生物學特征,向鞍區周圍組織浸潤生長,破壞正常結構[9-10]。原發病灶內的癌細胞不斷發展導致細胞粘附能力下降,癌細胞脫離病灶游離侵襲病灶周圍組織,穿破基底膜在血液循環系統內擴散,避開免疫系統監視機制形成新生血管,在遠隔部位形成新的病灶繼續生長[11]。因此,胃癌惡性腫瘤疾病惡化迅速,需探究相關指標在胃癌早期于組織侵襲轉移、預后的關系,以此控制胃癌組織浸潤轉移,提高胃癌預后質量。
組織蛋白酶存在于動物組織細胞內,主要存在于溶酶體部分,可以根據所作用的代表性底物發揮肽鏈內切酶功能,降解不同膠原細胞外基質[12]。CTSD具有獨特的合成和轉運方式,表面由粗面內質網合成,通過多種蛋白質水解途徑最終抵達細胞內的小泡結構(溶酶體、核內體、吞噬體),從而發揮蛋白質水解、細胞增殖、細胞凋亡等生理和病理功能[13-14]。本研究結果表明,胃癌組織惡化發展過程中合并大量CTSD,高效促進癌細胞的侵襲轉移進程。
劉愛東等[15]在相關研究中發現,胃癌組織中侵襲基因MMP-11和CTSD陽性表達呈顯著正相關,二者存在聯動作用,共同促進癌細胞的侵襲轉移。MMPs蛋白家族需要Ca2+、Zn2+等輔助激活,主要由疏水信號肽序列、保持酶原穩定性的前肽區、金屬離子結合點的催化活性區、富含脯氨酸的鉸鏈區以及酶底物特異性的羧基末端區5個功能區組成[16-17]。不同MMPs成員在不同功能區各有特點,但酶催化活性區和前肽區均具有高度保守性,可降解多種細胞外基質成份(ECM)中的各種蛋白成分,由此影響腫瘤細胞侵襲組織學屏障。MMPs家族已分離鑒別出26個成員,其中MMP-3又稱為基質溶解酶1(stromelysin 1),在惡性腫瘤細胞表達濃度遠遠高于其他MMP成員[18]。本研究結果與上述結論一致。究其原因,胃癌組織細胞侵襲轉移過程中CTSD大量合成,發揮肽鏈內切酶功能活化膠原酶,激活侵襲基因MMPs,經MMP激活后降解細胞外基質,打開惡性腫瘤細胞轉移通路,進一步加快腫瘤的浸潤和侵襲[19-20]。
此外,MMP-3主要作用于非變性膠原蛋白(PG)、層粘連蛋白(LN)、纖連蛋白(FN)、Ⅲ型和Ⅳ型膠原及明膠,且能夠激活陽性率較低的MMP-1和其他家族成員,而MMP-1在各種刺激下可呈高表達狀態,與惡性腫瘤與預后質量存在密切聯系[21],這說明CTSD陽性可能也與胃癌患者預后質量有關。本研究結果說明CTSD陽性表達不僅會影響侵襲基因的表達狀態,還會加快胃癌腫瘤疾病的惡化進程,縮短患者生存時間[22]。
綜上所述,胃癌組織中CTSD呈高度表達狀態,且與胃癌侵襲基因存在密切聯系,可用以初步判斷患者的預后質量。

