打破野生藏沙蒿種子休眠方法的篩選與評價
羅建民, 劉 歡*, 王敬龍, 劉云飛, 王綺玉, 黃 穎
(1. 甘肅農業大學草業學院,草業生態系統教育部重點實驗室, 甘肅 蘭州 730070; 2. 西藏自治區農牧科學院草業科學研究所, 西藏 拉薩 850000)
藏沙蒿(Artemisiawellbyi),隸屬于菊科(Compositae)蒿屬(Artemisia)植物,是一種多年生半灌木草本植物[1-2],主要分布在西藏氣候寒冷、紫外線輻射強度大、空氣稀薄和降水量少的高山草原、草甸以及荒漠地區[3]。因自然選擇和物種的適應性,藏沙蒿種質在防風固沙、草原退化修復和草原生態功能維持等方面具有重要作用[4]。藏沙蒿植株粗脂肪、粗蛋白含量高,分別為4.50%,13.19%,常被用作牧區飼用牧草[5]。因此,其作為西藏特有物種,在當地植被組成中占有非常重要的地位[6]。然而,青藏高原獨特的地理環境、氣候條件和脆弱的生態系統對藏沙蒿種子的萌發和生長繁殖起到一定的限制作用[7]。種子萌發是植物生長的重要過程之一,但其休眠機制在很大程度上阻礙了種子的萌發。菊科植物種子大多屬于非深度生理休眠[8],且多數荒漠蒿屬植物種子表面附有一層粘液,可能含有抑制種子萌發的物質,造成種子發芽率不高、出苗不規律等情況[9-11]。野生藏沙蒿種子也存在同樣問題,進而影響其成為生態草在科研及人工草地建植中的應用。研究表明,使用GA3,IAA等外源激素KNO3,H2O2,KMnO4、濃H2SO4等化學試劑、微量元素和溫水等方法浸種能夠軟化種子種皮,激發種子內部代謝活動和生理效應,促進種子對水分的吸收能力,抑制或破壞阻礙植物種子萌發的相關物質,打破種子的休眠,從而達到促進種子萌發的作用[12-17]。此外,PEG-6000是一種高分子滲透調節劑,其本身作為高分子化合物不能進入種子細胞中,但能夠參與種子細胞中的生理代謝過程,有報道縮短藜麥(Chenopodiumquinoa)[18]、紫花苜蓿(Medicagosativa)[19]種子的發芽時間,提高種子的活力的作用。
目前,對于藏沙蒿種質的研究多集中在分布區域調查、營養成分以及藥用價值等方面[20],在藏沙蒿種子休眠機制和打破休眠方法的研究上未見報道。鑒于此,本試驗以西藏野生藏沙蒿種子為試驗材料,研究不同濃度激素、化學試劑、不同溫度溫水浸種以及不同濃度PEG-6000,H2O2溶液浸泡濾紙等7種方法處理對藏沙蒿種子萌發的影響,通過對萌發指標的測定,運用隸屬函數綜合評價篩選出打破休眠的最佳處理方法,明晰不同處理對藏沙蒿種子萌發的影響,為提高藏沙蒿種子的萌發率以及培育優異種質提供一定理論依據。
1 材料與方法
1.1 試驗材料
藏沙蒿種子與2020年10月采自西藏拉孜縣彭措林鄉(29°12′N,88°18′E)海拔3 577 m地區,采集后室內自然風干,去除雜質,保存于紙質種子袋中,常溫(20℃~25℃)避光儲藏。藏沙蒿種子呈長橢圓、倒卵形,種子顏色為灰褐色至黑色,長約0.868 mm,寬約0.700 mm,長寬比約1.243,千粒重在0.201 g左右,其表層具有黏液。
1.2 試驗方法
選取籽粒飽滿、大小均一的藏沙蒿種子,10%的NaClO溶液浸泡3 min,蒸餾水沖洗3~4次,晾干。將消毒后的種子放置于裝有KNO3,GA3,IAA、微量元素水溶肥料(P2O5≥266 g·L-1,Mn=25 g·L-1,Zn=50 g·L-1,Cd≤10 mg·kg-1,Pb≤50 mg·kg-1,Hg≤5 mg·kg-1,Cr≤50 mg·kg-1,S≤30 g·L-1,Cl≤30 g·L-1等)各濃度溶液和不同溫度溫水的試管中浸泡12 h(溫水浸種采用水浴鍋恒溫加熱法),再次風干,浸種時以溶液浸沒種子為標準。H2O2,PEG-6000處理使用浸泡濾紙法,以溶液浸透濾紙為標準。以蒸餾水為對照。每個方法各設置3個處理,每一處理4次重復,共22個處理(見表1)。
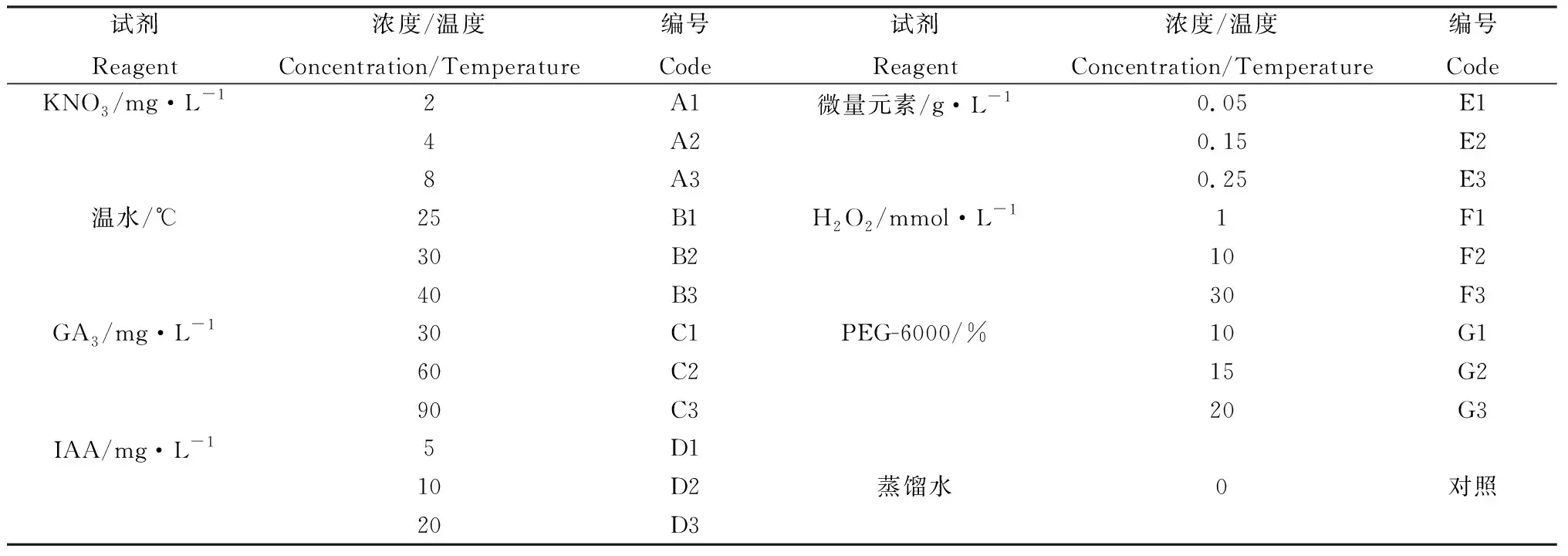
表1 試驗處理和編號Table 1 Test treatment and number
浸種結束后,每一重復對應選取處理的50粒藏沙蒿種子放置于直徑10 cm、鋪有2層濾紙的發芽盒中,后加入7 mL蒸餾水,并稱重,記為原始質量M。將發芽盒放置于25℃恒溫光照培養箱(光暗周期為12 h/12 h)培養。培養期間每天稱取發芽盒質量以補充失去的水分。H2O2,PEG-6000溶液處理定期更換發芽盒中浸泡的濾紙。從培養第2 d開始,每隔1 d統計種子發芽數,并觀察種子的萌發情況,若種子連續3 d不再發芽視為萌發結束,并測定各項萌發指標。
1.3 測定指標
參照《青蒿種子檢驗規程研究》[21]進行以下種子萌發指標的計算:
發芽率=發芽結束時發芽的種子數/供試種子總數(50)×100%;
相對發芽率=各方法處理下種子的發芽率/對照組發芽率×100%;
發芽勢=發芽高峰期發芽的種子數/供試種子總數×100%;
相對發芽勢=各方法處理下種子的發芽勢/對照組發芽勢×100%;
發芽指數(GI)=∑(Gt/Dt);
活力指數(VI)=GI×S;
式中,Gt為第t日的發芽數,Dt為相應發芽天數;S為平均幼苗長度;
根長:每個發芽盒中選出10株幼苗利用直尺測定從根基部到根尖測定的長度;
相對根長=各方法處理下幼苗根長/對照組幼苗根長×100%;
芽長:每個發芽盒中選出10株幼苗利用直尺測定幼苗從根基部到幼苗最高部位的長度;
相對芽長=各方法處理下幼苗芽長/對照組幼苗芽長×100%;
1.4 綜合評價方法
運用隸屬函數法進行綜合評價篩選,隸屬函數計算公式為:
X(a)=(X-Xmin)/(Xmax-Xmin)
X(b)=1-(X-Xmin)/(Xmax-Xmin)
其中,X為試驗不同處理下藏沙蒿種子某一指標的測定值,Xmax,Xmin分別為測定指標的最大值和最小值。如果某一指標與促進萌發指標呈現負相關,則可以通過反隸屬函數計算隸屬函數值。
將各方法處理下藏沙蒿測定萌發指標的隸屬函數值累加求其平均值,根據平均隸屬函數值的大小來確定促進種子萌發的強弱,平均隸屬函數值越大,說明促進種子萌發作用越強,反之越弱[22]。
1.5 數據分析
試驗數據用SPSS 25.0軟件進行統計分析,采用單因素方差分析檢驗不同處理對藏沙蒿萌發指標的影響,用Duncan法對不同處理的平均值進行多重比較,顯著性水平α為0.05;采用Microsoft Excel 2019進行數據整理和繪圖。
2 結果與分析
2.1 不同方法對藏沙蒿種子相對發芽率、相對發芽勢、相對根長、相對芽長的影響
由表2可知,不同浸種處理方法對打破藏沙蒿種子休眠有一定差異。A1~A3,隨KNO3浸種濃度的升高,對藏沙蒿種子的相對發芽率呈先抑制后促進的變化趨勢。A1,A2濃度浸種下抑制藏沙蒿種子萌發,僅A3濃度的KNO3浸種對藏沙蒿種子萌發起到促進作用,相對發芽率、相對根長分別提高7.14%,40.98%,此濃度下相對發芽勢與對照差異不顯著,且對相對芽長起到抑制效果,說明高濃度的KNO3浸種對藏沙蒿萌發中根的伸長有重要作用。
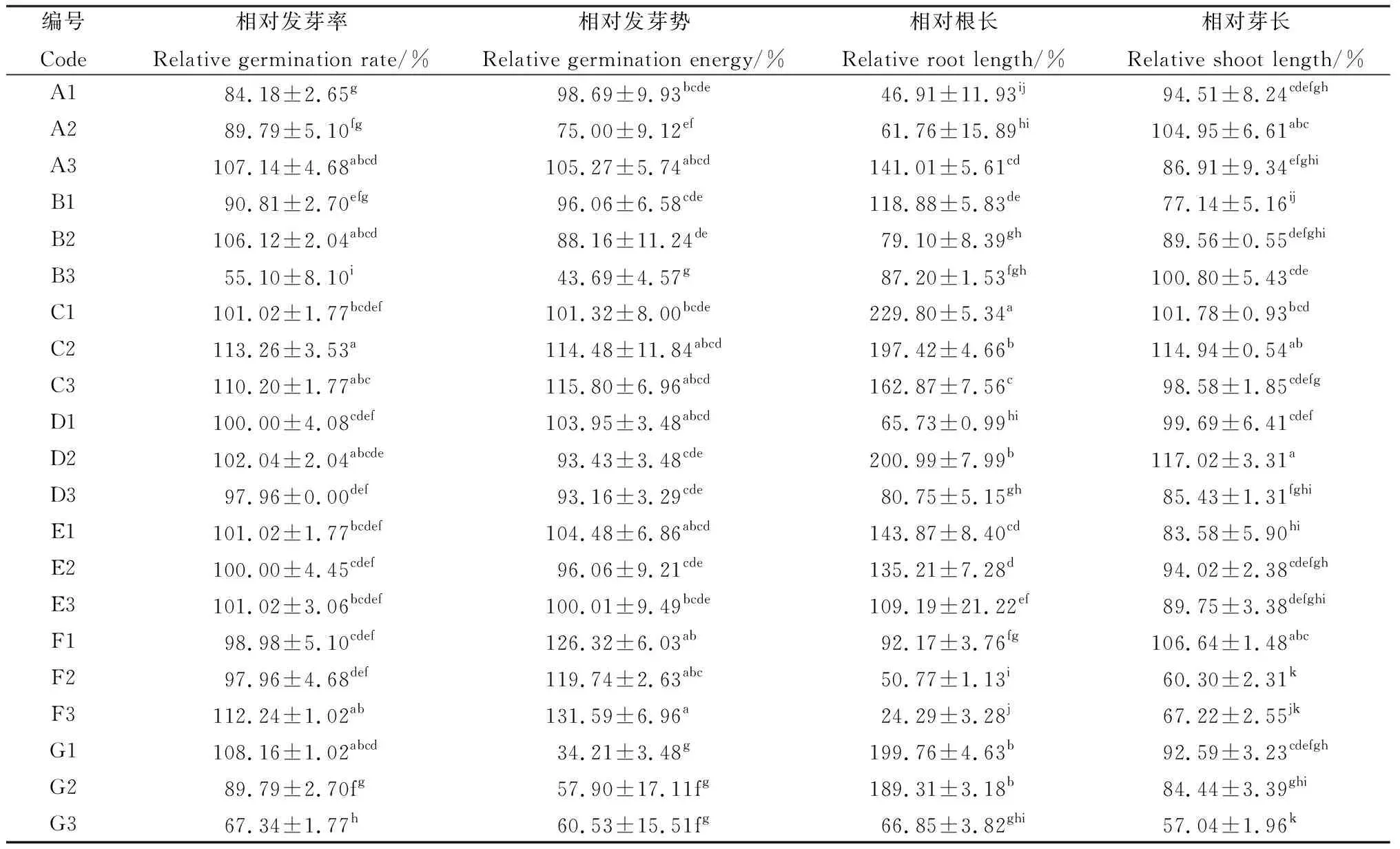
表2 不同處理下藏沙蒿種子的相對發芽率、相對發芽勢、相對根長、相對芽長變化Table 2 Changes of relative germination rate,relative germination potential,relative root length and relative bud length of Artemisia wellbyi seeds under different treatments
一般來說,溫水浸種處理能夠軟化種子種皮,但不同溫度的溫水浸種下對種子萌發影響不同。本研究結果表明,溫度過高或過低對藏沙蒿種子的萌發具有一定程度的抑制,B1浸種能夠促進藏沙蒿幼苗根的生長,但卻抑制芽的生長;僅B2浸種對藏沙蒿種子相對發芽率提高6.12%,是促進藏沙蒿種子萌發的最佳浸種溫度,但此溫度下其相對發芽勢較低,說明溫水軟化種皮需要一定時間。
GA3和IAA是兩種常見的促進種子萌發的激素,比較而言,GA3對于藏沙蒿種子的萌發促進作用較顯著。C1~C3,GA3濃度在30~90 mg·L-1范圍內,藏沙蒿種子相對發芽率整體呈現上升趨勢,其中C2,C3濃度的GA3浸種處理對其相對發芽率促進效果較對照更加顯著(P<0.05),其相對發芽率為113.26%,110.20%,分別較對照提高了13.26%,10.20%。尤其是C2濃度GA3浸種處理下藏沙蒿的出苗率整齊、根芽較長,幼苗生長強壯。C3濃度處理下藏沙蒿幼苗相對芽長的變化規律較對照不明顯,其他指標與C2濃度的變化規律相一致;D1~D3,IAA浸種對藏沙蒿相對發芽率、相對發芽勢的促進作用較對照不明顯,且高濃度(≥D2)下有抑制效果。但D2濃度IAA浸種能夠顯著促進藏沙蒿幼苗相對根芽的伸長(P<0.05)。
不同濃度微量元素E1~E3浸種對藏沙蒿種子相對發芽率、相對發芽勢的影響差異不顯著。E1微量元素濃度浸種處理,對藏沙蒿幼苗的相對根長促進效果較為顯著(P<0.05),相比對照提高43.72%。隨微量元素浸種濃度的升高,對其促進作用呈現下降趨勢。
藏沙蒿種子的相對發芽率在低濃度(≤F2)的H2O2(F1~F3)處理下降低,高濃度(≥F3)下升高,但不同濃度H2O2處理對藏沙蒿種子發芽勢的促進作用均有明顯提高。F3處理對藏沙蒿種子相對發芽率、相對發芽勢分別提高12.24%,31.58%(P<0.05),說明高濃度H2O2能夠促進藏沙蒿種子出苗的整齊度,但對藏沙蒿植株相對根長和相對芽長的伸長較對照具有顯著的抑制作用,隨H2O2濃度升高,抑制效果越明顯(P<0.05)。
隨PEG-6000 濃度G1~G3的升高,對藏沙蒿種子相對發芽率的影響呈現低濃度(≤G1)促進,高濃度(≥G2)抑制的變化趨勢。相比對照,G1濃度浸泡濾紙下藏沙蒿種子的發芽率提高了8.16%,根長提高了2倍,而發芽勢降低了65.78%。這表明G1濃度PEG-6000溶液處理能夠提高藏沙蒿種子的發芽率的同時卻抑制發芽勢,導致藏沙蒿出苗整齊度不高。

圖1 各方法處理下藏沙蒿種子萌發狀態Fig.1 Germination of Artemisia wellbyi seeds treated by each method

圖2 GA3,KNO3,H2O2處理下藏沙蒿種子萌發幼根、幼芽狀態Fig.2 Germination of young roots and buds of Artemisia wellbyi seeds treated with GA3,KNO3 and H2O2
2.2 不同處理在不同濃度下對藏沙蒿種子各萌發指標的影響
從表3雙因素方差分析結果可以看出,不同處理方法對藏沙蒿的發芽率、發芽勢、發芽指數、平均發芽時間、根長以及芽長等指標的影響均達到極顯著(P<0.01);不同處理方法的不同濃度對藏沙蒿種子發芽勢的影響不顯著,對其他指標的影響顯著;且不同處理方法和不同濃度的交互作用對藏沙蒿種子各萌發指標的影響均表現為顯著(P<0.05)。從F值大小可以看出,不同處理方法對藏沙蒿種子各

表3 不同處理方法和不同濃度對藏沙蒿種子各指標影響的雙因素方差分析Table 3 Two factor analysis of variance on the effects of different treatment types and concentrations on the germination indexes of Artemisia wellbyi seeds
萌發指標的影響比濃度最為重要。
2.3 不同方法對藏沙蒿種子發芽指數的影響
由圖3可知,A1~A3,隨著KNO3濃度的升高,藏沙蒿種子發芽指數呈先降低后升高的變化趨勢。B1~B3,隨浸種水溫的升高,對藏沙蒿種子發芽指數整體表現為抑制作用,B3溫度下的發芽指數較對照降低了63.04%,抑制效果顯著(P<0.05)。C1~C3,D1~D3,隨GA3和IAA浸種濃度的升高,對藏沙蒿種子發芽指數的影響整體呈現上升趨勢。E1~E3,不同濃度的微量元素浸種對藏沙蒿種子發芽指數影響不規律,E1微量元素浸種對藏沙蒿種子發芽指數起到促進效果,較對照提高18.78%。F1~F3,H2O2浸泡濾紙對藏沙蒿種子發芽指數較其他處理相比促進作用最為顯著(P<0.05),較高濃度H2O2處理對藏沙蒿種子發芽指數較對照有所升高,F2,F3濃度的H2O2浸泡濾紙對藏沙蒿種子的發芽指數較對照相比分別增加了43.97%,41.44%,且差異顯著(P<0.05)。G1~G3,G1對藏沙蒿種子發芽指數較對照有一定促進作用,提高了34.36%,而隨PEG-6000溶液濃度的升高,藏沙蒿種子發芽指數明顯受到抑制。
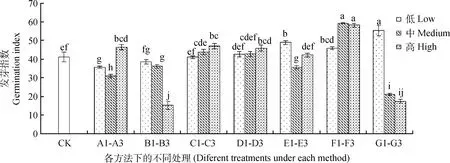
圖3 不同方法處理下的藏沙蒿種子發芽指數Fig.3 Germination index of Artemisia wellbyi seeds treated with different methods注:不同小寫字母表示不同處理間差異性顯著(P<0.05)Note:Different small letters indicate significant differences among different treatments at the 0.05 level
2.4 不同方法對藏沙蒿種子活力指數的影響
由圖4可知,對藏沙蒿種子活力指數起到明顯促進作用的為C1~C3的GA3各濃度,且激素浸種處理對藏沙蒿種子活力指數的影響具有統計學差異。C1,C2,C3濃度的GA3和D2濃度的IAA浸種顯著提高藏沙蒿種子的活力指數(P<0.05),較對照分別提高了125.77%,113.46%,90.21%,112.96%,且隨GA3濃度的升高,對藏沙蒿種子活力指數的促進效果逐漸降低。A1,A2濃度的KNO3浸種對藏沙蒿種子活力指數較對照相比起到明顯的抑制作用,但A3濃度KNO3浸種對藏沙蒿種子活力指數相比于對照提高了62.48%,起到明顯促進作用(P<0.05)。溫水浸種對藏沙蒿種子活力指數促進效果不顯著,且B3溫度的溫水浸種對藏沙蒿種子活力指數起到顯著抑制作用(P<0.05)。隨E1~E3,F1~F3,G1~G3處理濃度的升高,藏沙蒿種子的活力指數呈現逐漸下降趨勢,其中,E1微量元素浸種對藏沙蒿種子活力指數起到顯著促進作用,較對照增加73.73%。
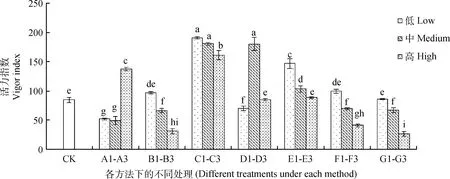
圖4 不同方法處理下藏沙蒿種子活力指數Fig.4 Seed vigor index of Artemisia wellbyi treated with different methods
2.5 不同方法對藏沙蒿種子平均發芽時間的影響
由圖5可知,與對照相比,A1,A2,A3,B3,C3,D1,F1,F2,F3,G1處理下能夠顯著降低藏沙蒿種子的平均發芽時間(P<0.05),F處理對藏沙蒿種子平均發芽時間的降低最為顯著(P<0.05)。G2,G3處理下平均發芽時間高于對照,說明對藏沙蒿種子的發芽能力有降低趨勢。其余處理下藏沙蒿種子的平均發芽時間較對照相比差異不顯著。

圖5 不同方法處理下藏沙蒿種子平均發芽時間Fig.5 The average germination days of Artemisia wellbyi seeds treated with different methods
2.6 不同方法下藏沙蒿種子萌發的綜合評價
利用多個指標來綜合性評價打破藏沙蒿種子休眠方法的篩選可以降低單一指標的片面性[23]。本研究以各方法處理下測定的發芽率、發芽勢、活力指數、發芽指數、平均發芽時間、芽長、根長等作為打破藏沙蒿種子休眠方法綜合評價的指標,通過計算不同方法處理下各指標的隸屬函數值并計算平均值進行排序。由表4得出,(C2) 60 mg·L-1GA3,(C3)90 mg·L-1GA3處理下的綜合隸屬函數值高達0.822,0.763,是打破藏沙蒿種子休眠的較為適宜的方法。

表4 各處理對藏沙蒿種子萌發指標隸屬函數值和綜合評價Table 4 Subjection function values and comprehensive evaluation of each germination index of Artemisia wellbyi seeds under each treatment
3 討論
3.1 激素浸種處理對藏沙蒿種子萌發的影響
GA3和IAA是兩種常用的促進種子萌發的外源生長調節物質,利用GA3和IAA浸種能夠有效打破種子休眠[24]。本研究結果發現,GA3浸種12 h能夠有效提高藏沙蒿種子發芽力,提高其活力指數、發芽指數和萌發速度,促進根芽的生長。隨GA3濃度的增大,對藏沙蒿種子相對發芽率的促進作用呈現先升高后降低的變化趨勢。總體來看,60 mg·L-1GA3浸種(C2)打破休眠的效果最佳。杜芳等[25]研究發現80 mg·L-1GA3對黑心菊種子萌發效果較好。分析原因可知,GA3浸種能夠提高種子內a-淀粉酶等多種相關水解酶的活性,這些水解酶將種子胚乳中的貯藏物質分解為非結構性碳水化合物,為種子萌發提供能量和其他養分[26];而高濃度GA3浸種反而會使淀粉酶活性降低,減慢分解淀粉的速度,也會損傷種子的滲透調節系統,從而降低種子萌發[27]。激素IAA浸種對打破藏沙蒿種子的休眠有一定的促進效果,但相比GA3促進效果較弱。向亮等[28]研究發現,1.5 mg·L-1IAA溶液浸種處理翅堿蓬(Suaedasalsa)種子12 h,其發芽率和萌發速率分別提高了17.65%和136.84%,這與本研究中10 mg·L-1IAA浸種12 h(D2)提高藏沙蒿種子的效果類似,但不同植物對于激素的適應濃度有差異。IAA浸種可以誘導和促進植物細胞的分化,參與植物同化物的運輸,打破休眠,促進種子萌發[29]。然而,激素對種子的萌發和細胞的生長具有兩重性,低濃度促進植物細胞生長,高濃度會抑制植物細胞生長[30]。
3.2 幾種試劑處理對藏沙蒿種子萌發的影響
試驗采用不同濃度KNO3、微量元素、PEG-6000,H2O2處理藏沙蒿種子對其萌發指標表現出不同程度的差異。低濃度(≤4 mg·L-1)KNO3浸種對藏沙蒿種子的萌發起到抑制作用,可能是KNO3濃度過低對種子的代謝過程和滲透調節物質的影響較小,不足以打破休眠。8 mg·L-1KNO3浸種(A3)對藏沙蒿種子相對發芽率、活力指數以及相對根的伸長較對照具有不同程度的促進效果,主要在于KNO3作為強氧化劑,能夠提供氧氣加速細胞代謝,同時KNO3也作為營養物質被種子吸收,為種子萌發提供充足養分[31],KNO3中K+是植物體內多種酶的激活劑,可以提高種子內部脫氫酶的活性,促進植株體內有機化合物的合成及運輸[32-33],從而打破植物種子休眠,促進萌發。3種不同濃度微量元素浸種對藏沙蒿種子萌發率的影響較對照差異不顯著,但卻能提高種子的活力指數,促進根的生長,說明低濃度微量元素能夠增加種子的新陳代謝,磷、硫、錳、鋅、銅、鉬等多種功能元素能夠迅速進入種子內部,為種子萌發提供充足的營養元素,提高種子活力[34],促進胚芽、胚根的生長。本研究中10%PEG-6000溶液浸泡濾紙能夠顯著提高藏沙蒿種子的發芽率,但隨PEG-6000濃度的升高,對藏沙蒿種子的萌發指標以及萌發速度均表現出不同程度的抑制作用,這可能由于低濃度PEG-6000溶液能夠開啟種子的自我保護機制,減少種子吸脹過程中膜系統的損傷,提高種子發芽率[35]。而當PEG-6000濃度超過一定值時,對種子的萌發能力起到一定程度的限制作用,細胞內自由基過度積累,對膜系統完整性造成損傷,使滲透調節功能紊亂,抑制了種子的萌發能力[36-37];馮瀟[38]研究發現10 mmol·L-1的H2O2浸泡會抑制白沙蒿種子的萌發,50 mmol·L-1的H2O2可以促進其萌發。本研究中30 mmol·L-1H2O2處理能夠顯著提高藏沙蒿種子的相對發芽率和相對發芽勢,但嚴重抑制根的伸長。說明H2O2作為一種信號分子來參與植物的多種生理過程,對于維持植物細胞內氧化還原平衡具有重要作用[39]。此外,H2O2溶液偏酸性,一定濃度下可以軟化種子種皮,有利于營養物質進入種子內部[40];其次,H2O2能夠對種子表面起到殺菌消毒的作用,抑制表面細菌的生長,從而打破種子休眠[41]。
3.3 溫水浸種處理對藏沙蒿種子萌發的影響
溫水浸種是最為簡便和節約成本的促進種子萌發的方法。本研究中,30℃溫水浸種12 h對藏沙蒿種子相對發芽率較對照有一定促進作用,隨浸種溫度的升高,對藏沙蒿種子的萌發起到明顯抑制效果。說明30℃溫水是藏沙蒿種質較為適宜的浸種溫度,能夠打破種子休眠,提高發芽質量[42]。浸種溫度越高,對種子種皮軟化程度和透性增強,使得高溫度的水分進入種子內部,對種胚造成傷害,降低種子的萌發率[43]。且溫度過低或過高會影響種子酶的活性,從而抑制種子萌發[44]。有研究表明,金光菊(Rudbeckialaciniata)[45]、沙生針茅(Stipaglareosa)[46]種子分別在50℃,60℃溫水浸種下發芽率最好,說明不同材料的種子對溫水浸種的溫度適應具有差異性。
3.4 打破藏沙蒿種子休眠的生態學意義
本研究得出60 mg·L-1GA3濃度浸種藏沙蒿種子其發芽率較對照提高13.26%,這在西藏以藏沙蒿為先鋒植物的生態環境治理和恢復中具有很高的實用價值,對于改善沙化引起的青藏高寒草地持續退化和生產力不斷下降的問題,以及青藏高原高寒草甸地區群落豐富度構建、西藏荒漠地區生態恢復具有生態意義。
4 結論
本研究采用不同溫度的溫水,不同濃度硝酸鉀、赤霉素、吲哚乙酸、微量元素浸種以及不同濃度過氧化氫、聚乙二醇溶液浸泡濾紙等7種方法處理藏沙蒿種子,初步明晰了不同方法處理對藏沙蒿種子萌發及打破休眠的影響規律,并通過模糊隸屬函數法綜合評價得出30 mg·L-1,60 mg·L-1,90 mg·L-1赤霉素,10 mg·L-1吲哚乙酸浸種處理藏沙蒿種子12 h能夠明顯提高藏沙蒿種子各萌發指標,打破藏沙蒿種子休眠,有效促進藏沙蒿種子萌發,為后期培育優質藏沙蒿幼苗提供理論基礎和研究依據。

