雞IL-2和IL-4融合基因真核表達質粒的構建及其表達產物的生物學活性
徐 彤 , 貢 鑫 , 鄭明學 , 呂曉玲 , 鄭龍龍 , 崔凱玲 , 張雪松 , 段步婷 , 白 瑞
(山西農業大學動物醫學學院 , 山西 太谷 030801)
雞球蟲病是一種危害性較大的腸道寄生蟲病[1],每年給養殖業帶來巨大損失。目前,對雞球蟲病防治的手段主要是化學藥物和活疫苗,而藥物防治存在藥物殘留、免疫抑制和耐藥性問題,活疫苗的免疫產生期長且影響雛雞增重。因此,高效免疫預防雞球蟲病成為一個熱門研究課題。隨著生物技術的不斷發展,融合細胞因子作為一種新的疫苗免疫佐劑成為可能[2]。白介素2(Interleukin 2,IL-2)在免疫系統中具有上調免疫應答的作用,使得免疫產生時間縮短。白介素4(Interleukin 4,IL-4)能夠增強單核細胞的抗原遞呈能力從而縮短抗體產生時間[3]。許多研究發現,表達2種不同細胞因子的融合蛋白具有免疫佐劑的作用。目前國內外尚無IL-2和IL-4融合基因佐劑。因此本試驗構建雞IL-2(Chicken interleukin 2,chIL-2)和雞IL-4 (Chicken interleukin 4,chIL-4)融合基因真核表達質粒,以期為研究新型細胞因子免疫佐劑夯實基礎。
1 材料與方法
1.1 菌株、質粒及動物 大腸桿菌DH5α和pCI質粒,均為本實驗室保存;pEGFP-N3質粒,購自上海瓦蘭生物科技有限公司;15日齡SPF雞胚,購自北京勃林格殷格翰維通生物技術有限公司。
1.2 主要試劑 QuickCutTMEcoR I、QuickCutTMSalI、QuickCutTMKpnI、QuickCutTMNotI、DNA Ligation Kit、PrimeScriptTMRT Reagent Kit和SYBR?PremixExTaqTMGC,均購自寶日醫生物技術(北京)有限公司;SanPrep無內毒素質粒DNA小量抽提試劑盒和柱式DNA膠回收試劑盒,均購自生工生物工程(上海)股份有限公司;MTT試劑盒,購自上海索萊寶生物科技有限公司;HilyMax,購自上海同仁化學研究所。
1.3 試驗方法
1.3.1chIL-4與chIL-2基因合成 根據GenBank中chIL-4(453 bp)基因序列(AJ621249.1)加EcoR I和KpnI酶切位點,下游去終止密碼子TGA并加Linker序列;根據GenBank中chIL-2基因(429 bp)序列(AF000631.1),加KpnI和SalI酶切位點,去終止密碼子TAA。由生工生物工程(上海)股份有限公司合成重組克隆質粒pUC57-ChIL-4和pUC57-ChIL-2。
1.3.2 重組克隆質粒和真核表達質粒的雙酶切、回收與鑒定 按QuickCutEcoR I和QuickCutKpnI說明書,將pUC57-ChIL-4重組質粒和pCI雙酶切,瓊脂糖凝膠電泳鑒定,膠回收pCI(約4 000 bp) 和ChIL-4的目的條帶;同樣方法雙酶切與鑒定pUC57-ChIL-2和pCI,膠回收pCI與ChIL-2的目的條帶。
1.3.3 連接與轉化 按DNA Ligation Kit說明書進行連接反應,雙酶切后的pCI分別與IL-4和IL-2片段按摩爾比3∶1混合為10 μL體系;加等體積Ligation Mix混勻,16 ℃ 30 min;轉化并增菌培養;按SanPrep無內毒素質粒DNA小量抽提試劑盒說明書提取質粒pCI-chIL-4和pCI-chIL-2。
1.3.4chIL-2連接至pCI-chIL-4質粒 按QuickCutKpnI和QuickCutSalI說明書雙酶切pCI-chIL-4,瓊脂糖凝膠電泳鑒定,膠回收約4 459 bp目的條帶;pCI-chIL-4與chIL-2基因片段連接與轉化同1.3.3項,獲得pCI-chIL-4-chIL-2重組質粒。
1.3.5 pCI-chIL-2、pCI-chIL-4、pCI-chIL-4-chIL-2質粒上連接增強綠色熒光蛋白(EGFP)基因 按QuickCutKpnI和QuickCutNotI說明書雙酶切pCI-chIL-4和pEGFP-N3,瓊脂糖凝膠電泳鑒定;同樣方法雙酶切、鑒定及膠回收pCI-chIL-2、pCI-chIL-4-chIL-2、pEGFP-N3;pCI-chIL-4-chIL-2、pCI-chIL-4、pCI-chIL-2分別與EGFP基因連接、轉化并提取質粒DNA,方法同1.3.3項。將構建的質粒送至深圳華大基因公司測序。
1.3.6 細胞轉染與真核細胞表達 將原代雞胚盲腸上皮細胞以3×105個/mL接種于24孔板中,41 ℃、 8% CO2培養箱培養;貼壁率達80%~90%時,將細胞分為5個組:空白組(A0,不加pCI、Opti-MEM培養基、HilyMax)、空載組(A1)、pCI-chIL-2-EGFP組(A2)、pCI-chIL-4-EGFP組(A3)和pCI-chIL-4-chIL-2-EGFP組(A4),每組16個孔。其中A1~ A4組分別添加相應質粒 16 μg、Opti-MEM培養基480 μL、HilyMax 48 μL,孵育4 h;在24、48、72 h和96 h檢測轉染率、轉染細胞chIL-4、chIL-2基因mRNA表達量、細胞內蛋白表達量和細胞培養液中融合蛋白表達量。
(1)轉染率:熒光細胞數占活細胞總數的百分比。
(2)chIL-4、chIL-2基因mRNA表達量測定:按SYBR?PremixExTaqTMGC說明書進行實時熒光定量PCR(RT-qPCR),用Primer 3軟件設計引物,由生工生物工程(上海)股份有限公司合成。引物序列:雞IL-4(156 bp):F 5′-AGCCAGCACTGCCACAAGAAC-3′, R 5′-GTGGAAGAAGGTACGTAGGTC TGC-3′;雞IL-2(155 bp):F 5′-AGTGCACCCAGCAAACTCTG-3′, R 5′-TCCGGTGTGATTTAGACCC GT-3′;雞β-actin(135 bp):F 5′-CACCACAGCCGAGAGAGAAAT-3′, R 5′-TGACCATCAGGGAGTTCATAGC-3′。反應體系:SYBR?PremixExTaqII(Tli RNaseH)(2×) 10 μL、PCR Forward Primer(10 μmol/L) 0.4 μL、PCR Reverse Primer(10 μmol/L) 0.4 μL、ROX Reference Dye II(50×) 0.4 μL、cDNA溶液(Template) 2 μL、ddH2O 6.8 μL,共20 μL;反應程序:95 ℃ 30 s,1個循環;95 ℃ 5 s,60 ℃ 34 s,40個 循環。雞β-actin基因為內參,RT-qPCR結果用2-ΔΔCt方法計算目的基因的相對表達量。
(3)細胞內蛋白表達量:采用Image-Pro Plus. v 6.0軟件測量熒光細胞累積光密度(IOD)。
(4)細胞培養液中融合蛋白表達量:按芮琴[4]的方法用熒光分光光度計(激發波長、發射波長分別為460 nm、509 nm)測定各時間段細胞上清的熒光強度。
1.3.7 表達產物的生物學活性鑒定 按范忠玲[5]的方法測定表達產物對淋巴細胞增殖活性的影響。取37 ℃、5% CO2培養箱中培養48 h的雞脾淋巴細胞懸液,接種于96孔板中,細胞密度為5×103個/μL,50 μL/孔。試驗分為6個組(每組5個孔),分別為空白組(C,無細胞僅含RPMI 1640培養基的對照)、細胞陰性對照組(C0)、試驗組(B1~B4)。分組后,B1~B4組再分別添加1.3.6項A1~A4組轉染后各時間段細胞上清液50 μL/孔,空白組(C)和細胞陰性對照組(C0)加DMEM培養基50 μL/孔,繼續培養36 h。MTT法檢測各組細胞活性,計算刺激指數(SI)。

2 結果
2.1 pUC57-chIL-4和pUC57-chIL-2重組質粒鑒定 pUC57-chIL-4重組質粒雙酶切得到約453 bp和2 700 bp 的條帶,pUC57-chIL-2重組質粒雙酶切得到約429 bp和2 700 bp的條帶,與預期一致,見圖1。
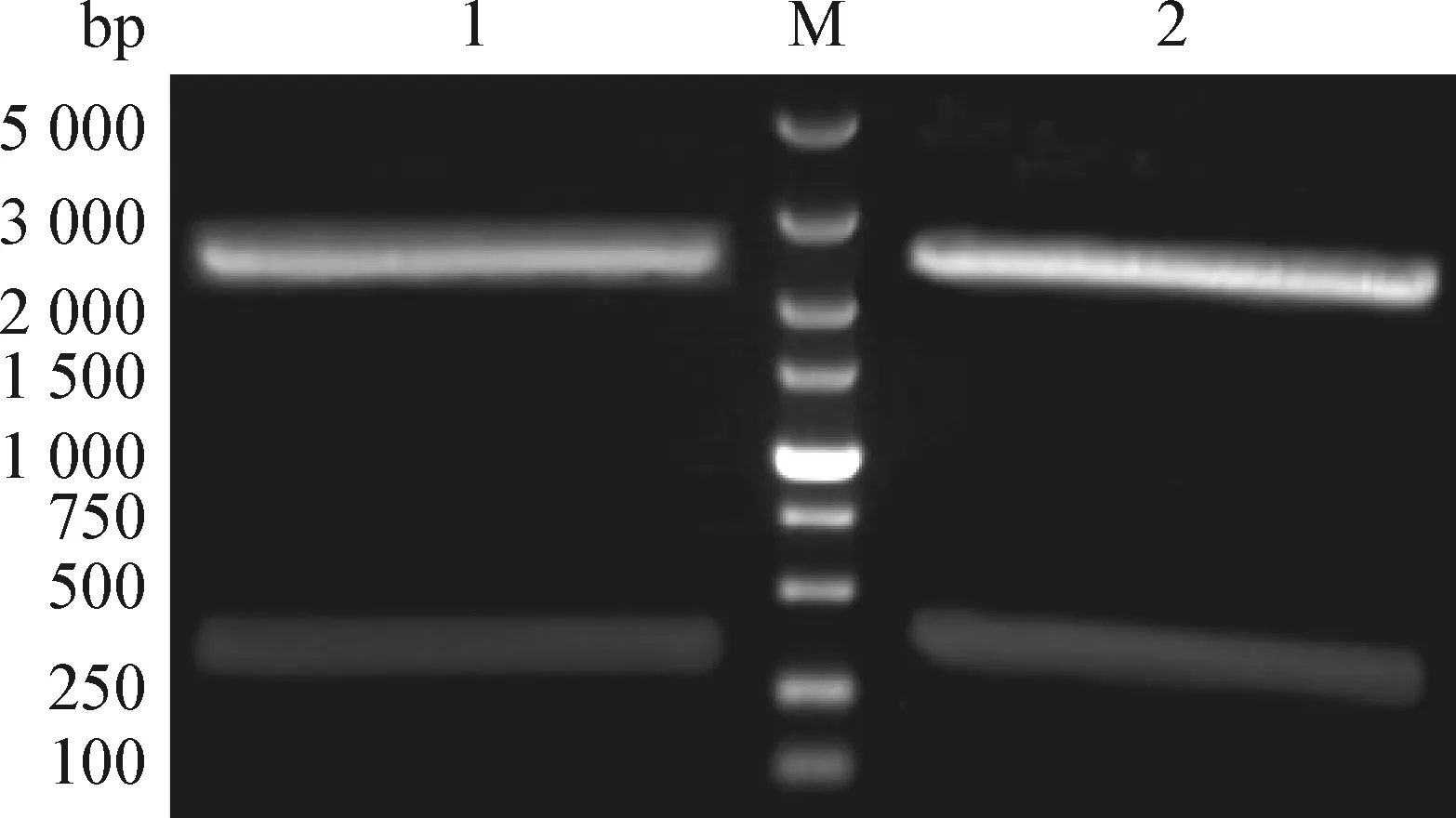
圖1 pUC57-chIL-4和pUC57-chIL-2雙酶切電泳圖
2.2 pCI-chIL-4、pCI-chIL-2和pCI-chIL-4-chIL-2重組質粒鑒定 重組質粒pCI-chIL-4可酶切得到約453 bp 和4 000 bp的條帶,pCI-chIL-2可酶切得到約429 bp 和4 000 bp的條帶,重組質粒pCI-chIL-4-chIL-2可酶切得到約4 000 bp和888 bp的條帶,符合預期結果(圖2)。
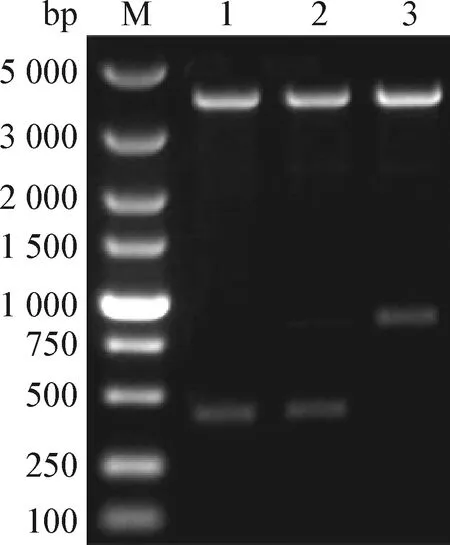
圖2 pCI-chIL-4-chIL-2、pCI-chIL-2和pCI-chIL-4雙酶切電泳圖
2.3 pCI-chIL-4-EGFP、pCI-chIL-2-EGFP和pCI-chIL-4-chIL-2-EGFP重組質粒鑒定 重組質粒pCI-chIL-4-EGFP可酶切得到約770 bp和4 400 bp的條帶,重組質粒pCI-chIL-4-chIL-2-EGFP可酶切得到約770 bp和4 900 bp的條帶,重組質粒pCI-chIL-2-EGFP可酶切得到約770 bp和4 400 bp的條帶,初步證實質粒構建成功(圖3)。
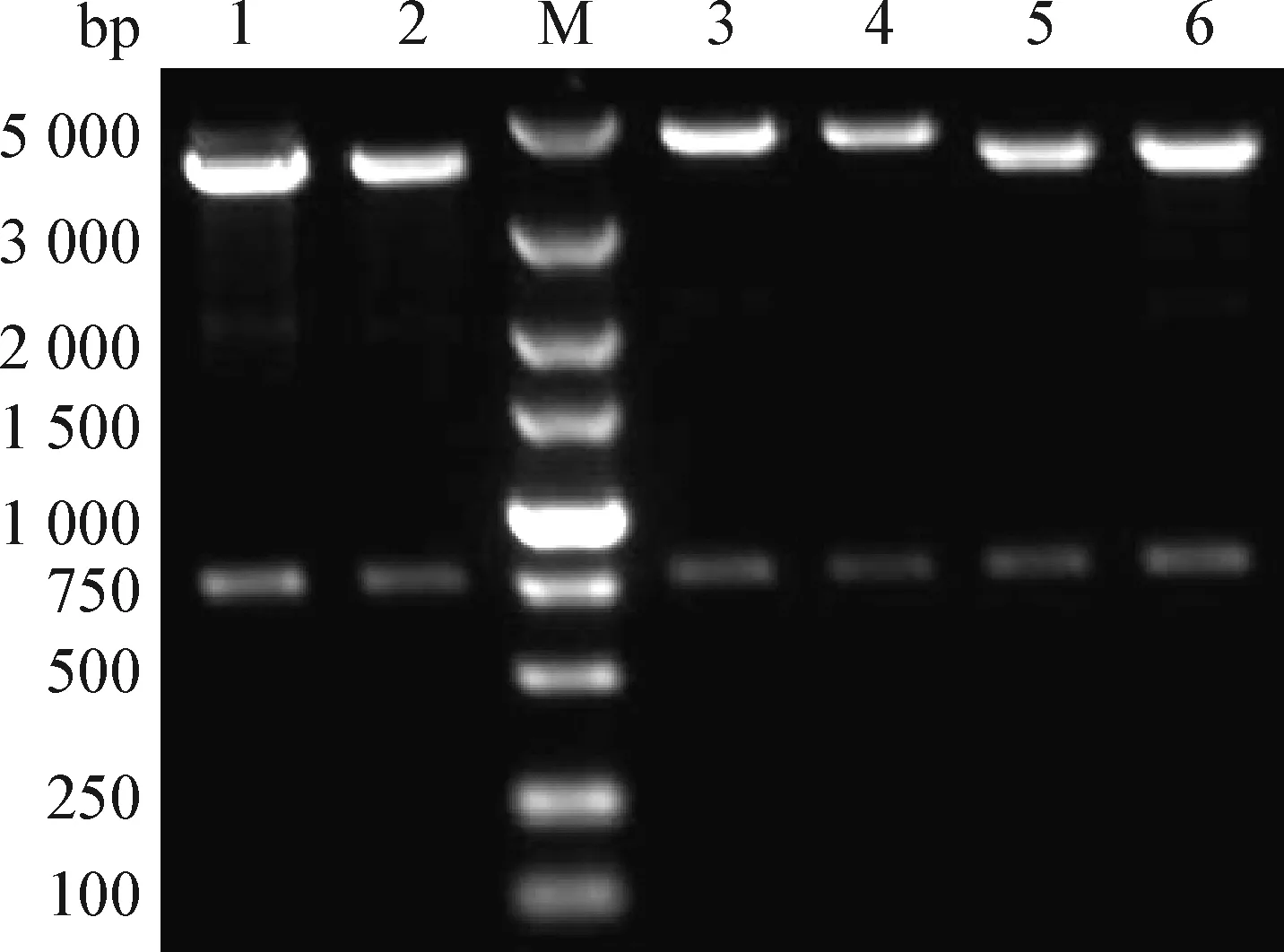
圖3 pCI-chIL-4-chIL-2-EGFP、pCI-chIL-2-EGFP和pCI-chIL-4-EGFP雙酶切電泳圖
測序結果用NCBI BLAST與GenBank中發表的EGFP、chIL-2、chIL-4基因序列進行比對,發現基因序列匹配度100%,符合預期結果。
2.4 雞胚盲腸上皮細胞轉染效果及表達效果
2.4.1 轉染效果 轉染重組質粒pCI-chIL-4-chIL-2-EGFP后24~96 h,轉染率先升后降,48 h達峰值,96 h為0,且各時間段間差異不顯著(P>0.05)。pCI-chIL-2-EGFP和pCI-chIL-4-EGFP規律同pCI-chIL-4-chIL-2-EGFP,見圖4和圖5。

圖4 pCI-chIL-4-chIL-2-EGFP、pCI-chIL-2-EGFP和pCI-chIL-4-EGFP在雞胚盲腸上皮細胞中的轉染效果

圖5 pCI-chIL-4-chIL-2-EGFP轉染雞胚盲腸上皮細胞
2.4.2 表達效果
2.4.2.1ChIL-4、ChIL-2基因mRNA表達量測定 轉染后24~96 h,chIL-4-chIL-2、chIL-2和chIL-4基因的mRNA表達量均先升高后降低,48 h時極顯著高于其他時間段(P<0.01),見圖6。
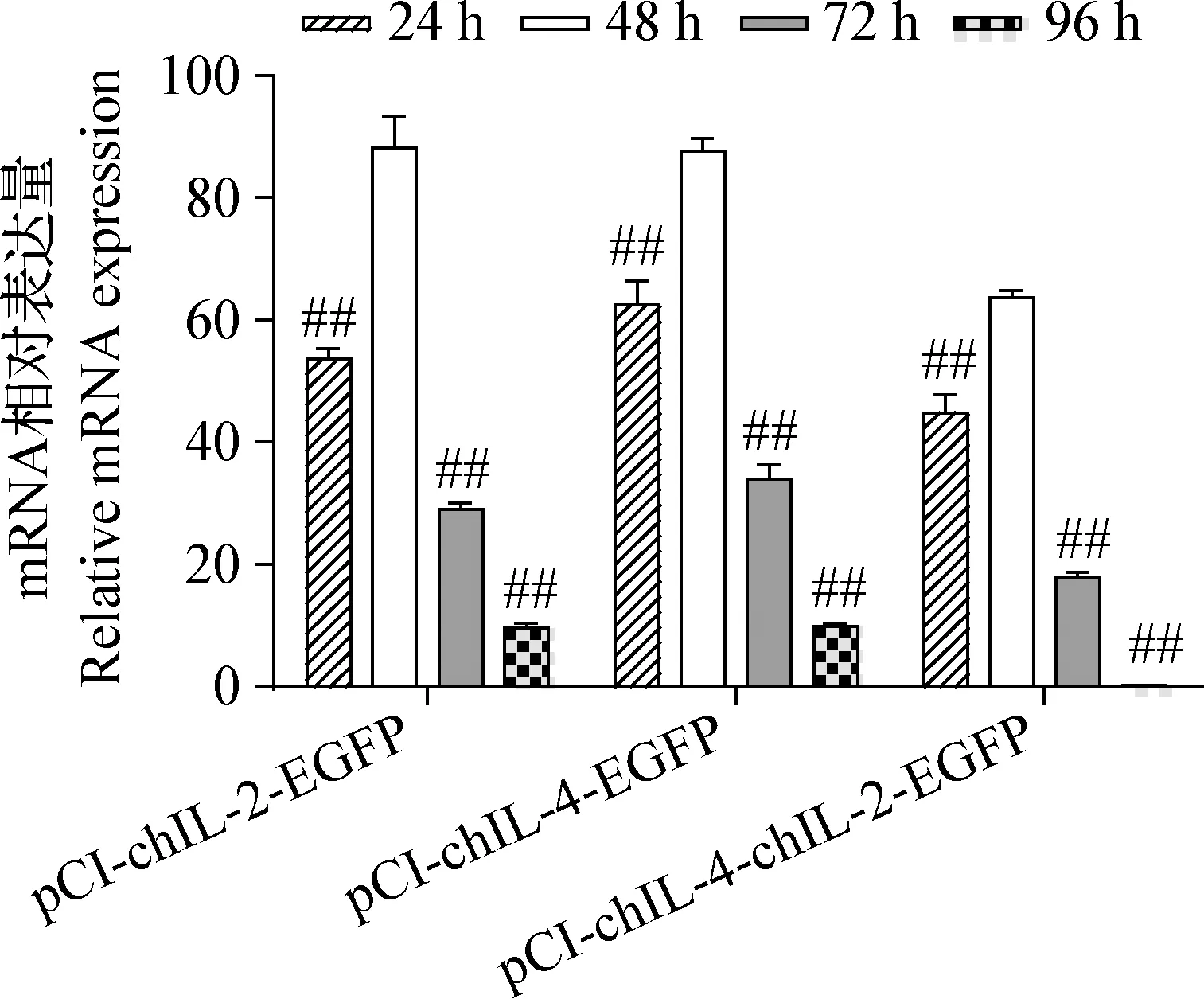
圖6 目的基因mRNA的相對表達量
2.4.2.2 細胞內蛋白表達量 重組質粒pCI-chIL-2-EGFP轉染后24~96 h,細胞累積光密度(IOD)值先升后降,72 h達峰值,其IOD值顯著高于48 h(P<0.05)或極顯著高于24 h(P<0.01),96 h為0。pCI-chIL-4-EGFP、pCI-chIL-4-chIL-2-EGFP變化規律同pCI-chIL-2-EGFP。空載組各時間段均為0,見圖7。
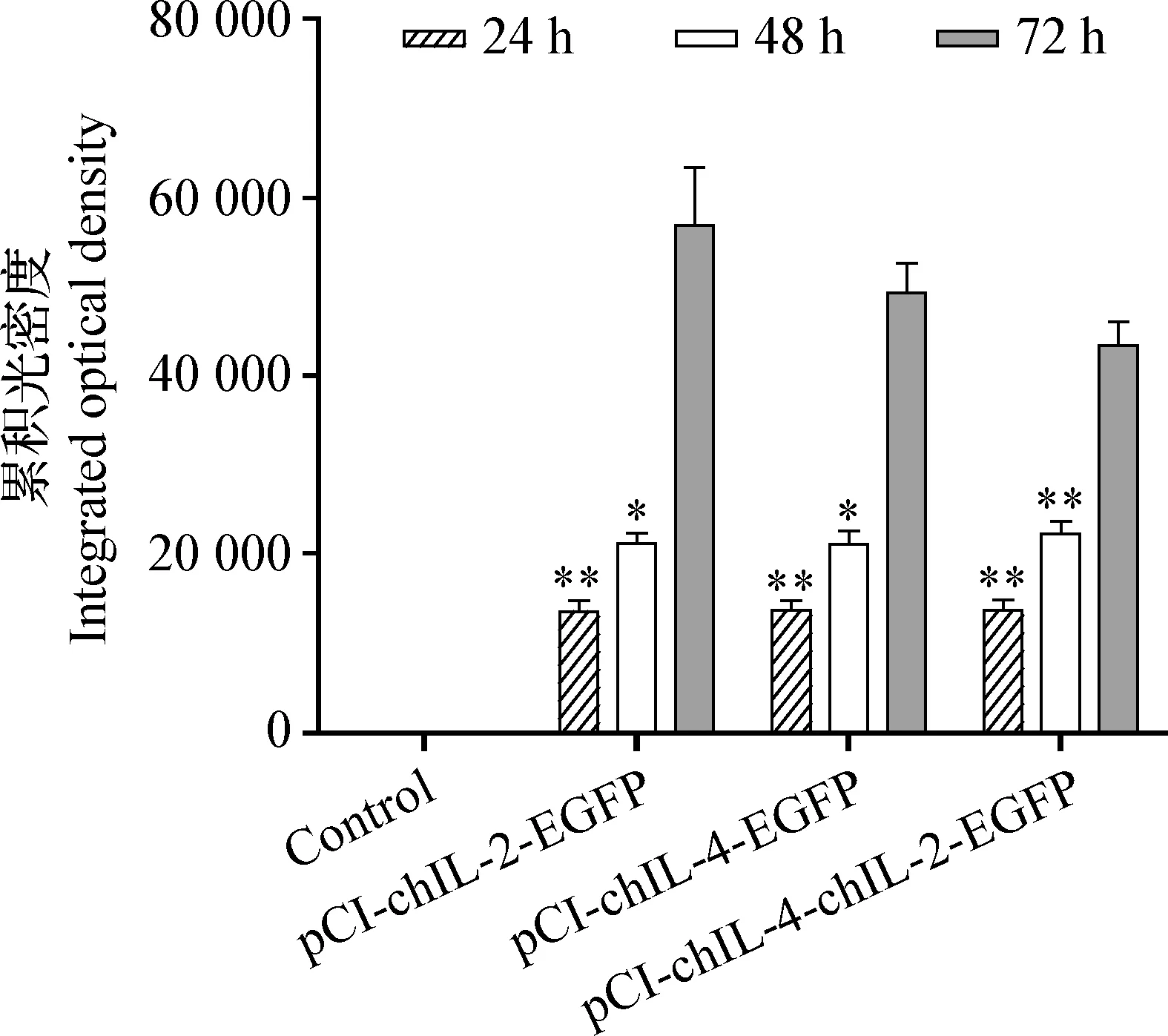
圖7 pCI-chIL-4-chIL-2-EGFP、pCI-chIL-2-EGFP和pCI-chIL-4-EGFP在雞胚盲腸上皮細胞中的表達
2.4.2.3 細胞培養液中融合蛋白表達量 重組質粒pCI-chIL-4-chIL-2-EGFP轉染后24~96 h,熒光強度先升后降,72 h達峰值且極顯著高于其他時間段(P<0.01)。 pCI-chIL-4-EGFP、pCI-chIL-2-EGFP變化規律同pCI-chIL-4-chIL-2-EGFP,見圖8。
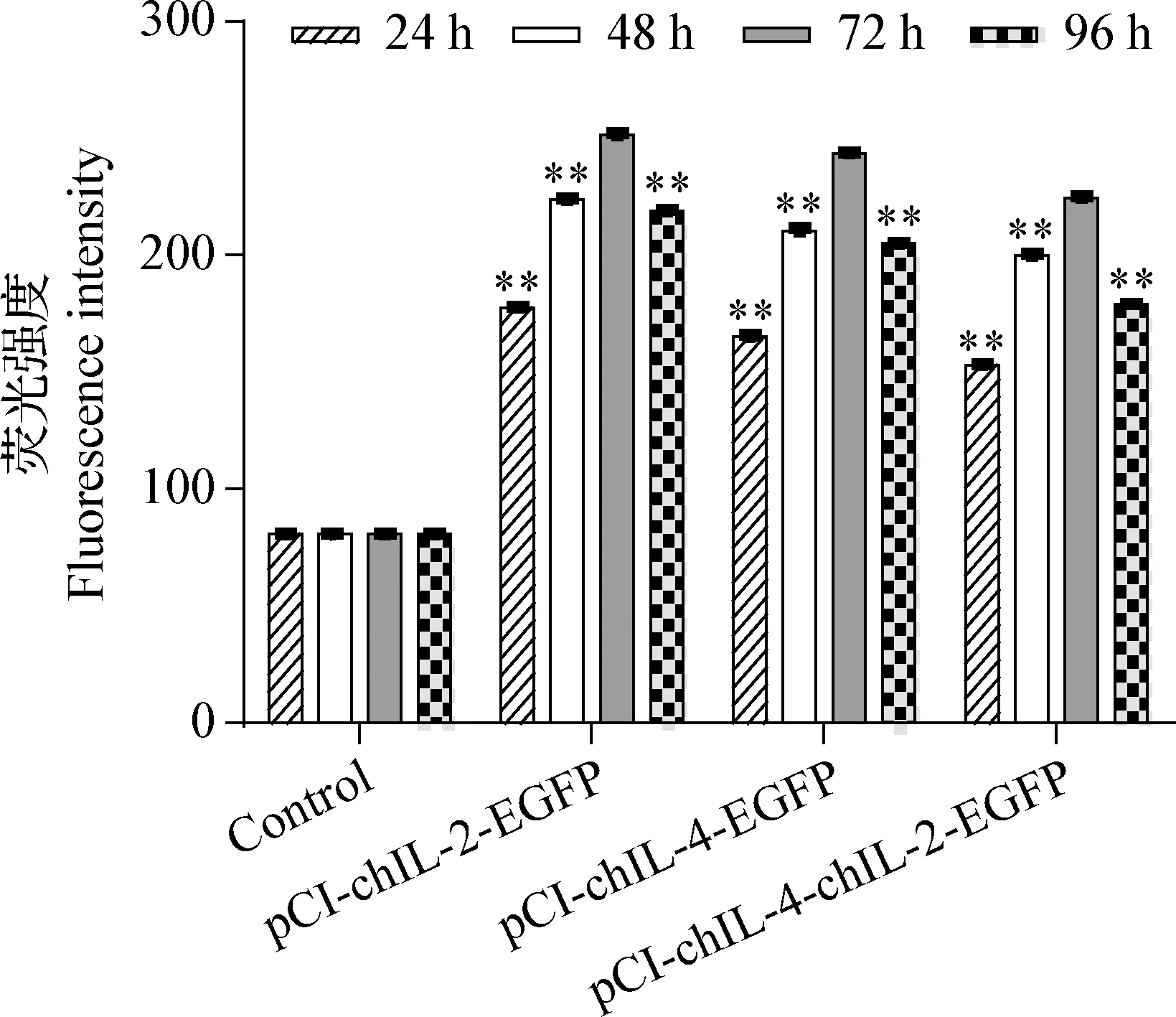
圖8 pCI-chIL-4-chIL-2-EGFP、pCI-chIL-2-EGFP和pCI-chIL-4-EGFP轉染細胞后表達蛋白的分泌情況
2.5 真核重組質粒表達產物的生物學活性鑒定 轉染后24~96 h,B2、B3組和B4組的表達產物對淋巴細胞增殖活性的影響均先升后降,且均極顯著高于B1組(P<0.01),B4組極顯著高于B2組和B3組(P<0.01),B2組和B3組無差異(P>0.05),見圖9。
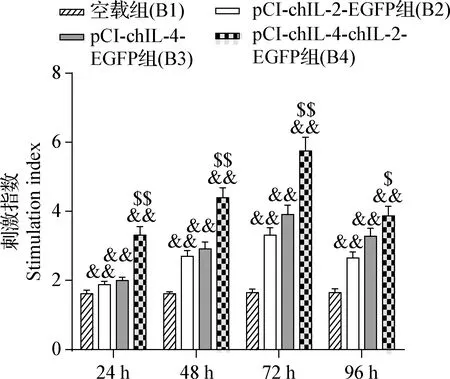
圖9 各組表達產物對淋巴細胞增殖活性的影響
3 討論
本試驗用DNA重組技術將IL-4和IL-2基因與EGFP基因融合構建重組質粒,經凝膠電泳、基因測序、轉染細胞內和細胞培養液熒光蛋白測定,表明成功構建了3種真核表達質粒,且轉染雞胚盲腸上皮細胞后可持續表達并分泌chIL-2、chIL-4、chIL-4-chIL-2融合蛋白,為進一步研究提供基礎。
研究發現,IL-2和IL-4都可促進淋巴細胞增殖[6-7]。雞脾淋巴細胞增殖活性試驗結果顯示,轉染于原代雞胚盲腸上皮細胞后分泌的chIL-2、chIL-4蛋白和chIL-4-chIL-2融合蛋白在各時間段均能促雞脾淋巴細胞增殖。戴華等[7]通過試驗獲得的重組蛋白pBac-ChIL-4能刺激雞脾淋巴細胞增殖。牛澤[8]研究結果表明,重組ChIL-2蛋白對雞脾淋巴細胞有顯著增殖作用。以上研究結果與本試驗結果一致。本試驗發現,3種重組質粒對雞脾淋巴細胞增殖均有顯著促進作用,而單一chIL-2、chIL-4促進雞脾淋巴細胞增殖作用顯著低于chIL-4-chIL-2,結果表明chIL-4-chIL-2融合蛋白具有更好的生物學活性。閆若潛等[9]以雞α干擾素與IL-2為對象構建融合基因并獲得其重組融合蛋白,結果表明此蛋白有雙重生物學活性。馬文濤[10]以豬IL-2和IL-6基因為對象獲得重組融合蛋白,通過試驗證實此蛋白生物學活性優于單一重組蛋白。上述研究結果與本試驗結果相同。但是chIL-4-chIL-2細胞因子免疫佐劑能否縮短免疫產生期還需進一步的驗證。總之,3種重組質粒對雞脾淋巴細胞的增殖均有促進作用,且融合蛋白chIL-4-chIL-2的生物學活性明顯優于單一蛋白。

