EGCG與β-伴大豆球蛋白/大豆球蛋白相互作用對蛋白質結構的影響
黃 國,田澤鵬,薛麗瑩,陳 騏,王 迪,衣艷嬌,李 萌,孫書境,隋曉楠,*
(1.東北農業大學食品學院,黑龍江 哈爾濱 150030;2.東北農業大學生命科學學院,黑龍江 哈爾濱 150030)
大豆蛋白是我國優質植物蛋白的重要來源,由于其良好的功能特性和豐富的營養品質,被廣泛應用于各種食品加工領域中。-伴大豆球蛋白(-conglycinin,7S)和大豆球蛋白(glycinin,11S)是大豆蛋白中的主要儲藏蛋白,其含量占大豆蛋白總量的70%。7S蛋白(150~180 kDa)是由3個不同的(67 kDa),’(71 kDa)和(50 kDa)亞基組成的三聚體,這些亞基主要通過疏水相互作用和氫鍵連接;11S蛋白(約360 kDa)是由兩個三聚體堆疊而成的六聚體,每個三聚體包含3個亞基,每個亞基由酸性多肽A(35 kDa)和堿性多肽B(20 kDa)通過二硫鍵連接。近年來,由于食品級蛋白質對生物活性物質具有潛在的傳遞和包埋作用,大豆蛋白作為其生物活性物質的載體而備受關注。一方面,大豆蛋白中含有豐富的疏水性/親水性,帶電氨基酸,這使大豆蛋白具有通過靜電相互作用、氫鍵、疏水相互作用等與小分子相互作用的潛力。這些相互作用使多酚等小分子活性物質包埋在大豆蛋白的三維網絡中,例如VB、姜黃素、花青素、原花青素等,能夠保留其生理活性并將其釋放到體內的目標部位。另一方面,與生物活性化合物的絡合可以改變大豆蛋白的結構、功能特性和營養價值。例如:大豆分離蛋白(soy protein isolate,SPI)與單寧的相互作用導致SPI發生交聯,從而影響了蛋白質的凝膠特性。花青素與SPI的結合誘導了SPI二級、三級結構的變化,進而改善了SPI的穩定性和消化特性。兒茶素可以增強7S蛋白的抗氧化性并促進了7S蛋白消化率的提高。盡管已經有大量的研究關注大豆蛋白與多酚等小分子的相互作用,然而這主要集中于大豆蛋白的混合物,如SPI,或單一的大豆蛋白組分,如7S/11S蛋白。正如前所述,7S和11S蛋白的分子質量和構象差異可能導致大豆蛋白與多酚等小分子的相互作用發生變化。因此,了解不同大豆蛋白組分和多酚等小分子之間的相互作用方式及其結合機理是有必要的。
表沒食子兒茶素沒食子酸酯((–)-epigallocatechin-3-gallate,EGCG)是綠茶中最主要的兒茶素,約占綠茶中兒茶素的40%。EGCG具有3個芳香環,1個吡喃環和8個酚羥基。與其他多酚相比,芳香環上大量活性酚羥基賦予EGCG優異的理化和功能特性,如抗氧化、抗腫瘤和抗病毒作用等,因此也被廣泛用作食品添加劑。另一方面,EGCG分子可以通過酚羥基與環形結構形成氫鍵和疏水相互作用與蛋白質發生相互作用。當將EGCG添加到大豆蛋白的食品中時,EGCG與大豆蛋白之間的互作可能賦予大豆蛋白更好的功能特性和一些額外的健康益處。You Yaohui等通過熒光光譜法發現SPI和EGCG之間相互作用力主要是依靠疏水相互作用和氫鍵,并表示EGCG使SPI結構變得松散,SPI的起泡性、乳化性和抗氧化性得到改善。EGCG的加入導致SPI二級結構螺旋與-折疊發生一定的轉變,并增強了SPI的熱穩定性。此外,EGCG還可以通過疏水相互作用和氫鍵與大豆蛋白形成不溶性聚集體,提高了大豆蛋白水解液中蛋白質的回收率。盡管EGCG的添加可能會影響大豆蛋白的結構與功能特性,但大多數研究僅限于大豆蛋白混合物或單一的蛋白組分。對于7S蛋白、11S蛋白與EGCG之間的作用機理的差異需要進一步研究。
因此,本實驗主要研究中性條件下7S/11S蛋白與EGCG之間的相互作用方式及結合機理,通過紫外-可見光譜及熒光光譜表征大豆蛋白與EGCG結合特性,并分析其相互作用類型與熱力學特征;還通過傅里葉變換紅外(Fourier transform infrared,FTIR)光譜提供相關蛋白質二級結構變化信息;最后利用分子對接了解7S/11S蛋白與EGCG之間的相互作用的類型和參與相互作用的氨基酸殘基。以期在分子水平上提供不同蛋白質組分和多酚的相互作用機制的見解,同時也為大豆蛋白功能性食品的設計和開發提供一定的理論基礎。
1 材料與方法
1.1 材料與試劑
大豆(綏農53號) 國家大豆工程技術研究中心;EGCG(純度≥98.0%) 西安通澤生物科技有限公司;8-苯胺基-1-萘磺酸鈉(sodium 8-anilino-1-naphthalenesulfonate,ANS-Na,純度>97.0%) 東京化成工業株式會社;實驗室中所用試劑均為分析純;所用實驗用水均為去離子水。
1.2 儀器與設備
UV-2600紫外-可見分光光度計、RF-6000熒光分光光度計 日本Shimadzu公司;F-7100熒光分光光度計日本Hitachi公司;Nicolet iS50 FTIR光譜儀 美國賽默飛世爾科技(中國)有限公司;FD5-3型冷凍干燥機美國SIM公司;KQ100超聲波清洗機 昆山舒美超聲儀器有限公司。
1.3 方法
1.3.1 7S/11S蛋白的制備
參考Nagano等的方法并稍作修改。大豆粉碎,過60 目篩,將大豆粉按照料液比1∶3(g/mL)分散于正己烷中,并在室溫下攪拌2 h后,富集上清液正己烷進行冷凝回收,重復脫脂5 次。將沉淀物進行干燥,得到的大豆脫脂豆粉。將其按料液比1∶10(g/mL)分散于去離子水中,用2 mol/L NaOH溶液調節pH 7.5,室溫攪拌1 h后,在4 ℃、10 000×離心30 min,除去沉淀物,向上清液中加入0.98 g/L干燥的亞硫酸氫鈉。用2 mol/L HCl溶液調節pH 6.4后在4 ℃條件下保持過夜,在4 ℃、6 500×離心20 min,得到11S沉淀物。為了制備7S蛋白,在上述步驟得到的上清液加入0.25 mol/L的固體NaCl,并用2 mol/L HCl溶液調節pH 5.0,攪拌1 h。而后在4 ℃、10 000×離心30 min,除去沉淀物。將得到的上清液用相同體積的冰冷水稀釋,用2 mol/L HCl溶液調節pH 4.8,室溫靜置1 h后,在4 ℃、6 500×離心20 min,得到7S沉淀物。
將7S/11S沉淀物進行5 次水洗后,并分散于10 倍的去離子水中重新溶解并調節pH 7.5。分別將懸浮液透析48 h(3 500 Da),每6 h換一次水,而后進行冷凍干燥研磨貯存。經杜馬斯法(N×6.25)分析測定,分別得到蛋白質質量分數為(90.30±0.15)%、(96.7±0.10)%的7S/11S蛋白。
1.3.2 7S/11S蛋白-EGCG復合體系的構建
將7S/11S蛋白分散于0.01 mol/L pH 7.0磷酸鹽緩沖溶液(phosphate buffered saline,PBS),室溫攪拌2 h后,4 ℃冰箱過夜充分水化,最終蛋白母液質量濃度為0.2 mg/mL。將EGCG分散于0.01 mol/L pH 7.0 PBS中,避光室溫攪拌2 h后定容,得到64 μmol/L EGCG母液。超聲10 min進行脫氣處理,4 ℃冰箱備用。將蛋白溶液與EGCG溶液按照不同梯度進行稀釋混合至所需濃度,在設置溫度下反應2 h后,冰水浴30 min終止反應,以獲得大豆蛋白-EGCG復合體系。
1.3.3 紫外-可見光吸收光譜分析
參考劉英杰等的方法并稍作修改。將7S/11S蛋白與EGCG溶液進行混合,最終蛋白質量濃度為0.1 mg/mL,EGCG濃度分別為0、0.5、1、2、4、8、16 μmol/L。在298 K水浴恒溫反應2 h,冰水浴30 min后,取出恢復室溫后進行紫外-可見光吸收光譜分析。波長范圍設置為250~350 nm,速率為中速,狹縫寬為2 nm。其中以未添加EGCG即EGCG濃度為0 μmol/L的蛋白樣品為空白對照,下同。
1.3.4 內源性熒光光譜分析
將1.3.3節配制好的7S/11S蛋白與EGCG混合溶液,在298、304、310 K水浴恒溫反應2 h,冰水浴30 min后,取出恢復室溫后進行內源性熒光光譜測量。使用RF-6000熒光分光光度計測定,激發波長設置為280 nm,發射波長為300~460 nm,激發和發射狹縫寬帶均為5 nm,掃描速率為2 000 nm/min。
1.3.5 外源性熒光光譜分析
使用ANS疏水熒光探針法測定蛋白質的表面疏水性。將1.3.3節所配制好的7S/11S蛋白與EGCG混合溶液,在298 K水浴恒溫反應2 h,冰水浴30 min后,取出恢復室溫后進行外源性熒光光譜測定。將50 μL的8 mmol/L ANS溶液添加到5.0 mL的7S/11S蛋白與EGCG混合溶液中,旋渦振蕩30 s,避光反應15 min后測量其熒光強度。使用F-7100熒光分光光度計測定,激發波長設置為390 nm,發射波長為400~600 nm,激發和發射狹縫寬帶均為5 nm,掃描速率為1 200 nm/min,電壓為500 V。
1.3.6 FTIR光譜分析
將EGCG粉末按EGCG∶大豆蛋白為0∶1、1∶2(/)比例添加至1 g/100 mL的7S/11S蛋白溶液中,避光攪拌2 h,以確保充分反應。將混合物置于透析袋(3 500 Da)中以除去游離的EGCG,并在4 ℃條件下透析48 h。每6 h更換一次去離子水,最后將透析袋中的懸浮液冷凍干燥以獲得大豆蛋白-EGCG復合物。將蛋白質樣品與KBr粉末以1∶100(/)充分混合研磨后壓片,進行FTIR光譜分析。測定波數范圍為4 000~500 cm,并以1 cm的分辨率掃描32 次。利用Peak Fit 4.12軟件對所獲得的掃描圖譜中的1 700~1 600 cm酰胺I帶進行蛋白質二級結構相對含量分析。
1.3.7 分子對接
使用Pymol 16.0軟件對大豆蛋白晶體模型(7S,PDB ID:1UIK;11S,PDB ID:1OD5)進行預處理。而后使用Autodocking Tool 4.12軟件對EGCG與預處理的大豆蛋白進行分子對接,獲得EGCG與大豆蛋白的結合構象和對接作用最小能量模式圖。
1.4 數據統計分析
每組實驗平行測定重復3 次,利用SPSS Statistics 23軟件對數據進行ANOVA差異顯著性分析及相關性分析,<0.05,差異顯著。采用Origin 9.1、Peak Fit 4.12等軟件進行數據分析、圖表制作以及FTIR光譜蛋白吸收峰進行擬合。
2 結果與分析
2.1 EGCG對大豆7S/11S蛋白紫外-可見光吸收光譜的影響
紫外-可見光吸收光譜是研究小分子和蛋白質之間互作的常見方法。在250~350 nm的波長范圍內,蛋白質中Trp和Tyr殘基的共軛雙鍵在280 nm波長處附近具有吸收峰。蛋白質分子中的氨基酸殘基的微環境變化會導致蛋白質的最大吸收波長發生紅移或藍移,從而引起蛋白質構象的改變。如圖1所示,隨著EGCG添加量增大,7S/11S蛋白吸收譜強度均有增加,這可能是由于EGCG與Trp和Tyr殘基之間形成了新的共軛體系,π-π電子對能級躍遷,吸光度增加。同時,7S/11S蛋白的最大吸收值峰位發生了輕微的藍移,這表明EGCG與大豆蛋白的相互作用改變了Trp和Tyr殘基的微環境,蛋白質構象發生改變,這與Wang Chen等的研究結果一致。
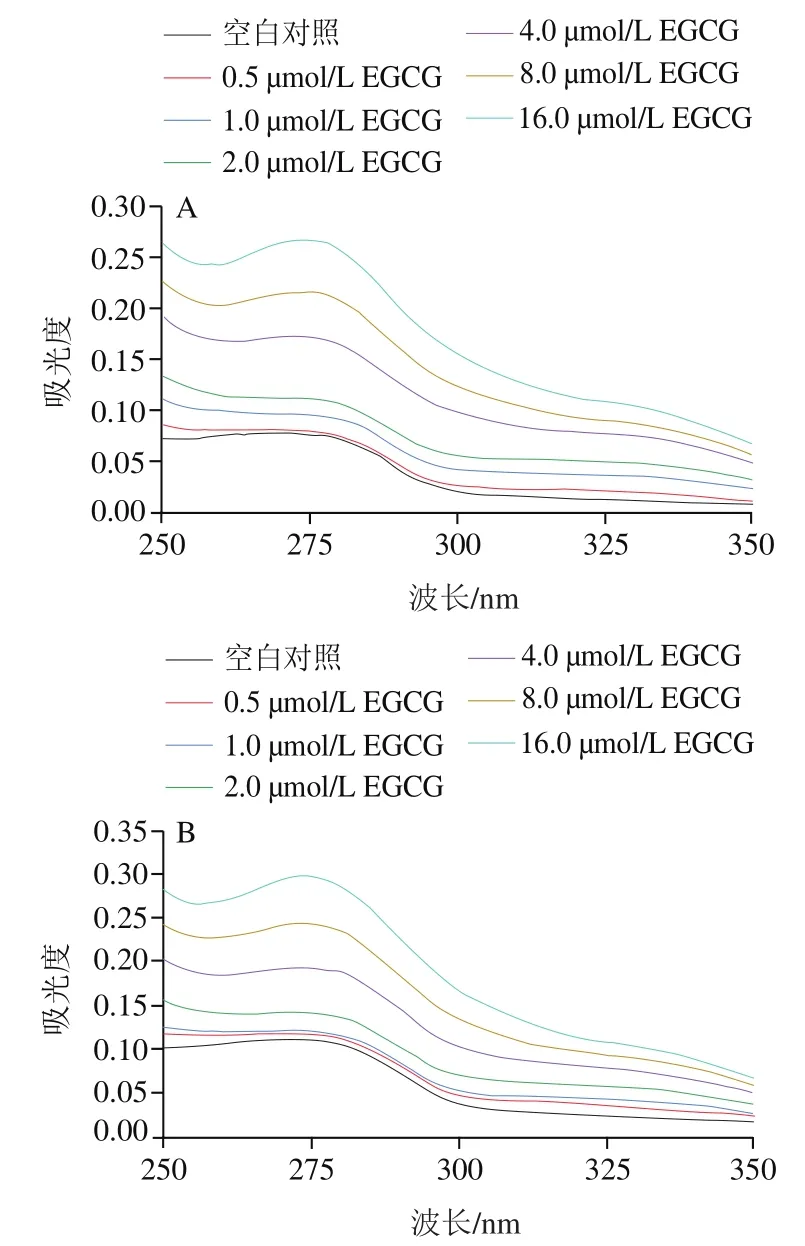
圖1 不同EGCG濃度下7S(A)、11S(B)紫外-可見光吸收光譜曲線Fig. 1 UV-Vis absorption spectra of 7S (A) and 11S (B) in the presence of different EGCG concentrations
2.2 內源性熒光光譜分析
2.2.1 EGCG對7S/11S蛋白內源性熒光光譜的影響
熒光光譜法是研究受體與配體相互作用的常見方法,因其方便、快捷、靈敏度高被而廣泛使用,從而確定受體與配體分子的結合方式與結合類型。當激發波長為280 nm時,蛋白質的固有熒光主要是來自于Trp與Tyr殘基,而Phe殘基由于量子產率低而常忽略不計。如圖2所示,與7S蛋白相比,11S蛋白顯示出更強的熒光強度,這是由于其蛋白含有較高含量的Trp與Tyr,與這與Li Jufang等的報道一致。當添加EGCG時,7S/11S蛋白的熒光強度下降,這表明EGCG對7S/11S蛋白具有猝滅作用,且猝滅效果與EGCG添加量有較強的依賴性。EGCG的添加使得7S/11S蛋白最大熒光峰的波長發生了輕微的紅移,這表明EGCG與7S/11S蛋白之間發生了相互作用,蛋白質主肽鏈變得舒展,埋藏于蛋白質內部中的Trp與Tyr殘基暴露至更親水性的環境。除此之外,當EGCG添加量最大時,EGCG對7S/11S的猝滅效率分別為(58.75±1.34)%、(67.07±2.05)%,這說明EGCG與11S蛋白相互作用更強。

圖2 不同EGCG濃度下7S(A)、11S(B)熒光光譜曲線Fig. 2 Fluorescence spectra of 7S (A) and 11S (B) in the presence of different EGCG concentrations
2.2.2 熒光猝滅類型分析
為了解EGCG與7S/11S蛋白之間相互作用的熒光猝滅機理,通過Stern-Volmer方程(1)進行相關猝滅常數的計算。猝滅常數是判定分子之間動態與靜態猝滅的關鍵數據。具體而言,在靜態猝滅中,猝滅常數隨溫度的升高而降低;而對于動態猝滅,其變化趨勢與靜態猝滅相反。
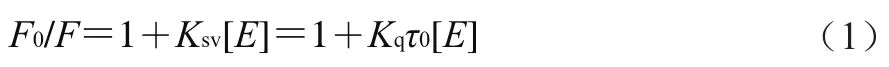
式中:、分別為不添加EGCG與添加EGCG后大豆7S/11S蛋白的熒光強度;[]為EGCG濃度/(mol/L);為動態猝滅常數/(L/mol);為分子猝滅速率常數/(L/(mol·s));為不添加猝滅劑時熒光分子的平均壽命10s。
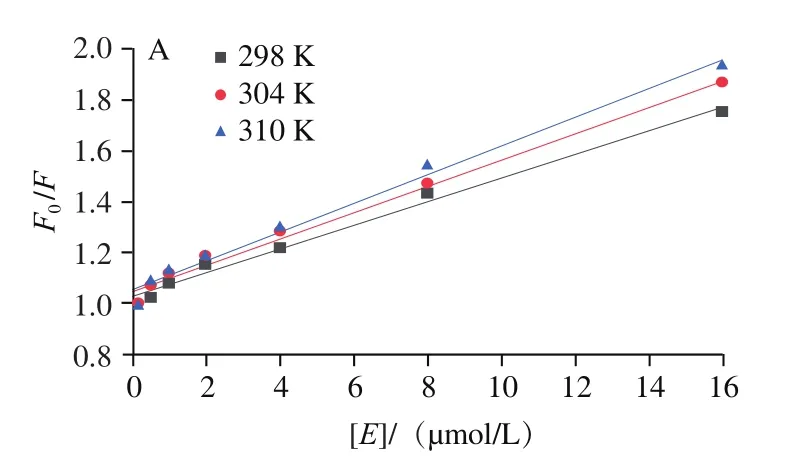
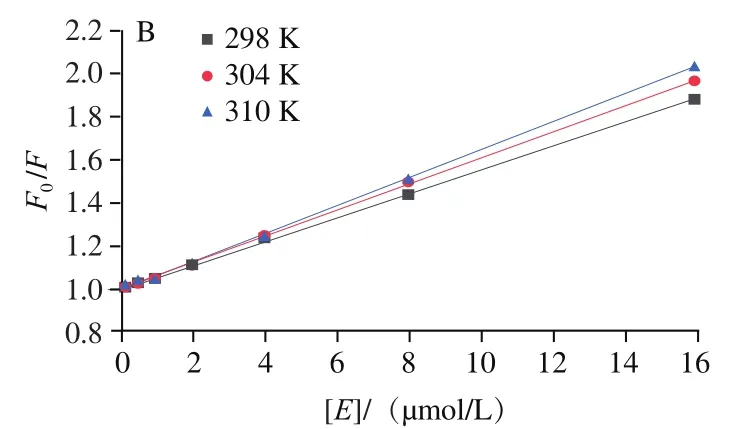
圖3 不同溫度下7S(A)、11S(B)與EGCG相互作用的Stern-Volmer圖Fig. 3 Stern-Volmer curves for the interaction of different temperatures of EGCG with 7S (A) and 11S (B)
如圖3和表1所示,7S蛋白和11S蛋白的和值隨溫度升高而增加。這些結果表明EGCG與大豆蛋白兩者之間由于分子間碰撞而引起了動態猝滅。此外,7S/11S蛋白的值遠高于最大動態猝滅常數(2.0×10L/(mol?s)),該結果表明以形成基態穩定復合物的靜態猝滅方式在大豆蛋白與EGCG結合中起著重要作用。因此,綜上表明7S/11S蛋白與EGCG的相互作用方式是動態和靜態猝滅同步發生,這與Zhang Jing等研究結論一致。同樣,王晨等研究了小麥谷蛋白與矢車菊素-3--葡萄糖苷的相互作用,結果發現矢車菊素-3--葡萄糖苷以動態和靜態猝滅相結合的方式使得小麥谷蛋白發生熒光猝滅現象。

表1 不同溫度下7S、11S的熒光猝滅常數及線性相關系數Table 1 Stern-Volmer quenching constants (KSV) and molecular quenching constants (Kq) for 7S and 11S at different temperatures
2.2.3 結合常數與結合位點的計算
對于靜態猝滅,結合常數和結合位點數可以通過雙對數方程(2)進行計算。
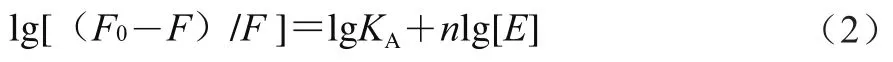
式中:、分別為不添加EGCG與添加EGCG后大豆7S/11S蛋白的熒光強度;[]為EGCG濃度/(mol/L);為結合常數;為結合位點。
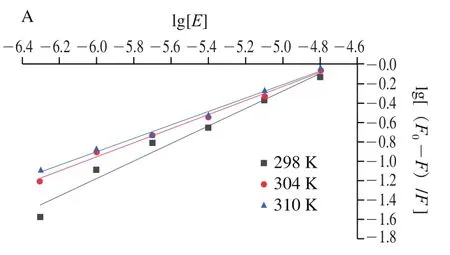
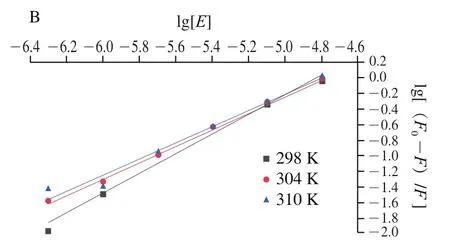
圖4 不同溫度下7S(A)、11S(B)與EGCG相互作用的雙對數回歸曲線Fig. 4 Double logarithmic regression curves for the interaction of EGCG with 7S (A) and 11S (B) at different temperatures
如圖4和表2所示,在相同溫度下,7S蛋白的值比11S蛋白低,這表明11S蛋白與EGCG的結合能力更高。7S/11S蛋白的值隨著溫度的升高而降低,這表明7S/11S蛋白與EGCG的反應是一個放熱反應,升高溫度不利于大豆蛋白-EGCG復合物穩定性的提高。在298、304 K和310 K溫度下,7S/11S蛋白的值近似接近于單個結合位點,表明大豆蛋白和EGCG能夠以1∶1的物質的量比形成穩定的靜態復合物;此外,觀察到7S/11S蛋白的值大小與值趨勢一致,進一步說明與7S蛋白相比,11S蛋白與EGCG之間的親和力更高。
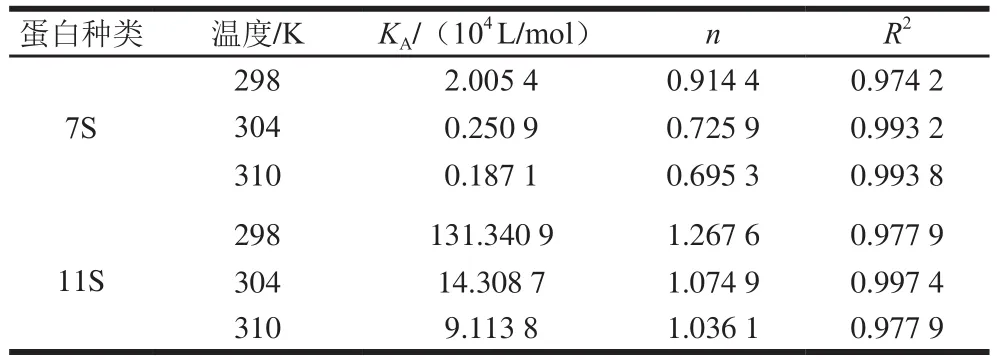
表2 不同溫度下7S和11S與EGCG結合的結合位點數、表觀結合常數及線性相關系數Table 2 Apparent binding constants, number of binding sites and linear correlation coefficients for the interaction of 7S and 11S with EGCG at different temperatures
2.2.4 熱力學參數與相互作用類型判斷
大豆蛋白與EGCG之間的相互作用可能涉及不同類型的結合力,這主要是由一種或多種結合力驅動的。為進一步探究大豆蛋白與EGCG相互作用的主要結合力,通過Van’t Hoff方程(3)、(4)計算了包括吉布斯自由能變(?)、焓變(?)、熵變(?)在內的熱力學參數。

式中:為實驗溫度/K;R為氣體常數(8.314 J/(mol·K));為對應溫度下的結合常數。
如表3所示,所有Δ值均為負值,表明大豆蛋白與EGCG的結合是自發過程。同時,根據Li Yuting等的研究,7S/11S蛋白的?和?值均為負值,這表明氫鍵和范德華力在大豆蛋白與EGCG的結合中起關鍵作用。劉勤勤等報道了類似發現并指出茶多酚與SPI之間的結合主要依靠范德華力和氫鍵驅動,在EGCG與米糠蛋白相互作用中也發現了類似的報道。這可能是由于EGCG含有兩種活性基團:沒食子酰基和酚羥基,且酚羥基數量較多,可以形成大量的氫鍵與大豆蛋白進行結合。然而,與其他類似的文獻報道不同,Zhang Jing等研究了7S/11S蛋白與VB的相互作用,發現疏水作用是主要的結合力;在Ren Cong等的研究中發現,7S/11S蛋白與矢車菊素-3--葡萄糖苷之間的相互作用力主要是靜電相互作用。大豆蛋白和EGCG等其他酚類物質的相互作用受其自身的復雜結構和各種因素影響,其他作用力也可能同時參與結合的過程。未來的研究應結合其他技術手段進一步研究大豆蛋白與EGCG之間的相互作用。
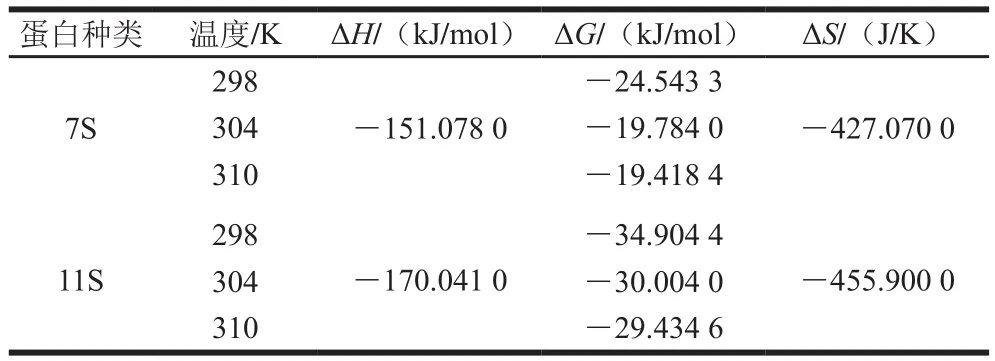
表3 不同溫度下EGCG與7S、11S結合的相關熱力學參數Table 3 Thermodynamic parameters for the interaction of 7S and 11S with EGCG at different temperatures
2.3 外源性熒光光譜分析
在有和無EGCG的情況下,可以通過7S/11S蛋白的ANS結合相對熒光強度表征其表面疏水性。如圖5所示,相比于7S蛋白,11S具有較高的表面疏水性,這可能歸因于11S蛋白中疏水性和不帶電荷的氨基酸含量較高,從而使11S蛋白具有較高的熒光強度。7S/11S蛋白的表面疏水性隨著EGCG濃度的增加而逐漸降低。其降低結果可能歸因于3個主要原因:首先,當EGCG與7S/11S蛋白的疏水區域結合時,EGCG干擾了ANS疏水性探針與疏水性氨基酸殘基結合,使其兩者的結合的可能性降低;其次,EGCG具有多個酚羥基,當EGCG與7S/11S蛋白結合時,由EGCG引入的額外羥基會增加7S/11S蛋白的表面親水性;同時,由于EGCG與7S/11S蛋白的相互作用改變了7S/11S蛋白構象,一些埋藏在蛋白質內部的親水區域可能會由于蛋白質分子的部分展開而暴露于蛋白質表面,這可能也是7S/11S蛋白與EGCG相互作用后表面疏水性降低的一個原因。相同的結果在Ren Cong等的研究中也有報道:矢車菊素-3--葡萄糖苷與大豆蛋白的相互作用導致蛋白質表面疏水性的下降。此外,11S蛋白的相對熒光強度下降的更加明顯,進一步說明11S蛋白與EGCG之間的相互作用更強。
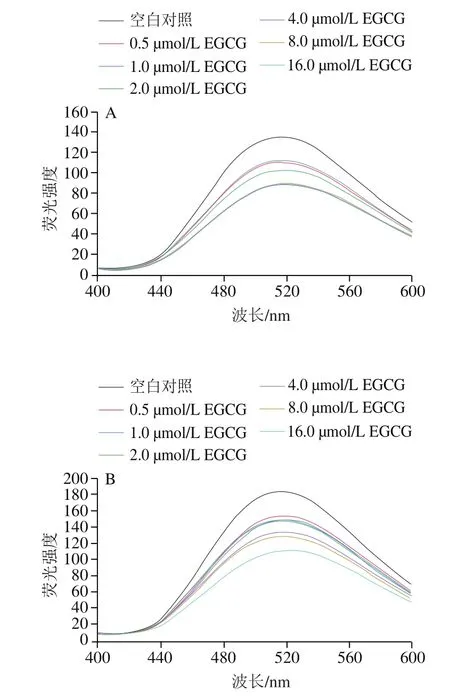
圖5 298 K條件下7S(A)、11S(B)與EGCG相互作用的表面疏水性Fig. 5 Effect of interaction with EGCG on surface hydrophobicity of 7S (A) and 11S (B) at 298 K
2.4 EGCG對大豆7S/11S蛋白FTIR光譜的影響
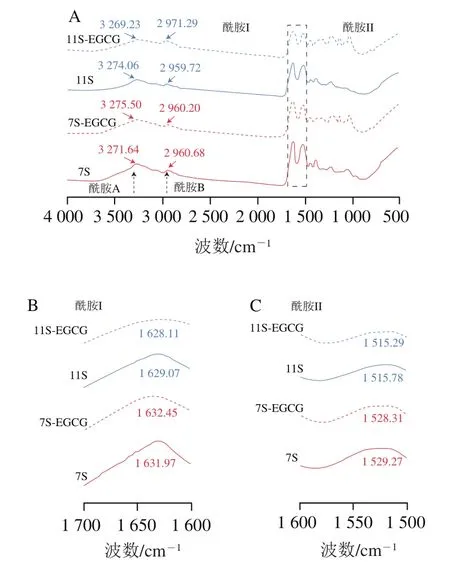
圖6 7S和11S及其與EGCG復合物的全局(A)、酰胺I(B)和酰胺II(C)FTIR光譜Fig. 6 Global FTIR spectra (A), amide I spectra (B) and amide II spectra (C) of 7S and 11S and their complexes with EGCG at pH 7.0
應用FTIR光譜法研究大豆蛋白-EGCG復合物,以了解形成復合物的相互作用以及添加EGCG后對大豆蛋白質二級結構的影響。酰胺A帶(3 300 cm附近)代表分子間的氫鍵以及O—H和N—H的拉伸振動,酰胺B帶(2 960 cm附近)代表蛋白質的C—H拉伸振動。酰胺I帶(1 700~1 600 cm)和酰胺II帶(1 540 cm附近)分別是由蛋白質C=O拉伸振動、N—H彎曲和C—N拉伸所導致。如圖6所示,EGCG的添加,7S/11S蛋白的酰胺A帶、酰胺B帶、酰胺I帶和酰胺II帶位置均發生了偏移,通過改變酰胺I帶和酰胺II帶的位置,可以推斷出大豆蛋白通過C=O、C—N和N—H與EGCG結合;同時,在酰胺A帶和酰胺B帶位置的變化也證實了EGCG主要與大豆蛋白形成氫鍵和疏水相互作用。Zhao Qian等研究了膠原蛋白、酪蛋白與沒食子酸的相互作用,并指出沒食子酸與蛋白質結合并通過氫鍵和疏水相互作用形成復合物。在茶多酚與豆漿蛋白相互作用中也發現了類似的結論,并表示兩者之間的疏水相互作用和氫鍵能夠影響豆漿蛋白的穩定性。
7S/11S蛋白及復合物的蛋白質二級結構定量分析結果如表4所示。-折疊是7S/11S蛋白的主要二級結構,該結果與以往的報道一致。添加EGCG之后,7S蛋白二級結構由-螺旋、-折疊轉變為-轉角、無規卷曲;這與Sui Xiaonan等的研究結果一致。而11S蛋白二級結構由-折疊、-轉角轉變為-螺旋、無規卷曲,這與Zhou Siduo等的研究結果一致。無規卷曲是一種無序結構,無序結構的增多表明了蛋白質的解折疊。在大豆蛋白與多酚的相互作用中,相關蛋白質二級結構的變化未得出一致的結論。橙皮苷結合7S蛋白能夠誘導-折疊向-轉角與-螺旋轉變,使得蛋白質結構部分展開呈現較松散的構象狀態;在7S/11S蛋白與VB相互作用中,VB促進7S/11S蛋白的-螺旋、-折疊和-轉角相對含量的增加,進而增強大豆蛋白質構象的致密性。矢車菊素-3--葡萄糖苷的添加,使得7S/11S蛋白中的-折疊結構向-螺旋、-轉角、無規卷曲結構轉換,進而降低蛋白質結構的穩定性。這可能是多酚與大豆蛋白質構象、結合量與結合方式的不同導致蛋白質內部氫鍵重排,對蛋白質氫鍵和疏水作用有干擾作用,從而導致二級結構發生了不同的變化,在膠原蛋白/酪蛋白-單寧酸、-酪蛋白/-酪蛋白-藍莓花色苷,乳球蛋白/-酪蛋白-木糖醇等相互作用研究中也觀察到了類似的趨勢。此外,與未處理的7S/11S蛋白相比,所有添加了EGCG的7S/11S蛋白樣品均顯示出-折疊相對含量的降低,無規卷曲相對含量的升高。7S蛋白的無規卷曲相對含量比11S蛋白增加更多,7S蛋白的-折疊相對含量比11S蛋白的減少更多。EGCG可能會對7S蛋白二級結構有更大的影響,這可能與蛋白質的固有的構象有關。11S蛋白是一個具有較高聚集度和分子質量的六聚體蛋白;而7S蛋白是一個三聚體,具有較低的聚集度與分子質量,且有較大比例的柔性結構的蛋白。當EGCG作用于7S/11S蛋白時,由于7S蛋白較低的聚集度,可能會更好的作用于7S蛋白,使其無規卷曲相對含量增加更多。這與Wang Yuting等的結果一致,并表示超聲處理后的7S/11S蛋白的二級結構相對含量變化有較大的差異,這可能與蛋白質之間構象不同有關。總之,FTIR光譜分析表明,EGCG與7S/11S蛋白結合并通過氫鍵和疏水相互作用形成復合物,從而導致大豆蛋白質的二級結構改變。此外EGCG會誘導7S/11S蛋白質解折疊,使得-折疊向無規卷曲轉變,無規卷曲相對含量的增加可能有利于大豆蛋白質功能性質的改善。
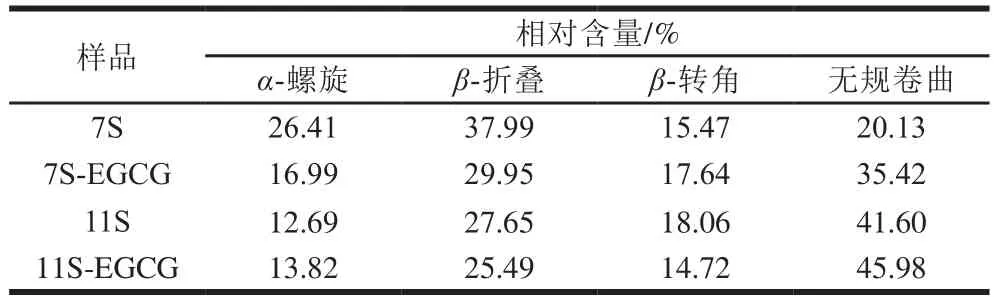
表4 7S和11S及其與EGCG的復合物在pH 7.0條件下的二級結構分析Table 4 Secondary structure analysis of 7S and 11S and their complexes with EGCG at pH 7.0
2.5 大豆7S/11S蛋白-EGCG分子對接分析
分子對接是一種有效的分子互作分析方法,可以提供更多有關EGCG與7S/11S蛋白之間相互作用的信息。如表5所示,Δ為負值,表明EGCG與7S/11S蛋白的反應是自發結合的,并且發現大豆11S蛋白Δ大于7S蛋白Δ,表明EGCG與11S蛋白之間親和力更高。是Δ的主要結合能來源,這表明包括范德華力、氫鍵和疏水相互作用在內的多種非共價相互作用力參與了復合物的形成。負值的還表明靜電相互作用對大豆蛋白和EGCG之間的結合具有一定的貢獻,但不是主要的驅動力,這與熱力學參數計算一致。此外,與11S蛋白相比,7S蛋白具有較多的帶電氨基酸,帶電氨基酸殘基電荷密度高,更強。氨基酸分布如圖7所示,EGCG位于大豆蛋白的疏水腔,并被一些疏水性和親水性氨基酸殘基包圍。在7S蛋白中,共有13個殘基參與了對接,其中,EGCG中的羥基與Asn-317、Glu-219、Asn-316、Ala-314、Asp-327和Asn-805殘基相互作用形成8個氫鍵。與7S蛋白類似,11S蛋白中共有10個殘基參與了與EGCG的對接,其中Arg-522、Val-523、Asp-531、Glu-533、His-534和Gly-542殘基參與形成了6個氫鍵。在7S/11S蛋白中,EGCG的結合行為發生在蛋白質的疏水口袋,并觀察到疏水相互作用、氫鍵和范德華力的存在,特別是氫鍵在結合過程中起主要作用,這有助于蛋白質構象的穩定性,從而促進了蛋白質疏水腔內EGCG的空間位置的穩定。這表明在大豆蛋白分子中通過多種形式的作用力為大豆蛋白-多酚復合物提供了必不可少的穩定作用。

表5 EGCG與大豆7S/11S蛋白對接的結果具體能量數值Table 5 Energy values for molecular docking of EGCG with 7S/11S
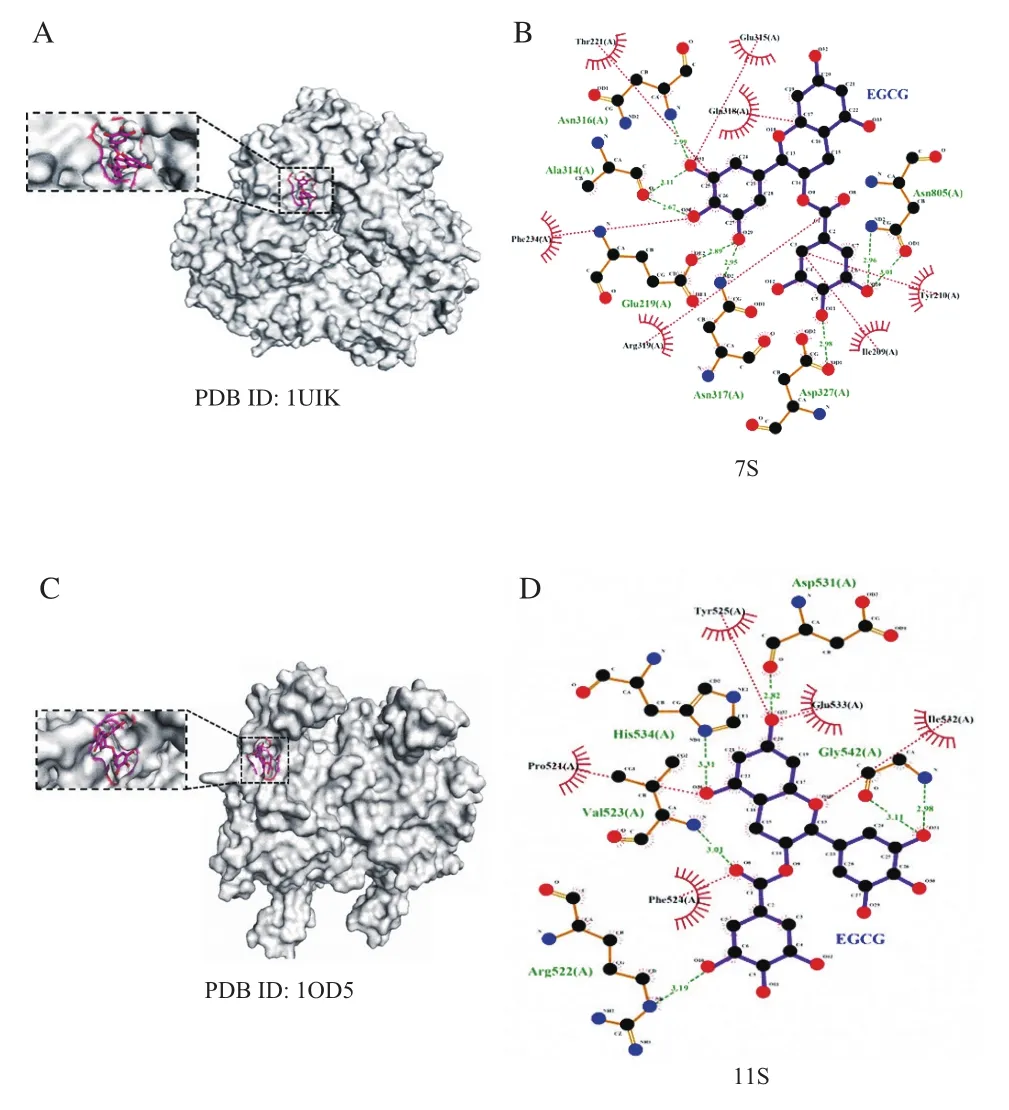
圖7 7S(A)、11S(C)與EGCG結合位點及7S氨基酸殘基(B)、11S氨基酸殘基(D)與EGCG相互作用圖Fig. 7 Binding sites between 7S (A)/11S (C) and EGCG, and interaction of amino acid residues in 7S (B)/11S (D) with EGCG
3 結 論
通過熒光光譜、紫外吸收、FTIR光譜和分子對接等分析了EGCG與7S/11S蛋白的相互作用的機理及兩者之間相互作用的差異比較。結果顯示,在中性條件下,EGCG可與7S/11S蛋白發生動態和靜態猝滅,主要通過氫鍵與范德華力以物質的量比1∶1自發的結合形成復合物,并使得7S/11S蛋白表面疏水性下降;與7S蛋白相比,11S蛋白的猝滅效率、值更高且表面疏水性下降得更為明顯,EGCG對11S蛋白具有更高的親和力;FTIR光譜和分子對接結果表明除氫鍵,疏水相互作用在EGCG與7S/11S蛋白相互作用中起著重要作用;EGCG的添加能夠引起7S/11S蛋白二級結構不同的改變,主要表現為-折疊的減少與無規卷曲的增加,導致大豆蛋白發生解折疊。

