肝素結合蛋白評估膿毒癥相關急性呼吸窘迫綜合征患者預后價值研究
包華瑞 丁振興 談媛媛 任粹萍
急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)是一種除外心源性因素、由各種肺內外因素導致的急性、進行性呼吸衰竭的疾病,其主要病理特點為肺毛細血管通透性增高導致的肺水腫,臨床病死率較高[1]。有報道顯示約40%的ARDS與膿毒癥相關,與膿毒癥相關的ARDS相比其他原因引起的ARDS患者有更高的發病率和病死率[2]。中性粒細胞是膿毒癥相關的ARDS患者病理生理過程中的關鍵細胞[3],肝素結合蛋白(heparin binding protein,HBP)是已激活的中性粒細胞釋放出來的免疫調節蛋白,它的分泌和存儲,均在中性粒細胞的嗜天青顆粒中進行,具有促進血管滲漏的作用[4]。有文獻指出它可以作為預測膿毒癥相關ARDS的預測指標,用于指導膿毒癥相關ARDS的診斷治療[5],但沒有探討HBP與膿毒癥相關ARDS患者肺水腫的聯系。本研究旨在探討膿毒癥相關ARDS患者血清HBP在不同預后患者間的差異,分析HBP對于膿毒癥相關ARDS患者預后的預測價值,評估HBP與膿毒癥相關ARDS患者肺水腫的聯系。
資料與方法
一、一般資料
選取2020年2月至2021年4月安徽醫科大學第一附屬醫院急診重癥監護室(intensive care unit,ICU)收治的膿毒癥相關ARDS患者,且行脈搏指示性連續心輸出量(pulseindicated continuous cardiac output,PICCO)監測相關臨床指標、序貫器官衰竭評估(sequential organ failure assessment,SOFA)和急性生理與慢性健康狀況評估II(acute physiology and chronic healthevaluation II,APACHE II)評分等臨床資料完整的32例患者入選本次研究。
納入標準:符合2016年美國危重病學會(Society of Critical Care Medicine,SCCM)發布的膿毒癥3.0最新定義[6]:1)因感染引起;2)出現危及生命的器官功能障礙,SOFA≥2分。同時符合柏林定義的ARDS診斷標準[7]。
排除標準:1)年齡<18歲;2)孕期患者;3)嚴重免疫缺陷患者,3個月內使用過免疫抑制劑、艾滋病患者;4)未控制已經多處轉移不能切除的惡性腫瘤;5)慢性心力衰竭NYHA分級Ⅲ級、iv級患者(New York Heart Associationg,NYHA)。根據轉歸將患者分為存活組(22例,其中慢性阻塞性肺疾病急性加重5例,吸入性肺炎4例,間質性肺炎2例,腎盂腎炎4例,化膿性膽管炎3例,腸梗阻3例,消化道穿孔1例)和死亡組(10例,其中慢性阻塞性肺疾病急性加重3例,吸入性肺炎2例,腎盂腎炎2例,化膿性膽管炎1例,腸梗阻2例)。本研究經醫院倫理委員會批準(批號:2022050),獲得患者和(或)家屬知情同意,符合醫學倫理學標準。
二、方法
1.所有患者均根據病情予以機械通氣、血液凈化、抗感染、維持水電解質、酸堿平衡以及營養支持等常規治療。
2.血清HBP監測:分別予入ICU 24小時、48小時、72小時留取患者靜脈血5mL,采用免疫熒光干式定量法測定血清HBP水平,比較各時間點兩組患者HBP水平。
3.PICCO監測:經右側頸內靜脈放置中心靜脈導管,連接溫度探頭,經股動脈放置PICCO導管,采用熱稀釋法測定血管外肺水指數(extravascular lung water index,EVLWI)、PVPI、胸腔內血容積指數(intrathoracic blood volume index,ITBVI)、外周血管阻力指數(systemic vascularresistance index,SVRI)及心排血指數(cardiac index,CI)。
三、統計學方法
結 果
一、兩組患者基本資料的比較
兩組患者在年齡、性別、基礎疾病、氧合指數、休克(、特殊治療上的差異無統計學意義(P>0.05)。各時間點死亡組患者SOFA評分、APACHE II評分明顯大于存活組患者(P<0.05)(見表1)。

表1 死亡組與存活組患者基本資料的比較
二、兩組患者臨床資料的比較
降鈣素原水平(procalcitonin,PCT)、HBP水平、EVLWI水平存在時間效應(P<0.05),有隨時間變化的趨勢;組間因素統計表明,死亡組、存活組間存在差異(P<0.05),而白細胞計數(white blood cell,WBC)、C-反應蛋白水平(c-reactive protein,CRP)、PLT、CI、ITBVI、SVRI、PVPI無明顯時間變化趨勢(P>0.05),且在死亡組和存活組間無明顯差異(P>0.05)(見表2)。
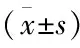
表2 死亡組與存活組患者臨床資料的比較
三、兩組患者各時間點HBP與各臨床數據的相關性分析
膿毒癥相關ARDS患者HBP水平與EVLWI水平及PVPI水平,在入ICU24小時(EVLWIr=0.735,P<0.001,PVPIr=0.571,P=0.001)、入ICU48小時(EVLWIr=0.867,P<0.001,PVPIr=0.617,P<0.001)及入ICU72小時(EVLWIr=0.603,P<0.001,PVPIr=0.565,P=0.001)均成明顯正相關,而僅在入ICU72小時與PCT(r=0.604,P<0.001)具有相關性(見表3)。

表3 各時間點死亡組與存活組HBP與各臨床數據的相關性
四、ROC曲線分析
建立ROC曲線,評估入ICU 24小時、入ICU 48小時及入ICU 72小時HBP預測膿毒癥相關ARDS患者死亡的風險(見表4,圖1~2)。入ICU 24小時、入ICU 48小時HBP的曲線下面積(AUC)>0.6,但P>0.05。在入ICU 72小時,HBP的曲線下面積(AUC)為0.895,且P<0.001。

圖1 入ICU24小時(a1)及入院48小時(a2)HBP預測膿毒癥相關ARDS患者死亡風險的ROC曲線

表4 HBP對膿毒癥相關ARDS患者死亡風險的預測價值
討 論
ARDS所致的肺水腫為高通透性肺水腫,目前臨床上已廣泛應用PICCO監測EVLWI及PVPI來評估ARDS患者肺水腫的程度及性質[8],EVLWI可以相對較好地反映肺泡和肺間質內液的變化情況,與肺部超聲評分呈明顯的正相關[9]。EVLWI升高是急性肺損傷早期的一個特點,數值越高,提示肺水腫越嚴重[10]。PVPI可以反映肺微血管的損傷程度和通透性。Jozwiak等人認為EVLWI和PVPI是ARDS患者28d病死率的獨立危險因素[11]。本研究顯示,死亡組的EVLWI均明顯高于存活組,提示死亡組肺水腫較存活組更嚴重,因而早期EVLWI持續升高可能提示ARDS患者預后較差。但臨床上PICCO監測為有創操作,臨床僅能實現于部分ICU患者,一定程度上也會增加患者的痛苦,長期留置會增加導管相關性感染的風險,并且監測費用高,臨床需要一種簡單、相對創傷較小、廉價的化驗指標,用于監測膿毒癥相關ARDS患者肺水腫的情況、預測患者預后,以利于早期干預提高生存率。

圖2 入ICU72小時HBP預測膿毒癥相關ARDS患者死亡風險的ROC曲線
HBP是存在于中性粒細胞顆粒中的蛋白質,最早是作為對革蘭陰性菌及白色念珠菌有殺菌作用的蛋白被發現的[12]。但是HBP還可以存在于細胞外環境中,作為中性粒細胞內一種可以被分泌的顆粒蛋白,其對炎癥反應可能起到重要作用[13]。當中性粒細胞激活后,中性粒細胞與血管內皮細胞發生粘附,使得HBP以旁分泌的形式釋放入血,一方面可以激活單核細胞和巨噬細胞,導致炎癥介質釋放明顯增加,另一方面可以活化血管內皮細胞,迅速使血管內皮細胞胞質中游離的Ca2+濃度升高、肌動蛋白應激纖維的形成進而引起內皮細胞骨架重新排列,引起血管滲漏及組織損傷[14-15]。而未分泌HBP的中性粒細胞,其相關活性則被完全抑制,這也證實該蛋白在中性粒細胞誘發的血管通透性改變中的關鍵作用。
本研究結果顯示,死亡組的HBP水平均明顯高于存活組,且HBP與EVLWI、PVPI始終保持顯著的相關性,提示HBP可以反映ARDS患者肺水腫的嚴重程度,早期HBP持續升高,可能提示ARDS患者預后較差。分析其原因可能為血管內皮細胞是HBP釋放后的靶細胞,其對血管內皮細胞功能的影響,主要表現為血管內皮通透性改變,進而導致血漿滲漏、肺泡水腫,這也是ARDS的病理生理特點[16],表現在臨床上的結果即為EWLWI的升高。Liu等人通過使用HBP氣管內滴注法建造老鼠模型,發現HBP氣管內滴注可以誘發高通透性肺水腫[17]。Tydén等研究顯示,ARDS患者收入ICU診療后48~72 h內,其血清HBP水平的增高,與患者低氧以及循環衰竭有關,而且與30d病死率具有一定的相關性,HBP能夠導致肺部毛細血管通透性增加,進而引起肺水腫或呼吸衰竭[18],與本研究結果相符。本研究進一步應用ROC曲線分析HBP預測膿毒癥相關ARDS患者死亡的風險,在入院ICU 24小時、入ICU 48小時,雖然AUC>0.6,但P>0.05,而在入ICU 72小時AUC為0.895,且P<0.001,當最佳臨界值為43.94ng/mL時,具有較高的敏感度(77.3%)和特異度為(90%)。
本研究的不足在于樣本量較少,尤其是死亡組患者,可能對統計結果造成偏倚,易出現假陰性結果,在今后的研究中需進一步增加樣本量,可采取多中心研究,擴大樣本量,并進一步研究不同病因導致的ARDS患者HBP水平變化的意義。
綜上所述,血清HBP水平與ARDS患者病情嚴重程度密切相關,一定程度上可以反映患者肺水腫情況。HBP監測僅需采取外周靜脈血送檢,對患者創傷較小,且相對廉價,在臨床上應用較為方便。
——過敏性休克和肺水腫的搶救流程

