非小細胞肺癌組織中缺氧誘導因子-2α、基質金屬蛋白酶7 的表達及臨床意義
段會娟,王希,陳嵐
河南科技大學第一附屬醫院病理科,河南 洛陽 471000
晚期肺癌患者預后較差,5 年生存率僅為15%,但對于早期肺癌患者,其治愈率和5 年生存率均可達到80%[1-2]。非小細胞肺癌占全部肺癌的80%,多數患者就診時已錯過最佳治療時間,5 年生存率較低[3]。早期肺癌患者可通過手術清除腫瘤細胞,在適合手術切除時,應首選手術治療。隨著臨床對非小細胞肺癌研究的不斷深入,有研究發現,有效的分子靶向治療藥物能夠提高患者的生存率。缺氧誘導因子(hypoxia-inducible factor,HIF)是人體普遍存在的一類轉錄因子,其中HIF-2α能夠增強腫瘤細胞的增殖能力,提高其侵襲性和轉移性,還能夠在肺中參與誘導腫瘤新生血管生成,同時促進凋亡基因產生,誘導細胞自噬[4-5]。HIF-2α因參與腫瘤的發展而成為肺癌精準治療的研究熱點。基質金屬蛋白酶7(matrix metalloproteinase 7,MMP7)參與腫瘤的浸潤和轉移過程,在多種惡性腫瘤中均呈高表達。本研究旨在探討非小細胞肺癌組織中HIF-2α、MMP7 的表達及臨床意義,現報道如下。
1 資料與方法
1.1 一般資料
收集2020 年1 月至2021 年1 月河南科技大學第一附屬醫院收治的非小細胞肺癌患者的病歷資料。納入標準:①經病理檢查確診為非小細胞肺癌;②臨床資料完整;③未發現其他部位轉移。排除標準:①合并嚴重感染;②合并心肝腎功能異常;③合并嚴重軀體性疾病;④存在活動性細菌或真菌感染。依據納入和排除標準,本研究共納入90 例患者。其中,男50 例,女40 例;年齡35~75歲,平均(45.22±5.12)歲;體重指數16~26 kg/m2,平均(22.35±2.25)kg/m2;腫 瘤 直 徑2~6 cm,平 均(4.25±0.22)cm。收集90 例患者的非小細胞肺癌組織和癌旁組織。本研究經醫院倫理委員會審批通過,所有患者均知情同意并簽署知情同意書。
1.2 免疫組化染色方法
1.2.1 HIF-2α檢測 ①脫蠟水化。將組織蠟塊連續切片,使用烤箱烤2 h,將干燥后的切片置于二甲苯中浸泡20 min,采用96%、70%、40%梯度乙醇水化。②抗原修復。滴加3%過氧化物酶,室溫孵育10 min,設置微波溫度為98 ℃,進行加熱,將切片置于耐高溫切片架中,于沸騰的檸檬酸緩沖液中加熱并浸泡30 min,次日采用磷酸鹽緩沖液(phosphate buffered saline,PBS)沖洗3 min,共3 次。③取出切片,甩干。滴加150 μl山羊血清封閉液,1 h后洗去,滴加HIF-2α單克隆抗體工作液,置于4 ℃冰箱中過夜,滴加生物素標記的二抗,PBS沖洗3 min,鹽酸乙醇分化,滴加顯色劑二氨基聯苯胺(diaminobenzidine,DAB),蘇木素復染5 min,中性樹膠封片。
1.2.2 MMP7 檢測 全部標本經10%甲醛溶液固定,連續切片,常規石蠟包埋,二甲苯脫蠟5 min,無水乙醇浸泡1 min,PBS 沖洗4 次,滴加MMP7 單克隆抗體,恒溫孵育1 h,PBS 沖洗4 次,加入DAB 顯色劑顯色,依次使用醋、鹽酸沖洗,中性樹膠封片。
1.3 免疫組化染色結果判定
由兩位經驗豐富的病理科醫師對切片位點的染色結果進行判定,在高倍鏡下(×400)觀察各個位點的50 個細胞,記錄染色強度和陽性細胞比例。染色強度評分:棕褐色為3 分,棕黃色為2 分,淡黃色為1 分,無色為0 分。陽性細胞比例評分:陽性細胞比例>75%為3 分,25%~75%為2 分,<25%為1分,無陽性細胞為0分。染色強度評分與陽性細胞比例評分相乘,>2分為陽性,≤2分為陰性。
1.4 觀察指標
比較非小細胞肺癌組織和癌旁組織中HIF-2α和MMP7 陽性表達率,比較不同臨床特征非小細胞肺癌患者非小細胞肺癌組織中HIF-2α和MMP7陽性表達率,分析HIF-2α與MMP7 表達的相關性。
1.5 統計學方法
采用SPSS 22.0 軟件對數據進行統計分析,計數資料以例數和率(%)表示,組間比較采用χ2檢驗;計量資料以均數±標準差(±s)表示,組間比較采用t檢驗;HIF-2α、MMP7 的相關性采用Spearman 等級相關性分析。以P<0.05為差異有統計學意義。
2 結果
2.1 非小細胞肺癌組織和癌旁組織中HIF-2α和MMP7 陽性表達率的比較
HIF-2α和MMP7 均主要表達于細胞質。非小細胞肺癌組織中HIF-2α陽性表達率為55.56%(50/90),高于癌旁組織的12.22%(11/90),差異有統計學意義(χ2=37.716,P<0.05);非小細胞肺癌組織中MMP7 陽性表達率為57.78%(52/90),高于癌旁組織的8.89%(8/90),差異有統計學意義(χ2=54.955,P<0.05)。
2.2 不同臨床特征非小細胞肺癌患者非小細胞肺癌組織中HIF-2α和MMP7 表達情況的比較
不同性別、年齡、吸煙史、腫瘤直徑、腫瘤類型非小細胞肺癌患者非小細胞肺癌組織中HIF-2α和MMP7 陽性表達率比較,差異均無統計學意義(P>0.05)。腺癌、低分化、有淋巴結轉移、臨床分期為Ⅲ~Ⅳ期非小細胞肺癌患者非小細胞肺癌組織中HIF-2α陽性表達率分別明顯高于鱗狀細胞癌、中高分化、無淋巴結轉移、臨床分期為Ⅰ~Ⅱ期的患者,差異均有統計學意義(χ2=35.583、23.223、9.720、22.952,P<0.01)。腺癌、低分化、有淋巴結轉移、臨床分期為Ⅲ~Ⅳ期非小細胞肺癌患者非小細胞肺癌組織中MMP7 陽性表達率分別明顯高于鱗狀細胞癌、中高分化、無淋巴結轉移、臨床分期為Ⅰ~Ⅱ期的患者,差異均有統計學意義(χ2=12.080、27.537、15.043、22.773,P<0.01)。(表1)
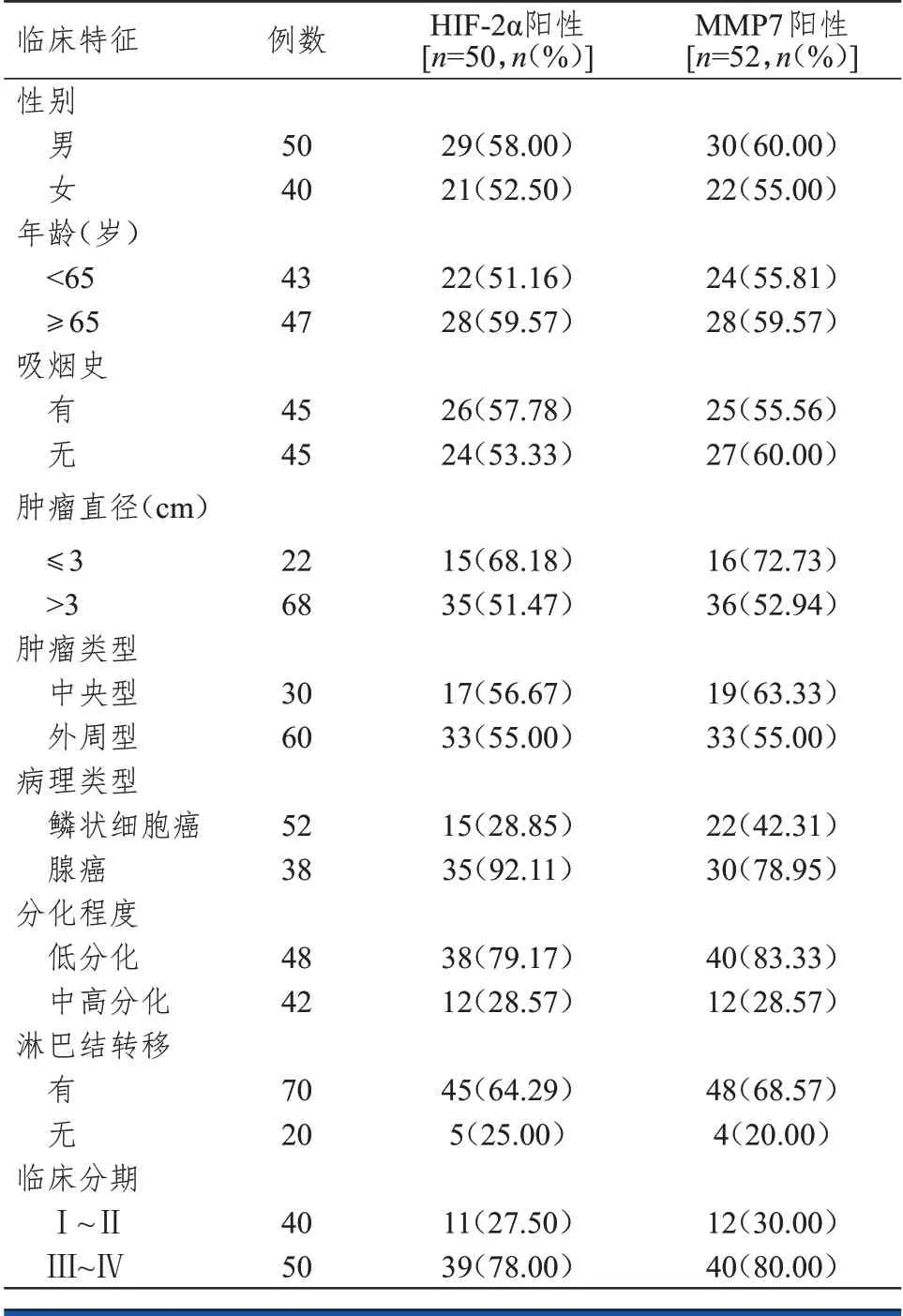
表1 不同臨床特征非小細胞肺癌患者非小細胞肺癌組織中HIF-2α和MMP7的表達情況
2.3 HIF-2α和MMP7 表達的相關性
經Spearman 等級相關性分析,HIF-2α與MMP7表達呈正相關(r=0.348,P<0.05)。(表2)
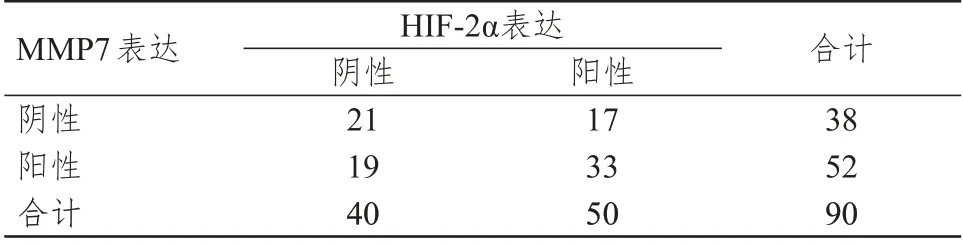
表2 非小細胞肺癌組織中HIF-2α和MMP7 的表達情況
3 討論
肺癌主要是原癌基因激活和抑癌基因失活的病理過程引起的,其臨床癥狀主要為咳嗽、發熱等。僅20%的肺癌患者在疾病早期能夠有效切除病灶,因此,對肺癌患者進行準確的病理分期可為治療策略制訂及預后評估提供依據[6-9]。肺癌的早期診斷率較低,病死率較高,手術切除是治療肺癌的主要方式,但術后患者的5 年生存率較低,死亡原因多數為遠處轉移和復發,提示手術切除并不能有效根治肺癌[10]。分析肺癌的生物學機制,選擇合適的分子標志物,有助于患者治療和預后判斷。隨著近年來分子生物學和免疫學的不斷發展,非小細胞肺癌的研究逐漸受到臨床關注,但目前關于非小細胞肺癌的分子生物學機制尚處于探索階段,其診斷及預后指標較多,且各有特點[11-12]。
缺氧是腫瘤惡性增殖過程中的普遍現象,腫瘤細胞能夠通過活化HIF 對缺氧產生應激反應[13]。HIF 對腫瘤細胞增殖的影響涉及細胞分化、細胞代謝等生物學過程。MMP7 可作用于細胞外基質和基底膜,進而參與腫瘤細胞的浸潤和轉移[14]。既往有研究顯示,MMP7 在外周血、骨髓、成纖維細胞中不表達,僅在上皮起源的腫瘤中表達,因此可通過檢測患者的外周血、骨髓中MMP7 水平判斷是否發生轉移[15-16]。本研究結果顯示,非小細胞肺癌組織中HIF-2α和MMP7 陽性表達率均高于癌旁組織,HIF-2α和MMP7 陽性表達與非小細胞肺癌病理類型、分化程度、淋巴結轉移情況、臨床分期密切相關,且HIF-2α與MMP7 表達呈正相關,表明HIF-2α和MMP7 在非小細胞肺癌中的異常表達與腫瘤的浸潤和轉移有關,聯合檢測有助于判斷患者預后。本研究中,HIF-2α主要表達于非小細胞肺癌的細胞質中,其在腫瘤壞死周圍均呈高表達,HIF-2α高表達反映其在缺氧調節中發揮作用[17-18]。在缺氧環境下,HIF-2α可增強腫瘤供血能力,增加無氧糖酵解以適應缺氧,同時HIF-2α可以增強腫瘤細胞的侵襲能力,提高化療耐受閾值[19-20]。MMP7 可減弱細胞外基質和腫瘤細胞的連接,加快腫瘤轉移,其在結直腸癌、胃癌等多種惡性腫瘤中均呈高表達,研究MMP7 在肺癌中的表達及臨床意義有助于判斷肺癌患者的預后[21-22]。腫瘤轉移是一個復雜的過程,是否形成轉移灶受機體免疫狀況、局部微循環等多個方面的影響,因此需要對參與研究的患者進行長期隨訪,明確HIF-2α和MMP7 與腫瘤轉移和復發的關系,尋找更科學有效的治療方案,在微轉移時給予針對性治療,扼殺早期的腫瘤細胞,爭取良好預后[23-24]。然而,本研究的樣本量較少,未進行長期隨訪,后續需要進行多中心、大樣本量的深入研究。
綜上所述,HIF-2α和MMP7 在非小細胞肺癌組織中高表達,其異常表達與腫瘤的浸潤和轉移有關。

