杜仲CONSTANS-like全基因組鑒定、系統進化及表達模式分析
劉 俊,李 龍,陳玉龍,劉 燕,吳耀松,任閃閃
(1. 河南中醫藥大學 中醫藥科學院 河南省中醫方證信號傳導重點實驗室,河南 鄭州 450046;2. 國際竹藤中心國家林業和草原局竹藤科學與技術重點開放實驗室,北京 100102;3. 國際竹藤中心 安徽太平試驗中心,安徽黃山 245700;4. 西北農林科技大學 林學院,陜西 楊凌 712100)
CONSTANS-like是植物中保守的一類鋅指蛋白轉錄因子,N端含有1個或2個由2個半胱氨酸組成C-X2-C-X16-C-X2-C(C為半胱氨酸,X為可變氨基酸)介導蛋白互作的B-box結構域[1],C端包含1個由43個氨基酸組成參與蛋白核定位的CCT(CONSTANS、CONSTANS-like、TOC1)結構域[2-3]。CO/CO-like(COL)基因家族已在多個物種中進行了報道,擬南芥Arabidopsis thaliana中鑒定到17個CONSTANS-like成員[2],水稻Oryza sativa中有17個[4],甜菜Beta vulgaris中有13個[5],大麥Hordeum vulgare中有9個[4],甘藍型油菜Brassica napus中有4個[6],小麥Triticum aestivum中有3個[7],挪威云杉Picea abies中含有2個COL成員[8]。
研究表明:COL基因具有功能多樣性,特別是在光響應介導的開花和生長調控方面[2,4-5,9]。CO基因的表達和蛋白穩定受生物鐘和光周期調節;長日照條件下,CO與FLOWERING LOCUS T (FT)啟動子結合,誘導FT基因表達,促進擬南芥提前開花[10-11],CO通過調節TERMINAL FLOWER 1 (TFL1)的表達,抑制FT誘導開花[12]。AtCOL9通過抑制CO基因表達,減緩FT轉錄,延遲開花[13]。在水稻中,超表達 OsCOL15 通過上調開花抑制因子 Ghd7 (grain number, plant height and heading date 7),下調激活因子RID1 (rice indeterminate 1)、 Ehd1 (early heading date 1)、 Hd3a (heading date 3a)、 FLT1 (FLOWERING LOCUS T1),導致開花延遲[14]。在長日照條件下,過表達甘菊Chrysanthemum lavandulifolium 的 ClCOL5誘導轉基因擬南芥提前開花[15]。大部分PheCOLs在毛竹Phyllostachys edulis葉片中表達量最高,具有顯著的光周期響應模式[16];在早竹Ph. violascens中,PvCO1和PvCO2主要在葉片中表達[17]。毛果楊Populus trichocarpa的PtCOLs優先在葉片中表達[18];銀杏Ginkgo biloba中GbCO基因主要在葉片和莖尖表達[19]。超表達PhCOL16提高轉基因矮牽牛Petunia corollas葉綠素含量,正調控葉綠素生物合成[20]。COL不僅參與開花調控,在植物發育和逆境脅迫中也發揮重要作用。AtCOL4提高轉基因植株鹽和脫落酸 (abscisic acid, ABA)耐受性[21],AtCOL7促進擬南芥側枝形成和下胚軸伸長[22]。
杜仲Eucommia ulmoides是單科、單屬、單種植物,雌雄異株,廣泛分布于陜西、河南、四川、貴州、云南等地,是中國特有的經濟樹種。因杜仲樹皮、根、葉、花和果實中均含有大量的白色絲狀杜仲橡膠,被譽為優質的天然橡膠樹種[23]。COL蛋白在植物生長發育的多個方面發揮重要作用,具有重要的藥用價值和橡膠用價值。杜仲COL基因家族系統進化及其在杜仲葉片生長發育和杜仲膠形成中的表達模式尚未報道。本研究以杜仲基因組數據為基礎,利用生物信息學分析方法,對杜仲CONSTANS-like基因家族進行全基因組鑒定、理化性質和系統進化分析,初步鑒定EuCOLs基因在杜仲葉片生長發育及杜仲膠生物合成中的功能,為進一步探索EuCOLs基因的功能提供理論依據。
1 材料與方法
1.1 材料
杜仲種植于西北農林科技大學苗圃(陜西楊凌)。取生長正常,長勢一致的2年生‘秦仲1號’‘Qinzhong 1’杜仲幼苗的葉芽(莖尖)、生長葉(3 cm長葉片)、幼葉(完全展開的新葉)、老葉(完全展開60 d葉片);取同一生長條件,與‘秦仲1號’相同發育時期的‘紫葉’杜仲E. ulmoides ‘Ziye’葉片,經液氮處理后凍存于-80 ℃冰箱,用于RNA提取。
1.2 方法
1.2.1 杜仲 COL 基因家族鑒定及理化性質分析 從杜仲基因組數據庫 Genome Warehouse (https://bigd.big.ac./gwh/Assembly/13/show)中下載COL蛋白候選序列,利用美國國家生物信息中心(NCBI)保守結構域搜索服務(CD Search)分析蛋白結構域,保留含有完整B-box和CCT結構域序列。通過在線軟件ProtParam(http://web.expasy.org/protparam/)分析蛋白理化性質,使用Plant-mPLoc (http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)預測EuCOLs蛋白亞細胞定位,利用在線工具ExPASY (https://www.expasy.org/tools)分析EuCOLs氨基酸數量、分子量、理論等電點,通過Expasy (https://web.expasy.org/protscale/)軟件分析蛋白的親疏水性,利用SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage=npsa_sopma.html)軟件預測蛋白的二級結構。
1.2.2 杜仲 COLs 基因 scaffold 定位及系統進化分析 通過杜仲基因組數據庫,查找 EuCOLs 基因在scaffolds上的位置以及scaffolds長度,使用DNAMAN軟件進行EuCOLs蛋白序列比對,通過Clustal X1.83軟件對杜仲、水稻、擬南芥、毛果楊和玉米Zea mays的COLs蛋白進行多序列比對,利用MEGA 6.0的鄰接法(neighbor-joining),重復次數設置為1 000次[24],構建系統發育樹。
1.2.3 杜仲 COLs 基因結構、基序及啟動子分析 利用 GSDS (http://gsds.gao-lab.org/index.php)軟件分析EuCOLs基因結構,通過 MEME (http://meme-suite.org/)對 EuCOLs進行基序分析 (參數是:any number of Repetitions (anr),maximum number of Motifs= 20,minimum width≥6,and maximum width≤50)。通過Clustal X 1.83比對和DNAsp5軟件分析EuCOLs同源基因對,并計算非同義替換率(non-synonymous substitution rate, Ka) 和同義替換率 (synonymous substitution rate, Ks)。杜仲同源基因復制和分離的時間(t)由公式 t=Ks/1.3×10-8計算[16]。利用 Plant CARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/htmL/)軟件對EuCOLs基因啟動子(ATG)上游2 000 bp序列進行查找分離,進行啟動子順式作用元件分析。
1.2.4 杜仲 EuCOL 基因家族表達模式分析 從 NCBI的 Short Read Arshive (SRA)數據庫中下載‘秦仲1號’不同發育時期葉片(葉芽、初生葉、幼葉、老葉,版本號:SRP218063)[25]及不同膠含量杜仲品種(高產膠杜仲品種‘秦仲2號’‘Qinzhong 2’、低產膠杜仲品種‘小葉’‘Xiaoye’含量,版本號:SRP158357)[26]的轉錄組數據,利用1百萬個映射上的堿基中映射到外顯子的1千個堿基上的堿基個數(fragments per kilobase million,FPKM)值表示 EuCOLs基因相對表達豐度 (A),對該數值取對數 (Log2A)進行統計分析,通過TBtools工具繪制基因表達圖譜[27]。
利用Trizol (天根DP424)試劑提取‘紫葉’杜仲的葉芽(莖尖)、生長葉(3 cm長葉片)、嫩葉(完全展開的新葉)總 RNA,反轉錄合成 cDNA,利用 Quant Studio 6 (Life Technologies公司,新加坡),All-in-One SYBR Premix EX TaqTM kit (Gene Copoeia 公司,美國)進行實時熒光定量 PCR (qRT-PCR)反應,10.0 μL 反應體系: 2×mix 5.0 μL、正向引物/反向引物各 0.25 μL、cDNA 2.0 μL、ddH2O 2.5 μL。反應程序:95 ℃ 預變性 5 min,95 ℃ 變性 10 s,60 ℃ 退火 10 s,72 ℃ 延伸 20 s,45 個循環。內參基因為UBC E2[28],使用法對3次生物學重復的數據進行分析。
1.2.5 杜仲 COL7 蛋白互作分析 利用 STRING 軟件 (https://string-db.org/),選擇擬南芥數據庫進行序列比對,根據已知擬南芥COLs蛋白互作關系,預測EuCOL7互作蛋白,通過Cytoscape 3.7.0軟件進行評估和預測[16]。
2 結果與分析
2.1 杜仲COL基因家族鑒定及理化性質分析
通過Genome Warehouse數據庫,從杜仲基因組中共查找到8個EuCOLs基因,利用Pfam和NCBI的Conserved Domain Search軟件,驗證EuCOLs蛋白保守結構域。結果顯示:8個EuCOLs蛋白均含有B-box和CCT結構域,分別命名為EuCOL1~EuCOL8。通過ExPASy工具,對EuCOL家族成員進行理化性質分析,EuCOL3蛋白序列最長,編碼469個氨基酸,EuCOL7序列最短,編碼315個氨基酸,分子量分布區域為 35.21~52.65 kDa,等電點范圍是 5.10 (EuCOL1)~6.47 (EuCOL6),亞細胞定位預測結果顯示:EuCOLs均定位在細胞核中(表1),屬于疏水性蛋白,8個EuCOLs分布于8條scaffolds。
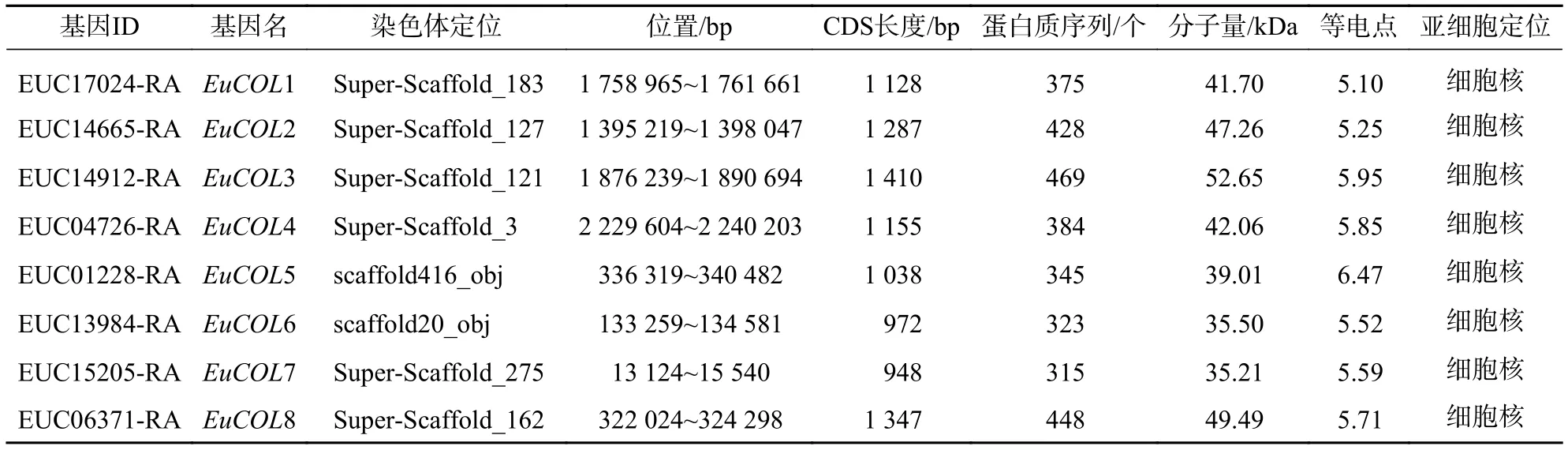
表1 杜仲 CO-like 蛋白序列特征及亞細胞定位預測Table 1 Sequence characteristics and predicted subcellular location of E. ulmoides CO-like proteins
2.2 杜仲 COLs 蛋白系統進化分析
為了分析杜仲EuCOL基因家族的進化關系,將8個EuCOLs蛋白與17個擬南芥AtCOLs、水稻OsCOLs、ZmCOLs和14個毛果楊PtCOLs[18]導入MEGA 6.0軟件,通過鄰接法構建系統發育樹,73個COLs蛋白分為3個亞家族(分別是群組 Ⅰ、群組 Ⅱ和群組 Ⅲ)(圖1)。群組Ⅰ亞家族包含2個B-box和1個CCT結構域,由28個COLs蛋白組成,包含2個EuCOLs蛋白(EuCOL6和EuCOL7);群組Ⅱ亞家族含有1個B-box、1個CCT和1個分化的鋅指結構域,所含COLs蛋白數量最少,有15個COLs蛋白,分別含有4個AtCOLs,3個PtCOLs蛋白和OsCOLs蛋白,5個ZmCOLs蛋白,不含EuCOLs蛋白;群組Ⅲ亞家族由1個B-box和1個CCT結構域組成,所含蛋白數量最多,包含30個COLs蛋白,有6個EuCOLs蛋白,進化關系顯示杜仲與毛果楊親緣關系最近。
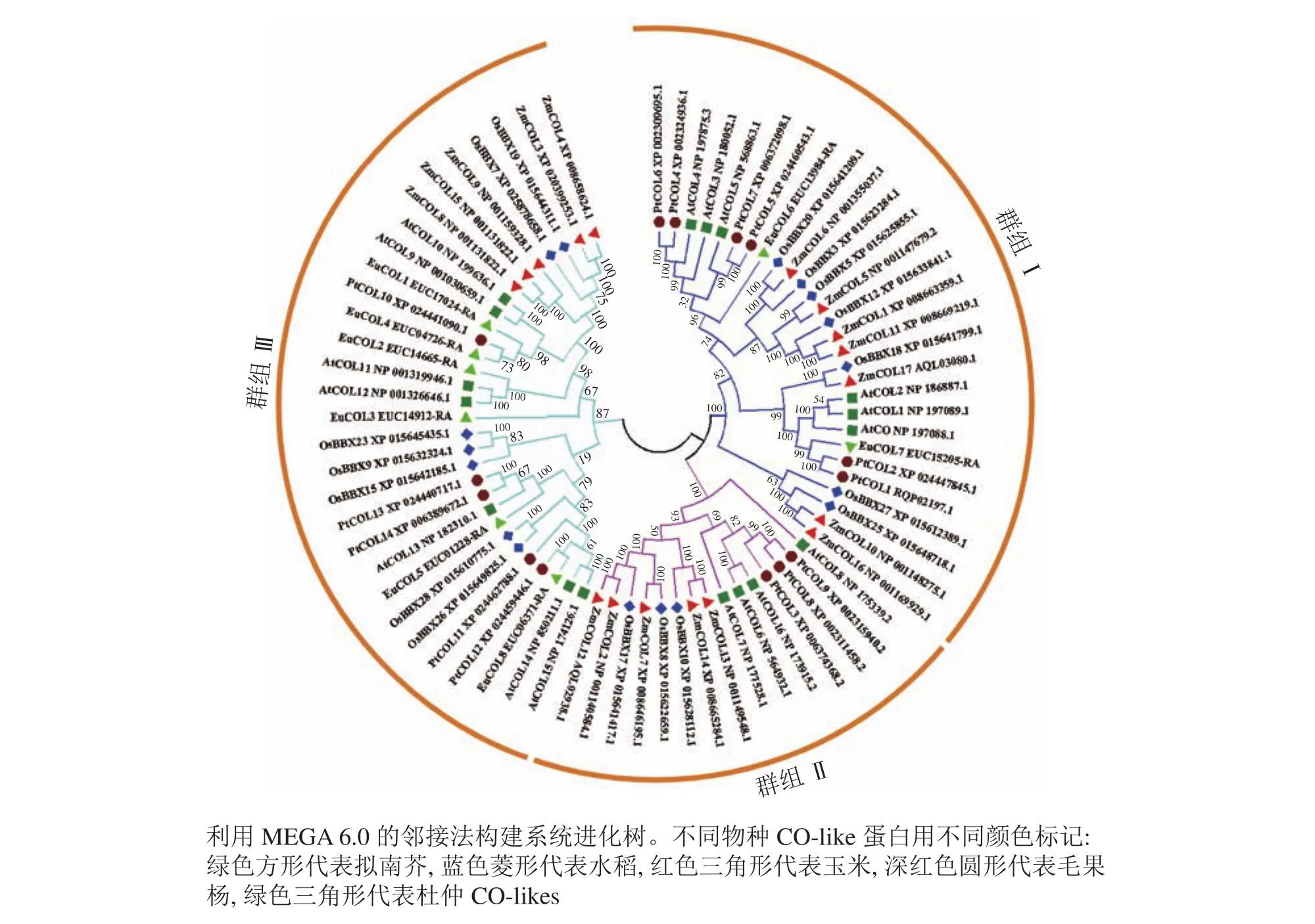
圖1 杜仲、水稻、擬南芥、毛果楊和玉米CO-likes蛋白系統進化樹Figure 1 Phylogenetic tree of CO-like proteins from E. ulmoides, O. sativa, A. thaliana, P. trichocarpa and Z. mays
2.3 杜仲 COLs基因結構與基序分析
為了進一步分析EuCOLs基因的保守性和多樣性,對EuCOLs基因結構及蛋白基序進行了分析,結果顯示:EuCOLs基因結構較為簡單(圖2),EuCOL1和EuCOL6分別含有2個和3個外顯子,4個EuCOLs基因含有4個外顯子,EuCOL2和EuCOL3外顯子數目最多,含有6個外顯子。
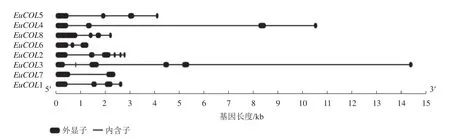
圖2 杜仲 COLs 基因結構分析Figure 2 Structural analysis of COLs in E. ulmoides
利用MEME在線軟件,對EuCOLs家族進行保守基序分析,基序鑒定個數設置為20,分別命名為motif 1~motif 20。結果如圖 3 所示:motif 1 和 motif 2 為 EuCOLs 蛋白的特征性結構域,存在于所有EuCOLs蛋白中。只有EuCOL7含有1個B-box結構域,其余EuCOLs蛋白均由2個B-box組成,這與圖2蛋白序列比對結果一致。同一亞家族EuCOLs基序具有高度相似性,其中motif 1包含1個典型的由C-X2-C-X16-C-X2-C編碼的GATA鋅指結構域。不同亞家族基序存在顯著差異,例如:motif 7和motif 14只存在于群組Ⅲ亞家族,motif 12只在群組Ⅱ亞家族中存在。EuCOLs蛋白之間基序也有差異,只有EuCOL1和 EuCOL4 含有 motif 5、motif 7 和 motif 9,motif 10 僅存在于 EuCOL2,推測基因功能差異可能與基序有關。

圖3 EuCOLs 蛋白保守基序分析Figure 3 Conservative motif analysis of EuCOL proteins
2.4 杜仲 COLs啟動子順式作用元件分析
利用Plant CARE軟件對EuCOLs起始密碼子(ATG)上游2 000 bp序列進行順式作用元件分析(圖4)。EuCOLs啟動子中不僅包含基本順式作用元件,還存在3種類型元件。①脅迫響應元件,如干旱脅迫響應元件MBS;低溫響應元件LTR;厭氧脅迫相關元件ARE等。②光響應元件,如Box 4、G-box、GBox、GT1-motif、I-box、GATA-motif、TCCC-motif等。③激素響應元件,如赤霉素響應元件ABRE;生長素響應元件AuxRR-core;水楊酸響應元件CGTCA-motif等。推測EuCOLs可能參與杜仲生長發育、脅迫響應以及光周期調控。EuCOLs基因中光響應元件數量最多,共79個,包含18個Box 4,G-box和GT1-motif均有12個,暗示EuCOLs基因的轉錄可能受光周期調控。EuCOLs啟動子區域含有16個ABRE和14個ARE元件(圖4B),推測EuCOLs可能參與ABA調節和厭氧調控。
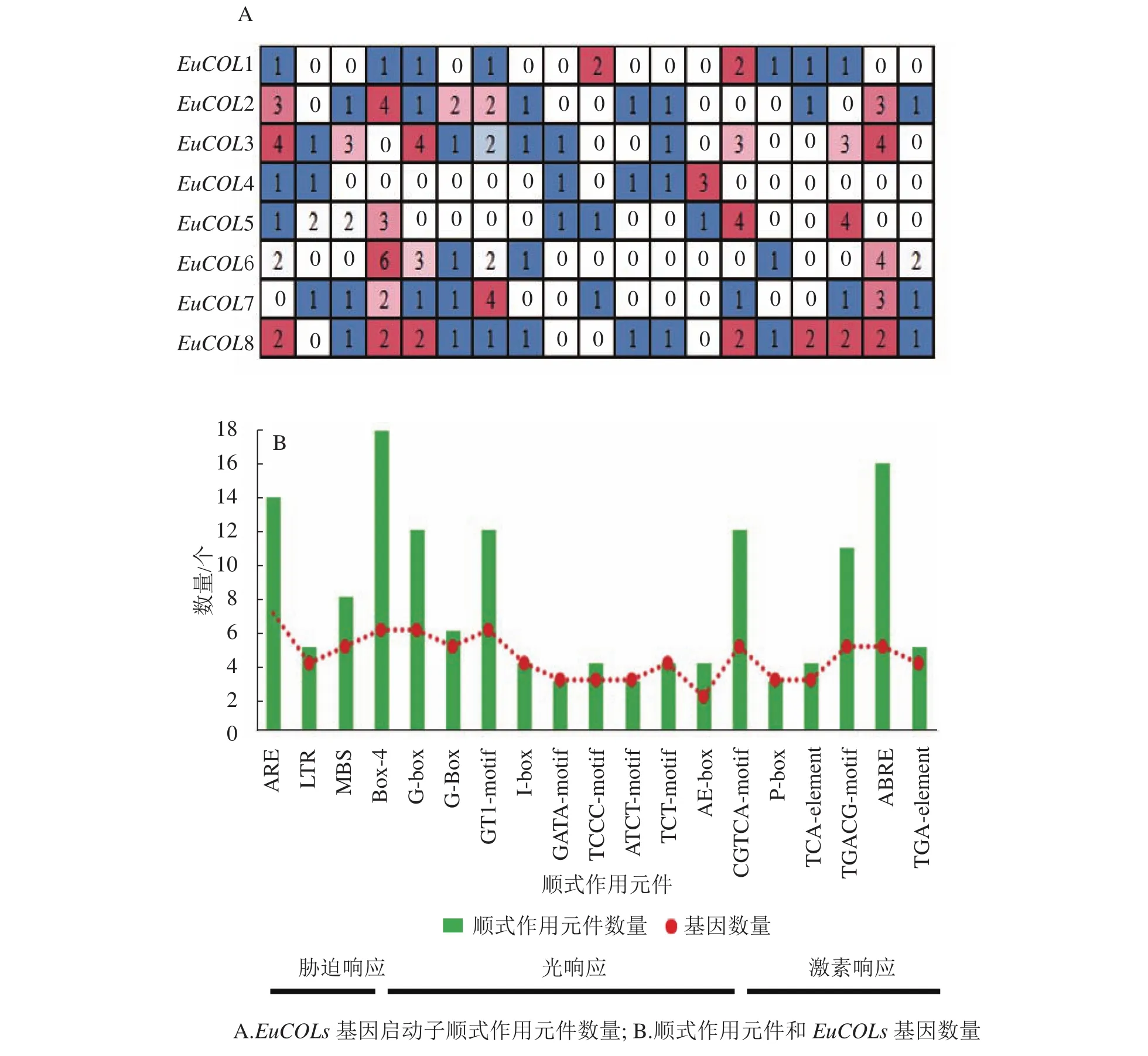
圖4 EuCOLs 啟動子順式作用元件分布Figure 4 Cis-elements distributed in the promoters of EuCOLs
2.5 杜仲 COLs基因表達模式分析
為了探索EuCOLs基因在杜仲葉片發育中的功能,利用杜仲葉片不同發育時期的轉錄組數據,進行表達模式分析。圖5顯示:EuCOLs在杜仲葉片發育中轉錄水平較低,大部分基因FPKM值小于1,EuCOL6在杜仲葉片中不表達,暗示EuCOLs在杜仲葉片中發揮作用較小,EuCOL5在葉片中的轉錄水平相對較高,并且隨著葉片發育,轉錄水平逐漸升高,推測EuCOL5在杜仲葉片中可能發揮正調控作用。
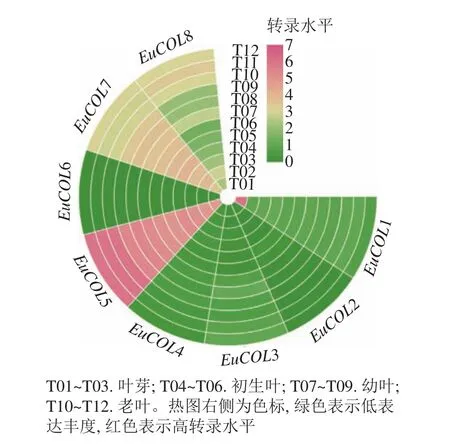
圖5 EuCOLs 基因在杜仲葉片不同發育時期表達模式Figure 5 Expression patterns of EuCOLs genes at different development stages of E. ulmoides leaves
利用高產膠杜仲品種‘秦仲2號’和低產膠杜仲品種‘小葉’成熟葉片轉錄組數據,檢測EuCOLs基因的表達水平,結果如圖6所示。大部分EuCOLs轉錄水平較低,只有EuCOL5和EuCOL7的表達量較高,EuCOL7在各樣品中的FPKM值大于150,并且高膠含量葉片中的轉錄水平高于低膠含量葉片,推測EuCOL7在杜仲膠形成過程中發揮正調控作用,相反EuCOL5在‘小葉’中的轉錄水平高于‘秦仲2號’,暗示EuCOL5在杜仲膠形成中可能發揮負調控作用。
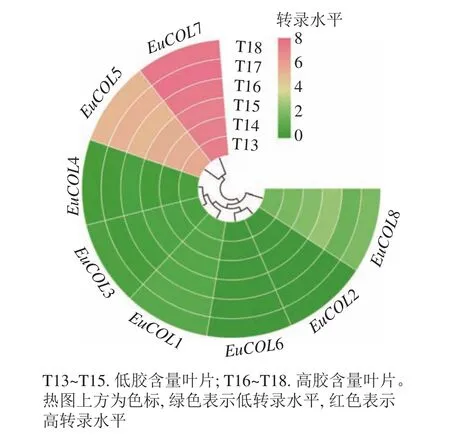
圖6 EuCOLs 基因在杜仲膠形成中的表達模式Figure 6 Expression pattern of EuCOL genes in the formation of eurubber
為了驗證EuCOLs基因在杜仲葉片發育中的表達模式 ,以‘紫葉’杜仲不同發育階段的葉片為材料,通過qRT-PCR檢測EuCOLs基因的表達水平。結果顯示:EuCOLs在杜仲葉片中差異表達(圖7),EuCOL1和EuCOL4在葉芽中表達量最高,隨著葉片發育,表達水平逐漸降低,嫩葉中降為最低,暗示EuCOL1和EuCOL4在杜仲葉片發育的起始階段發揮重要作用;相反EuCOL7隨著葉片發育轉錄水平逐漸升高,嫩葉中的表達量是葉芽中的5.8倍,推測EuCOL7在杜仲成熟葉片中扮演重要角色。5個EuCOLs基因(EuCOL2、EuCOL3、EuCOL5、EuCOL6和EuCOL8)在幼葉中表達量最高,在葉片發育中,呈現先升高后降低的表達趨勢。
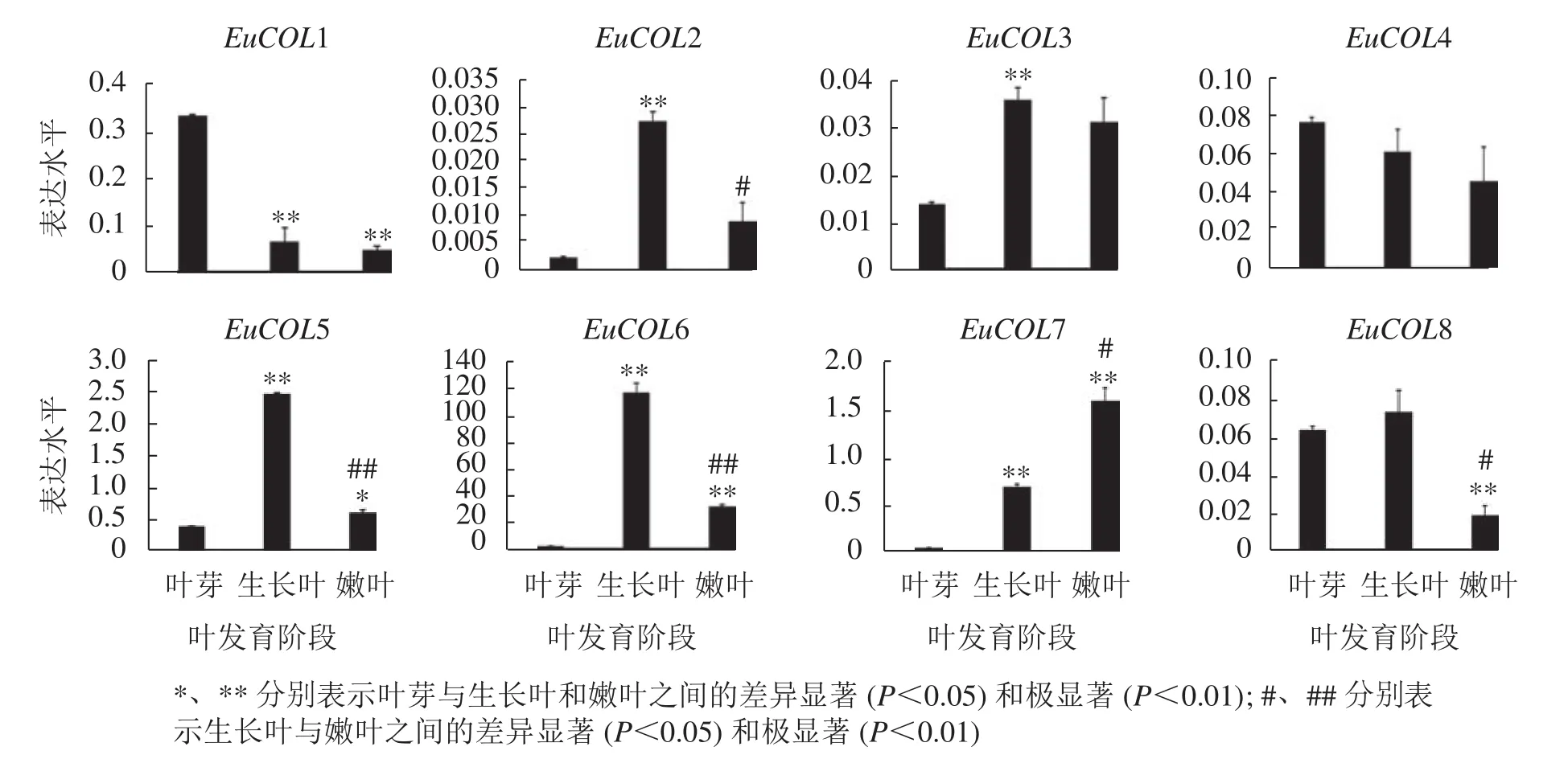
圖7 杜仲 COL 家族基因在葉片發育中的表達模式Figure 7 Expression patterns of E. ulmoides COL family genes during leaf development
2.6 杜仲 COL7 蛋白互作網絡預測
表達模式分析顯示:EuCOL7在杜仲葉片發育和杜仲膠形成中均具有較高表達量,暗示EuCOL7在葉片發育和杜仲膠形成中發揮重要作用。利用STRING軟件,預測EuCOL7與其他蛋白質的互作關系。結果顯示:EuCOL7可以與10個蛋白質發生相互作用(圖8),其中3個屬于BBX蛋白質家族,LHY、CCA和JAC家族各有1個,7個蛋白質(LNK2、LHY、CCA、RVE、COL、BBX25和BBX19)參與光周期響應。
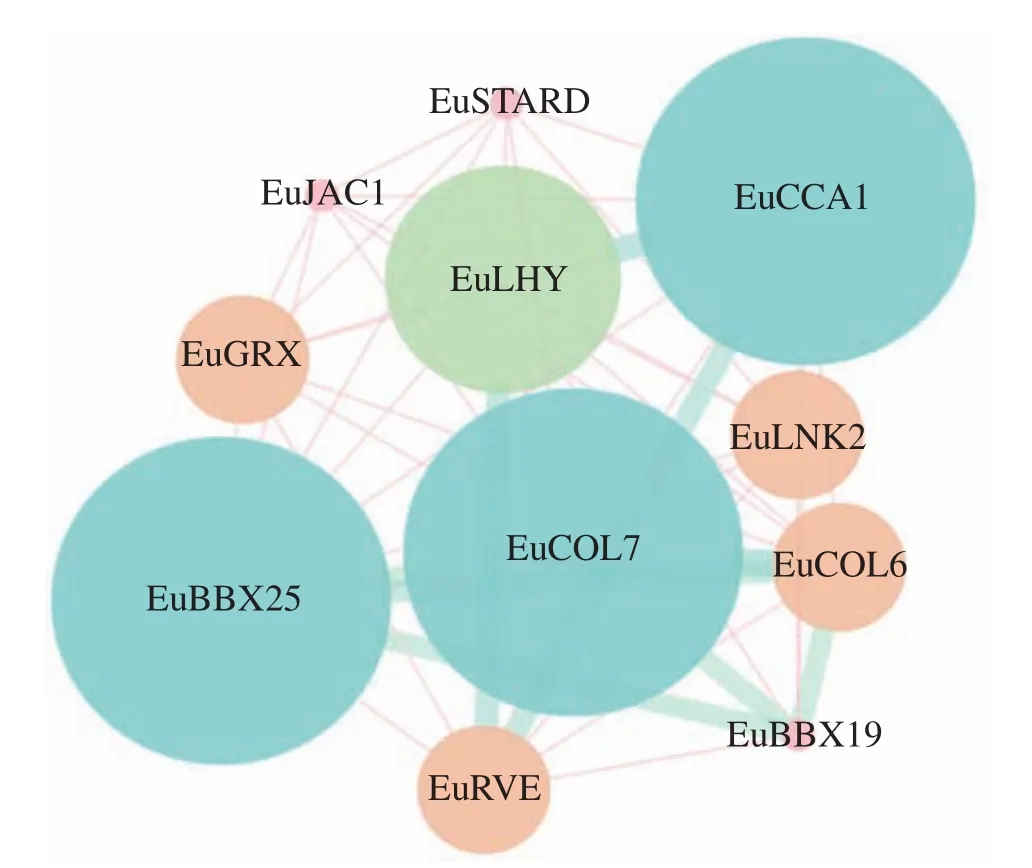
圖8 EuCOL7 蛋白互作網絡預測Figure 8 Prediction of interaction network between EuCOL7
3 討論
杜仲具有重要的經濟價值、藥用價值和生態價值,廣泛分布于中國27個省(市、自治區)[29]。COL(CONSTANS-like)基因是植物光周期途徑重要的調控基因。在營養生長階段,COL基因在葉片中表達;光周期途徑中,COL可將光信號和生物鐘信號轉變為開花信號,誘導成花基因FT、LFY表達,促進植株開花[30-31]。本研究以杜仲基因組數據為基礎,通過生物信息學方法,搜索杜仲CONSTANS-Like基因家族,共鑒定到8個EuCOLs基因,根據基因組注釋位置,8個EuCOLs基因分別映射到8條特定的染色體上,表明EuCOLs基因在染色體上均勻分布。
系統進化結果顯示:EuCOLs分為2個亞家族(群組Ⅰ和群組Ⅲ),分別包含2和6個EuCOLs蛋白。在擬南芥中,AtCO、AtCOL1~AtCOL5屬于群組Ⅰ亞家族,含有2個B-box和1個CCT結構域,超表達AtCOL3延長轉基因擬南芥開花時間[32],在短日照條件下,超表達AtCOL5可以促進FT和SOC1基因表達,誘導擬南芥提前開花[33]。大麥HvCO1和Hd1基因與CO親緣關系最近,可以通過激活HvFT1誘導大麥開花[4],擬南芥co突變體過表達牽牛花Pharbitis nil的PnCO基因可促進植物開花[34]。黑麥草Lolium perenne的LpCO可以互補擬南芥co突變體晚花表型[35],毛果楊PtCO促使植株提前開花,也可調控植株的生長和芽的分化[36]。群組Ⅲ亞家族含有1個B-box和1個CCT結構域。在擬南芥中,AtCOL6~AtCOL8和AtCOL16屬于群組Ⅲ亞家族,AtCOL7和AtCOL8在開花調控中是轉錄抑制因子,超表達AtCOL7和AtCOL8導致轉基因擬南芥開花延遲[22,37-38],推測EuCOLs可能也參與杜仲開花調控。
蛋白序列比對結果顯示:EuCOLs與擬南芥、毛果楊COLs蛋白結構域具有高度的相似性,N末端含有1~2個典型的B-box結構域,C端包含1個CCT結構域。B-box1和B-box2結構域保守氨基酸殘基分布相似,B-box1結構域中的5個Cys殘基和2個His殘基比其他氨基酸殘基更保守,B-box2結構域中的第1個組氨酸(His)殘基被蘇氨酸(Thr)取代或者丟失(EuCOL2和EuCOL7)。在葡萄Vitis vinifera中,VviBBX9和VviBBX10蛋白B-box2結構域中的第1個His殘基被天冬酰胺(Asn)取代[39],暗示EuCOL2和EuCOL7可能具有特異的功能。
外顯子-內含子結構與基因系統進化存在密切關系,外顯子-內含子的增加或減少有助于基因家族的擴展和多樣化[40]。結構分析顯示:EuCOLs基因含有2~6個外顯子,EuCOL2含有6個外顯子,其同源基因EuCOL8含有4個外顯子,EuCOL3和EuCOL6分別含有6和3個外顯子,而EuCOL5和EuCOL7分別含有4和2個外顯子,推測EuCOLs在進化過程中可能存在外顯子丟失現象,這與葡萄VviBBXs蛋白情況類似[39]。基序分析發現:motif 1和motif 2分別編碼B-box和CCT結構域,存在于所有EuCOLs轉錄因子,同一亞家族EuCOLs蛋白motifs分布較為相似,不同亞族之間有差異。
EuCOLs啟動子中含有多個脅迫、激素和光周期響應元件,其中光響應元件數量最多,共有79個,暗示EuCOLs可能參與杜仲光周期調節。研究表明:COLs基因參與多種植物光周期開花調控,在矮牽牛中,PnCO和PnCOL1具有顯著的晝夜振蕩節律,PnCO可以恢復擬南芥co突變體晚開花表型[41-42];大部分香蕉Musa acuminate的MaCOLs基因表達量在白天達到峰值,夜晚降為最低[43]。楊樹PttCO1和PttCO2黃昏時表達水平開始增加,黎明時達到峰值[44]。短日照條件下,OsCOL3通過抑制Hd3a和RFT基因表達,導致水稻延遲開花[45],OsCOL13和OsCOL10在開花中發揮負調控作用[46-47];超表達HvCO1和ClCOL3促進開花[15,48]。EuCOLs在杜仲雄花芽苞葉原基分化中期和雄蕊原基分化初期差異表達,EuCOL7在雄蕊原基分化初期上調表達,EuCOL1下調表達[49],表明EuCOLs參與杜仲開花調控。
大量研究表明:COLs不僅調控植物開花,還參與非生物脅迫以及生長發育等生物學過程[22,50]。擬南芥STO與CONSTNS結構相似,超表達STO提高轉基因植株的耐鹽性[51]。在菊花Chrysanthemum morifolium中,Cm-BBX24-RNAi轉基因株系開花提前,冷凍和干旱脅迫耐受性降低,光周期和赤霉素生物合成相關基因上調表達,表明Cm-BBX24在菊花開花時間和非生物脅迫中發揮多重作用[52]。低溫誘導葡萄葉片、莖和花中VvZFPL基因上調表達,超表達VvZFPL導致轉基因擬南芥下胚軸伸長,蓮座葉變小,葉綠素含量降低[53],提高轉基因擬南芥低溫、干旱和鹽脅迫耐受性[54]。AtCOL4基因表達受ABA、高鹽和滲透脅迫的誘導,在種子萌發和子葉綠化過程中,atcol4突變體增加ABA和鹽脅迫的敏感性[21]。表達模式分析顯示:大部分EuCOLs在杜仲葉片發育中表達水平較低,各發育階段轉錄水平無顯著差異。EuCOL5轉錄水平相對較高,尤其在老葉中;EuCOL7在幼葉中表達量最高。在杜仲膠形成中,EuCOL5在‘小葉’中高量表達,EuCOL7在‘秦仲2號’中表達水平最高。qRT-PCR結果顯示:EuCOL1和EuCOL4在葉片發育起始階段表達量最高,EuCOL7隨著葉片發育,轉錄水平逐漸增加,EuCOL2、EuCOL3、EuCOL5、EuCOL6和EuCOL8在葉片發育中,呈現先升高后降低的表達趨勢,表明EuCOLs在杜仲葉片發育中具有功能差異性。
蛋白互作網絡結果顯示:EuCOL7可以與10個蛋白質互作,10個蛋白質中有7個(LNK2、LHY、CCA、RVE、COL、BBX25和BBX19)參與光周期調控,推測EuCOL7參與杜仲光周期響應,具體互作蛋白還需實驗驗證。在毛竹中,PheCOLs具有顯著的晝夜振蕩表達模式,光照抑制大部分PheCOLs基因表達,黑暗誘導。酵母單雜交結果顯示:PheCOL14可以與PheCOL3啟動子結合[16]。在擬南芥中,LHY屬于同源域蛋白超家族,參與晝夜調控,與APRR1/TOC1和TCP21/CHE的啟動子結合,抑制其轉錄,并抑制CCA1基因表達[55-56]。AtCOL5在維管組織中表達,超表達AtCOL5導致開花提前,然而AtCOL5缺失突變體并不影響開花時間,暗示AtCOL5可能與其他開花調控因子存在功能冗余現象[33]。

