紫外/氯胺高級氧化法降解水中四環素的研究
朱永娟,李健鵬,孔德挺,朱衍鑫,夏余佳
(惠州學院化學與材料工程學院,廣東 惠州 516000)
在過去的幾十年里,由于抗生素在醫藥、畜牧業和水產養殖業等領域的廣泛應用,在各種水體(污水、地表水和飲用水)中均檢測到ng·L-1甚至mg·L-1水平的抗生素[1-3]。其中,TC是生產和使用第二高的抗生素,導致它在水生環境中經常被檢測到[4-5]。TC對人類和生態系統的潛在危害主要在于抗生素耐藥菌和耐藥基因的不斷擴大[6-7]。然而,由于其生物抗性和化學穩定性,通過混凝、沉淀、過濾和消毒等常規處理工藝難以去除水中的TC[4-6]。因此,開發先進的處理技術以去除水中的TC勢在必行。
最近的研究表明,NH2Cl作為一種新型的氧化消毒劑具有替代其他氯基消毒劑的趨勢和潛力[19]。與游離氯相比,NH2Cl雖然是一種較弱的消毒劑,但是當它與有機前體反應時,會降低(飲用水消毒副產物DBPs)如三鹵甲烷(THMs)和鹵代乙酸(HAAs)的形成[20-21]。此外,與游離氯相比,NH2Cl可以保持更穩定的余氯。然而,由于其穩定性和低反應性,單獨的NH2Cl 的消毒時間通常比氯的消毒時間長,而且對于水中新興污染物的降解效率較低。應運而生的UV/NH2Cl工藝似乎可以通過產生OH·和RCS有效解決上述問題,因此受到廣泛關注[22-23]。然而,目前對于UV/NH2Cl的研究還不夠深入和全面。深入研究UV/NH2Cl的工藝參數以及作用機制,對于其在水處理中的應用具有指導意義。
本研究選擇TC作為目標化合物,主要目的是研究TC在紫外光解、氯胺化和UV/NH2Cl過程中的降解效果;同時研究NH2Cl用量和反應溶液初始pH對TC降解行為的影響。
1 實驗部分
1.1 材料與試劑
四環素(TC)由阿拉丁實業有限公司(上海)提供。H2SO4、NaOH和氯化銨(NH4Cl)購自國藥化學試劑有限公司(上海)。所有溶液用水均使用超純水。每天新鮮制備NH2Cl溶液,方法是將NaClO溶液緩慢加入攪拌的NH4Cl 溶液中,n(Cl)∶n(N)=0.8,pH為8.5,反應時間為0.5 h。
1.2 實驗方法
光催化實驗在配備有75 W的低壓汞燈(發射波長253.7 nm)的自制光催化反應器(圖 1)中進行。實驗溫度保持在(25±1)℃。實驗前,至少提前30 min打開紫外燈,以確保穩定的紫外發射。 通過將NH2Cl溶液添加到裝有20 mg·L-1的TC溶液的250 mL的敞口燒杯中進行實驗,以實現0.005~0.025 mol·L-1的初始NH2Cl 濃度。此外,利用H2SO4和NaOH溶液調節反應溶液的初始pH值為5.0~9.0。在一定反應時間后用注射器吸取1.0 mL反應溶液過0.45 μm濾膜后立即用0.1 mol·L-1的Na2S2O3淬滅,并在4℃下避光保存,用于通過島津紫外分光光度計UV-2600i分析溶液中TC的濃度。UV直接光解和氯胺降解TC的對照實驗以類似的方式進行,只是缺少氯胺添加和UV照射的條件。

圖1 自制光催化反應器
2 結果與討論
2.1 不同工藝降解四環素的性能研究
圖2顯示了在pH為7.0的條件下通過單獨紫外照射、單獨氯胺工藝以及UV/NH2Cl聯合工藝去除水中TC的效果。結果表明,紫外/NH2Cl工藝對TC的降解明顯高于單獨的紫外照射或氯胺工藝。單獨UV照射在360 s內僅降解了1.9% 的TC,這也驗證了TC結構的光穩定性。此外,通過單獨氯胺工藝在360 s內大約只降解了0.2%的TC。與之形成鮮明對比的是,通過UV/NH2Cl組合工藝處理在360 s內實現了4.5%的TC去除。顯然,UV/NH2Cl組合工藝顯著增強了TC的降解。這也證明了對紫外光和氯胺對于TC降解的協同作用,這可能是由于NH2Cl的光解產生OH ·和RCS[24]。
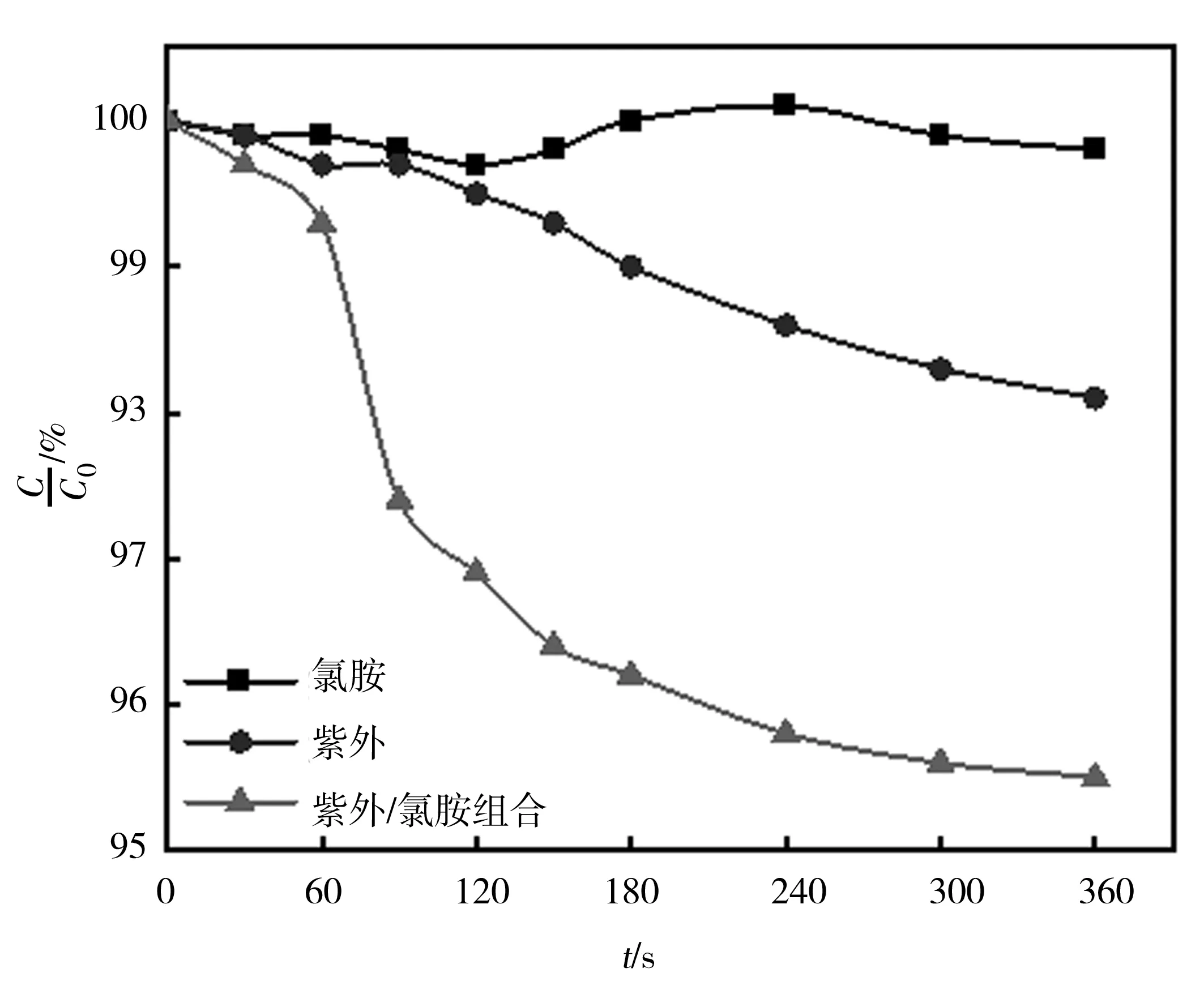
圖2 不同工藝降解四環素的性能研究
2.2 不同環境因子對四環素降解的影響
為了在提高TC的降解性能的同時確定催化體系中的最佳反應條件,本文考察了NH2Cl濃度以及反應體系初始pH對TC降解的影響。
2.2.1 NH2Cl濃度對四環素降解的影響
圖3展示了不同濃度NH2Cl 下通過UV/NH2Cl體系氧化TC的降解曲線。
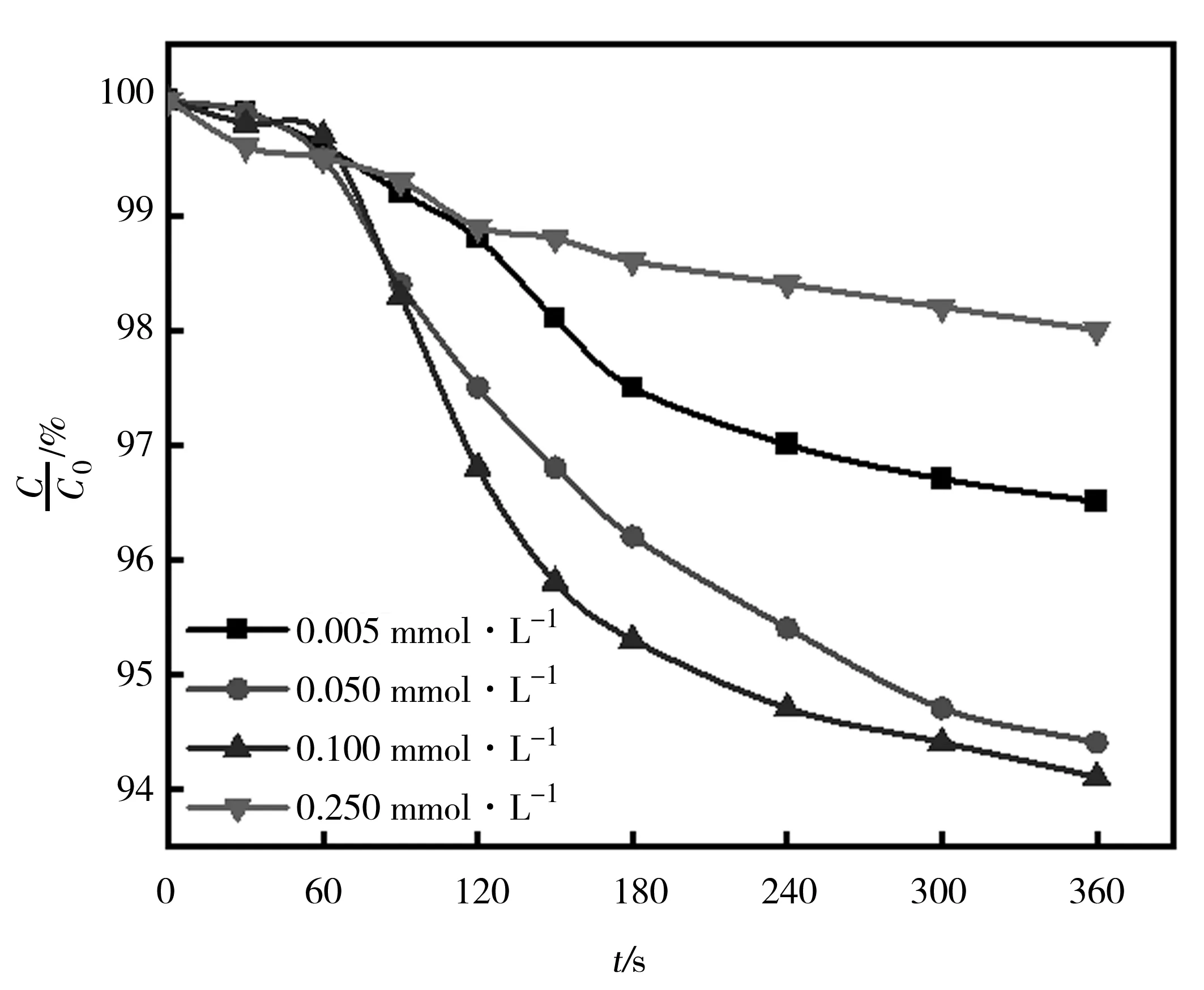
圖3 不同濃度NH2Cl對UV/NH2Cl體系降解四環素效果
對于UV/NH2Cl工藝,隨著反應體系中NH2Cl的濃度從0.005 mmol·L-1增加到0.100 mmol·L-1,體系中TC的降解率由3.5%上升到5.9%。這可能歸因于通過更多氯胺的光解產生更多的活性自由基。但隨著體系內NH2Cl的濃度進一步增加到0.25 mmol·L-1,TC的降解效果呈現出下降的趨勢,經過360 s僅有2.0%的TC被降解。這可能是由于過量的 NH2Cl 與體系內產生的反應活性物種反應生成了一些具有低氧化能力的自由基[6,25]。
2.2.2 不同初始pH值對四環素降解的影響
圖4顯示了初始溶液pH值對UV/NH2Cl體系中TC降解效果的影響。如圖4所示,該體系中的TC降解效果表現出高度的pH依賴性。對于UV/NH2Cl組合工藝,隨著溶液pH從5.0增加到7.0,TC的降解率從1.9%增加到4.5%。然而,當溶液的pH值不斷增加到9.0時,TC的降解率又下降到2.6%。TC的pH依賴性首先可歸因于TC的吸收光譜和質子化狀態。前人研究發現,TC的吸光度隨著pH的升高而升高,當pH為4.0時最小,這導致TC在酸性條件下的光解效率降低[26]。此外,在堿性條件下NH2Cl的自分解減少,這導致產氯量可能有所減少,進而造成了TC降解效果下降[19]。

圖4 不同pH值對UV/NH2Cl體系降解四環素效果
3 討論與結論
UV/NH2Cl組合工藝中紫外線以及氯胺對TC降解效果表現出協同作用,該協同作用使得TC在UV/NH2Cl處理下的降解效果要優于單獨UV或者氯胺處理的效果。此外,TC在UV/NH2Cl組合工藝中的降解表現出較高的pH依賴性,而酸性或者堿性條件下會抑制該體系中TC的降解,而在中性條件下TC可以在360 s內實現4.5%的降解效果,這可能是RCS在 UV/NH2Cl 過程中對TC降解發揮了最重要的作用。

