基于slit-RoBo信號通路探討骨碎補總黃酮對誘導膜技術骨重建的作用機制
黃錦陽,吳凡,袁靈梅,曾志奎,戈陽華,熊偉,郭靈,潘斌
(1.江西中醫藥大學研究生院,南昌330004;2.江西中醫藥大學附屬醫院,南昌330006)
節段性骨缺損的重建具有挑戰性,其治療難度大、周期長、失敗率及致殘率高,困擾著臨床骨科醫生[1-2]。傳統的治療方法為:骨缺損<5 cm多采用自體骨移植,而骨缺損>5 cm的修復方法包括帶血管自體腓骨移植和牽張成骨技術,但均存在一定的局限性[3-5]。Masquelet等[6]于2000年首次描述的誘導膜技術,已被臨床證明是重建節段性骨缺損的有效手段。相關基礎研究[7-8]發現誘導膜組織含有豐富的血供,并可分泌大量生長因子。豐富的血供對成骨至關重要,因新生血管在運輸營養及排泄細胞代謝的垃圾的同時,可提供成骨所需的骨髓間充質干細胞 (Mesenchymal Stem Cells,MSCs)。最新研究[9]表明slit-RoBo信號通路在血管新生、干細胞調節等多個生理功能中起作用,且成骨細胞通過SHN3/SLIT3軸參與了CD31hiEmcnhi血管偶聯成骨的過程。Gruber HE等[10]研究發現在誘導膜及新生骨組織中含有大量的成骨細胞,說明在誘導膜技術中很可能存在著slit-RoBo信號通路調控CD31hiEmcnhi偶聯成骨機制。中藥骨碎補具有補腎壯骨功效,在促進骨形成與骨修復方面療效確切,同時具有促進誘導膜局部血管新生的作用。然而,骨碎補總黃酮對誘導膜技術骨重建的干預機制和靶點尚不清楚,有待進一步探究。本研究通過建立大鼠股骨Masquelet誘導膜模型并采用骨碎補總黃酮干預,檢測局部成骨、血管新生和slit-RoBo信號通路相關關鍵細胞因子的表達,研究結果如下。
1 材料與方法
1.1 材料 實驗采用48只SD大鼠(雄性SPF級),鼠齡8~10周,體重約260~280 g(由江西中醫藥大學動物實驗中心提供,動物許可證號SCXK[(贛)(2018-0003)]。大鼠分籠飼養,溫度22~24℃,4只/籠,適應性喂養1周后進行實驗。實驗過程中對動物的處置遵照中華人民共和國科學技術部2006年頒布的《關于善待實驗動物的指導性意見》標準,采用過量麻醉處死,動物尸體交由江西中醫藥大學實驗動物中心處理。器材與試劑:自制不銹鋼大鼠股骨6孔鋼板及截骨導板,直徑1.5 mm皮質骨自攻螺釘(江蘇百舍醫療器械有限公司),總RNA提取試劑盒(上海Promega公司),PMMA骨水泥(國械注進20143656033),反轉錄試劑盒(美國Thermo公司)。藥物:強骨膠囊(北京岐黃制藥有限公司生產,國藥準字Z20030007,0.25 g/粒,有效成分為骨碎補總黃酮),青霉素(主要成分青霉素鈉,80萬U/瓶,國藥準字H13020657)。
1.2 方法
1.2.1 實驗動物分組及造模前準備 依據體重分層結果隨機分為空白組、模型組、中藥中劑量組、中藥高劑量組4個組,每組12只(前期實驗已表明中藥中、高劑量組對誘導膜作用效果確切)。術前禁食24 h,不禁水。按體重予2%戊巴比妥鈉腹腔麻醉(0.2 mL/100 g),左側大腿青霉素8萬U肌肉注射預防感染。
1.2.2 手術步驟 一期造模方法同筆者前期所發表文獻[11]的手術步驟,除空白組外均放置骨水泥進行曠置。二期造模:于骨水泥曠置6周后進行,術前準備同前。75%乙醇消毒大鼠尾巴,鋪無菌單,縱行切開,取兩節段大鼠尾骨,剝離尾骨上附著組織、剪碎。沿大鼠右大腿原切口小心切開誘導膜,取出PMMA骨水泥塊,于骨缺損區填充剪碎的尾骨粒(見圖1),小心縫合誘導膜組織,防止尾骨粒散開,關閉傷口,8周后取材進行指標檢查。
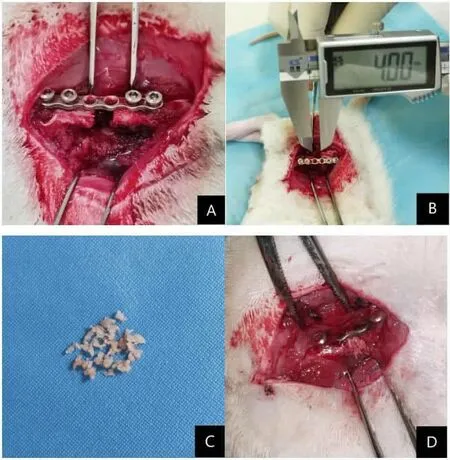
圖1 造模及植骨過程
1.2.3 術后處理 術后禁食12 h,正常進水。每期手術后連續5 d,肌注青霉素8萬U以預防感染。單籠飼養,5 d后予同組合籠。
1.2.4 藥物干預 按動物等效服藥量按體表面積計算,為78.75 mg(mg-1·d-1)。因此干預濃度分別為:高濃度157.5 mg(mg-1·d-1)、中濃度78.75 mg(mg-1·d-1)。使用純水制成對應濃度溶液灌胃,按預期每500 g體重灌胃2 mL,予等量純水對空白組、模型組大鼠進行灌胃。灌胃時間為二期植骨術后第2 d至第8周取材當天,1次/d。
1.3 指標檢查
1.3.1 X線拍攝 二期植骨術后8周拍攝實驗側股骨標準正、側位X片。拍片結果采用Lane-Sandhu法進行影像學評分,見表1。
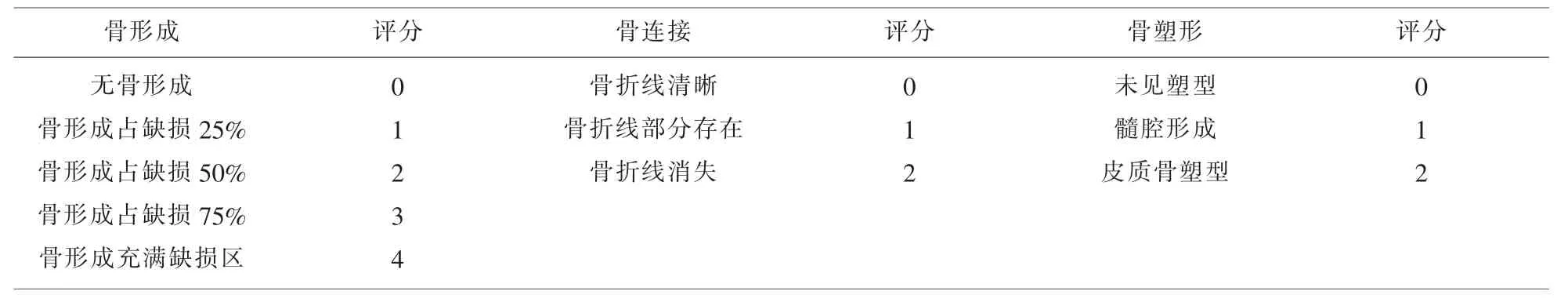
表1 La ne-Sa ndhu X射線評分表
1.3.2 PCR檢測新生骨組織中CD31、Emcn、slit3、ROBOm R NA的表達 每個樣本稱取100 mg左右冰凍新生骨組織液氮研磨成粉末狀,采用Trizol提取樣本組織總RNA,紫外分光光度計測定總RNA純度濃度。熒光定量PCR檢測新生骨組織中相關mRNA的表達情況,反應條件如下:95℃15 min,95℃15 s,60℃60 s延伸,40個循環,溶解曲線確認產物是否為特異性擴增。
1.4 統計學分析 采用SPSS 22.0軟件進行統計分析,計量資料采取(±s),行正態性檢驗后,滿足正態分布的組間數據比較采用單因素方差分析;不符合正態分布的數據則采用秩和檢驗,P<0.05為差異有統計學意義。
2 結果
實驗期間所有大鼠未出現死亡,4只大鼠傷口縫線在術后第1 d裂開,經對癥處理后順利愈合,亦無螺釘松動等并發癥。
2.1 X線檢查結果 空白組可見少量骨痂形成,不足骨缺損區域25%;模型組成骨約占骨缺損區域50%,骨折線部分消失,但重建皮質薄弱;中藥中劑量組可見骨形成占缺損75%以上,骨折線模糊,尚見少許骨皮質未連續;中藥高劑量組則骨形成充滿缺損區,骨折線消失及骨皮質重建可(見圖2)。
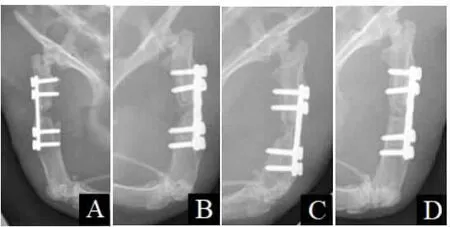
圖2 各組大鼠股骨缺損區成骨X線比較
2.2 新生骨組織相關基因RT-PCR相對表達量模型組較空白組CD31、Emcn、slit3、ROBO m R NA的表達提高,差異有統計學意義(P<0.05);而中藥中、高劑量組相關基因的表達相比模型組明顯上調(P<0.05),見圖3。
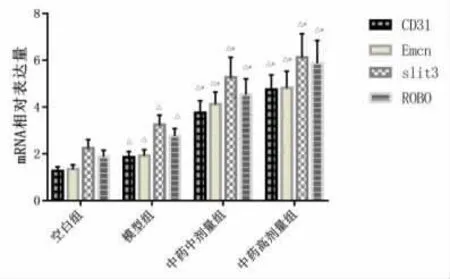
圖3 各組新生骨組織中CD31、Emcn、s lit3、ROBOm R NA的表達
3 討論
傳統“二元調控”理論認為,成骨細胞與破骨細胞功能偶聯調控骨形成與重建過程。但最新研究[12-13]發現成骨的微環境除成骨、破骨外,還與骨內血管新生有密切關系,其中CD31hiEmcnhi血管可調節骨內微血管生長、產生獨特的新陳代謝和分子微環境,可維持血管周圍的骨組細胞和偶聯成骨,是具有調節成骨作用的新成員。
Slit-Robo細胞信號通路廣泛存在于生物體內,與神經發育、血管生成、組織器官發育以及干細胞的增殖調節等均有關。Slit3是成骨細胞中發現的一種SHN3新型配體,最早發現于中樞神經系統中,可通過ROBO受體來調節神經軸突的生長,被證實為大鼠模型和人體組織工程中的促血管新生因子。既往研究[14-15]發現Schnurri3調節蛋白(adaptor protein Schnurri3,SHN3)可抑制成骨細胞活性,敲除SHN3基因小鼠模型可以募集大量的造血元素到骨痂處以致形成成熟的板層骨,這說明成骨細胞亦通過SHN3/SLIT3軸參與了CD31hi-Emcnhi血管偶聯成骨的過程。誘導膜含有豐富的血管網,并存在大量的成骨細胞,故我們認為在誘導膜骨重建過程中很可能存在Slit-Robo信號通路調控CD31hiEmcnhi偶聯成骨機制,值得進一步探究,查閱相關文獻,尚無相關報道。
骨碎補是補腎法的代表藥物,研究[16-17]表明其有效成分骨碎補總黃酮不僅可加速骨缺損區域骨組織重建,還可通過上調血管內皮舒張因子及VEGF的表達從而促進血管生成。本研究采用骨碎補總黃酮干預大鼠股骨Masquelet誘導膜骨重建過程。該研究X線影像學結果提示中藥組較空白組和模型組骨缺損區骨痂形成明顯增加,提示骨碎補總黃酮可促進誘導膜技術骨缺損區骨痂形成,加速其二期骨重建。同時研究還證實模型組新生 骨 組 織 中CD31、Emcn、slit3、ROBOm R NA的 表達較空白組提高,筆者認為空白與模型組對照也有陽性結果是由于模型組放置骨水泥后形成誘導膜,誘導膜中生長因子促進CD31hiEmcnhi血管新生,加速成骨。而中藥高、中劑量組相比模型組有明顯的上調,從而表明骨碎補總黃酮通過調控Slit-Robo信號通路介導血管偶聯成骨,促進誘導膜技術二期骨重建。
綜上所述,該研究肯定了誘導膜骨組織重建過程中CD31hi Emcnhi血管偶聯成骨與Slit-Robo信號通路的相關性,初步揭示了骨碎補總黃酮促進誘導膜技術二期骨重建的分子生物機制。預期為中藥干預誘導膜技術提供新靶點,有助于解決誘導膜技術二期移植骨血管化、礦化緩慢的關鍵性問題。

