FCGR3A和FCGR3B基因拷貝數變異對HBV感染轉歸的影響
李昊天, 王同同, 李緒桐, 郜玉峰
安徽醫科大學第一附屬醫院 感染病科, 合肥 230022
HBV感染后的臨床轉歸與病毒、宿主免疫及宿主遺傳因素密切相關[1],慢性HBV感染可誘導體內固有免疫和特異性免疫反應,常伴有肝損傷和炎癥[2]。由病毒復制引起的持續或反復的炎癥增加了慢性乙型肝炎(CHB)發展為肝衰竭甚至肝癌的風險[3]。目前對HBV感染機制的認識還存在許多不足,其結果受多種因素的影響,包括自我限制的消除或持續耐受。除了與病毒本身、宿主的免疫反應、年齡和性別有關外,越來越多的證據[4-5]表明人類遺傳變異中拷貝數變異(copy number variant,CNV)可能在HBV感染慢性化中起作用。以往綜合分析的研究[6]表明,IgG Fcγ受體(FcγR)的表達與HBV感染的不同免疫階段有關。FcγRⅢA和FcγRⅢB編碼的免疫球蛋白G Fc段受體Ⅲa(Fc gamma receptors 3A,FCGR3A)和免疫球蛋白G Fc段受體Ⅲb(Fc gamma receptors 3B,FCGR3B)基因位于CNV的染色體1q23.3位點,這個位點可改變相應受體的表達和對抗原的免疫效力[7-8]。免疫細胞上活化的FcγRⅢ可參與調節一系列免疫應答,如清除免疫復合物和抗體依賴的細胞毒性作用,并進一步促進炎癥反應[9]。在復雜的免疫過程中產生的促炎細胞因子進一步影響HBV感染的結果[10]。FCGR3A和FCGR3B基因 CNV是否通過改變基因表達水平從而影響HBV感染后的轉歸尚不清楚。
1 資料與方法
1.1 研究對象 選取2014年1月—2018年12月安徽醫科大學第一附屬醫院和第二附屬醫院感染病科住院和門診慢性HBV感染患者841例,其中CHB患者444例,肝硬化(LC)274例,肝細胞癌(HCC)123例。另外再納入性別、年齡、種族相匹配的296例自限性HBV感染者。所有病例診斷均符合《慢性乙型肝炎防治指南(2015年版)》[11]。慢性HBV感染的診斷標準:HBsAg陽性6個月以上。自限性HBV感染者的入選標準:抗-HBc和抗-HBs陽性,HBsAg陰性,血清ALT水平正常,HBV DNA低于檢測下限,且均未接種乙型肝炎疫苗。排除標準:酒精或非酒精性因素所致脂肪肝、自身免疫性肝病、合并HIV或其他嗜肝病毒感染(甲、丙、丁、戊)、不明原因肝功能障礙及其他嚴重全身性疾病。
1.2 觀察指標 采集患者的年齡、性別、實驗室指標。實驗室指標包括ALT、AST、HBV DNA、HBeAg等指標。使用bs330全自動生化分析儀檢測ALT(正常范圍9~50 U/L)、AST(正常范圍15~40 U/L);在ABI7500熒光定量PCR儀上使用HBV DNA定量檢測試劑盒進行HBV DNA的檢測;HBV DNA檢測下限為500 IU/mL。采用酶聯免疫吸附劑測定(ELISA)檢測HBV血清學指標。
1.3 基因組DNA的提取和CNV的檢測 每位患者采集5 mL全血置于抗凝管中。根據QIAGEN試劑盒(QIAGEN, Hilden, Germany)的說明書進行基因組DNA提取,提取后置于-80 ℃保存,用于后續的DNA基因型檢測。FCGR3的基因拷貝數采用AccuCopy試劑盒(上海天昊生物科技有限公司)進行定量,采用文獻[12]報道的方法,合成FCGR3特異性引物和競爭模板(表1),根據要求將一定量的競爭DNA與適量樣本DNA混勻,進行多重熒光競爭性PCR擴增,采用毛細管電泳法分離DNA片段,采用 GeneMapper 4.0軟件分析。通過目的基因與內參基因S/C值比較,進行均一化處理,得到FCGR3基因拷貝數。以上實驗重復3次,以保證實驗的準確性和真實性。

表1 FCGR3A和FCGR3B基因擴增引物
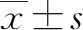
2 結果
2.1 兩組HBV感染者基線特征比較 慢性HBV感染組平均(44.11±15.87)歲,自限性HBV感染組平均(42.13±15.27)歲;兩組男女性別比分別為673∶168和224∶72,兩組年齡(t=1.870,P=0.062)、性別(χ2=2.486,P=0.115)差異均無統計學意義。
依據HBV慢性感染后不同疾病進展狀態將患者分為CHB組、LC組和HCC組。3組間性別差異無統計學意義(P=0.180),年齡、ALT、AST、HBeAg差異均有統計學意義(P值均<0.05)(表2)。

表2 慢性HBV感染者不同分組的基線特征
2.2 兩組HBV感染者FCGR3A和FCGR3B拷貝數的分布 對841例慢性HBV感染者和296例自限性HBV感染者的FCGR3A和FCGR3B基因 CNV進行定量分析。將得到的拷貝數量化后,受試者的頻率分布范圍為2~8拷貝。CNV的中位數為4拷貝,對于FCGR3A, 4拷貝在慢性HBV感染組和自限性HBV感染組中的比例分別為65.5%和62.2%,而FCGR3B分別為64.5%和62.9%(表3)。

表3 兩組HBV感染者FCGR3A和FCGR3B拷貝數分布情況
2.3 兩組HBV感染者FCGR3A和FCGR3B基因拷貝數的分布頻率比較 根據CNV的中位數將所有樣本分為低拷貝(≤3)、中拷貝(=4)和高拷貝(≥5)三類。分析顯示,FCGR3A基因CNV在慢性HBV感染組和自限性HBV感染組之間的頻率分布有顯著性差異(χ2=11.406,P=0.003),這與FCGR3B一致(χ2=19.143,P<0.001)(表4)。

表4 兩組HBV感染組FCGR3A和FCGR3B拷貝數分布頻率差異
2.4 慢性HBV感染組不同疾病進展階段患者FCGR3A和FCGR3B基因拷貝數分布頻率比較 CHB組、LC組、HCC組中FCGR3A、FCGR3B CNV分布頻率差異無統計學意義(表5)。HBeAg血清轉換與否與機體的免疫功能密切相關,將所有慢性HBV感染者按照HBeAg狀態進行分為陽性組和陰性組,比較FCGR3基因CNV在兩組間的分布差異,結果顯示,FCGR3基因CNV在HBeAg陽性組和陰性組之間沒有統計學差異(P值均>0.05)(表6)。

表5 慢性HBV感染組不同疾病進展患者FCGR3基因拷貝數分布頻率比較

表6 慢性HBV感染組不同HBeAg狀態患者FCGR3 基因拷貝數分布頻率比較
2.5 FCGR3 CNV在慢性HBV感染后轉歸中的作用 將年齡、性別、拷貝數作為自變量,患者HBV感染后的轉歸(急性/慢性)作為因變量,進行logistic回歸分析。其中FCGR3A基因和FCGR3B基因拷貝數減少或缺失增加HBV感染者慢性化的風險,OR及(95%CI)分別為0.621(0.513~0.752)、0.594(0.491~0.719),結果提示FCGR3A基因和FCGR3B基因拷貝數目減少或缺失是HBV感染慢性化的危險因素(表7)。

表7 FCGR3A和FCGR3B CNV與慢性HBV感染后轉歸的關系
3 討論
CNV可以造成宿主基因拷貝數的改變,并通過基因序列位置的改變影響基因的表達,并進一步影響疾病的易感性和疾病進展[13]。越來越多的報道[14-16]證明CNV在人類感染和自身免疫性疾病中起著至關重要的作用,包括HIV-1感染、系統性紅斑狼瘡和潰瘍性結腸炎。既往研究[17]表明CNV影響HBV感染的結果。慢性HBV感染可誘導體內固有免疫和特異性免疫反應,FCGR3基因編碼的FcγRⅢ可介導固有免疫和適應性免疫的多種免疫功能。在一些自身免疫性疾病和炎癥性疾病中已經檢測到FCGR3 CNV,但其在HBV感染中的特異性作用尚不十分清楚。
既往研究[18]表明,FcγR介導的抗體效應功能在病毒持續感染過程中受損或被抑制。Jin等[6]發現HBV感染免疫耐受期FcγRⅢB的表達低于清除期的表達,免疫耐受階段可能會導致病毒感染的持續存在。此外,血清IgG水平升高是慢性感染性疾病的臨床特征,與疾病進展密切相關[19]。FCGR識別并結合免疫復合物(immune complexs,IC),這是由IgG抗體與其同種抗原結合形成的。Willcocks等[20]證實了FCGR3B CNV與受體的表達和IC的攝取之間的顯著相關性。另一項研究[21]證實,FCGR3B基因表達降低與循環IC清除率降低有關,這將促進炎癥性疾病的發展。本研究通過對HBV感染后不同轉歸患者外周血FCGR3基因的CNV分析發現,自限性HBV感染組與慢性HBV感染組之間在FCGR3基因拷貝數分布頻率上存在差異,與自限性HBV感染組相比,慢性HBV感染組FCGR3A基因和FCGR3B基因的拷貝數減少或缺失的比例更高,差異有統計學意義。本文因納入因素有限,模型擬合度較低(FCGR3A:R2=0.038,FCGR3B:R2=0.045),但研究模型分析對疾病的轉歸和病程進展具有一定的價值。
在HBV感染不同免疫狀態的基因和通路研究中,熒光定量PCR分析發現免疫清除期患者FcγRⅢA和FcγRⅢB的表達水平明顯高于免疫耐受期HBV感染者和健康對照[6]。一般來說,免疫清除期反映了對HBV的免疫應答[22],FcγRⅢA可以通過免疫受體酪氨酸基活化基元(immunoreceptor tyrosine-based activation motif,ITAM)誘導細胞信號轉導,ITAM與FcγR鏈有關,當IgG濃度達到一定水平時,ITAM以一種特殊的構象傳導抑制信號,阻止炎癥細胞浸潤和炎癥介質產生,這有助于控制炎癥疾病的發生發展[23-24]。對于FcγRⅢB,認為另一種可能的機制是FCGR3B的高拷貝數和具有抗炎活性的循環可溶性FcγR水平升高之間存在相關性[20]。
綜上所述,FCGR3A基因和FCGR3B基因拷貝數目減少或缺失是HBV感染慢性化的遺傳易感因素之一,但與疾病進展無關。FCGR3基因CNV在HBV感染中的具體機制值得進一步探討。由于本研究僅涉及中國漢族患者,這些發現是否與其他民族慢性HBV感染的結果一致有待進一步研究。
倫理學聲明:本研究于2012年2月18日通過安徽醫科大學生物醫學倫理委員會審核批準,批號:2012102。所有患者均簽署知情同意書。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突。
作者貢獻聲明:李昊天、王同同負責實驗和數據分析及文稿撰寫;李緒桐負責數據收集及文獻檢索;郜玉峰負責文稿的構思、潤色和最后定稿。

