藥物快速衛(wèi)生技術(shù)評(píng)估方法學(xué)研究
劉夢(mèng)娜 吳斌 艾丹丹 許倩 李雪 陳金榆 郭武棟

關(guān)鍵詞抗腫瘤用藥;快速衛(wèi)生技術(shù)評(píng)估;衛(wèi)生技術(shù)評(píng)估;多準(zhǔn)則決策分析
生命科學(xué)、生物科技、醫(yī)藥技術(shù)的創(chuàng)新層出不窮、日新月異,提高了健康預(yù)期目標(biāo),而不斷增長(zhǎng)的健康需求與衛(wèi)生健康事業(yè)發(fā)展不平衡、不充分成為各個(gè)國(guó)家和地區(qū)衛(wèi)生健康決策者普遍面臨的現(xiàn)實(shí)問(wèn)題。近些年來(lái),面對(duì)新技術(shù)的廣泛應(yīng)用、醫(yī)療費(fèi)用的快速增長(zhǎng)和醫(yī)療衛(wèi)生體制改革中的利益調(diào)整,很多國(guó)家和地區(qū)開(kāi)展了衛(wèi)生技術(shù)評(píng)估(health technology assessment,HTA)工作,通過(guò)科學(xué)規(guī)范的證據(jù)分析和全面系統(tǒng)的綜合評(píng)估,為醫(yī)療資源配置的循證決策提供了可靠依據(jù)和選擇方案,為醫(yī)療技術(shù)準(zhǔn)入、配置、定價(jià)、補(bǔ)償、管理和淘汰等政策的制定提供了證據(jù)支持。
上述循證決策需求促進(jìn)了HTA方法學(xué)的研究和應(yīng)用。HTA方法學(xué)包括傳統(tǒng)的完整HTA以及相對(duì)較新的快速衛(wèi)生技術(shù)評(píng)估(rapid health technology assessment,rHTA)。完整HTA的質(zhì)量較高,通常需要1~2 年的評(píng)估時(shí)間來(lái)完成。然而,衛(wèi)生健康決策者往往需要及時(shí)的技術(shù)信息,以便在保證科學(xué)嚴(yán)謹(jǐn)性的前提下,用相對(duì)較短的時(shí)間推進(jìn)決策。rHTA能夠快速收集與整合證據(jù),整個(gè)評(píng)估過(guò)程較HTA大幅縮短,是一個(gè)新興的方法學(xué)領(lǐng)域,并越來(lái)越受到不同類(lèi)型決策者的青睞。實(shí)證研究領(lǐng)域已經(jīng)有了比較完整HTA和rHTA的相關(guān)研究,兩種評(píng)估方法學(xué)的研究結(jié)果都表明,完整HTA包含更多細(xì)節(jié),但通過(guò)完整HTA和rHTA得出的總體結(jié)論是相似的[1-4]。
本研究以多準(zhǔn)則決策分析(multi-criteria decisionanalysis,MCDA)與HTA 為基礎(chǔ)的Evidence and ValueImpact on Decision Making(EVIDEM)框架為綱,以抗腫瘤藥物為抓手,探索建立基于我國(guó)國(guó)情的抗腫瘤用藥rHTA方法學(xué),具體包括評(píng)估維度、指標(biāo)、數(shù)據(jù)、規(guī)則等;而后以疾病負(fù)擔(dān)較重的肺癌用藥為例,驗(yàn)證rHTA方法學(xué)的科學(xué)性和實(shí)操性,以便其更廣闊的應(yīng)用。
1 相關(guān)概念的介紹
1.1 HTA
HTA是利用循證醫(yī)學(xué)、衛(wèi)生經(jīng)濟(jì)學(xué)、社會(huì)學(xué)、醫(yī)學(xué)倫理學(xué)以及其他相關(guān)學(xué)科的原理和方法,全面系統(tǒng)地評(píng)價(jià)衛(wèi)生技術(shù)的安全性、有效性、經(jīng)濟(jì)性、創(chuàng)新性和公平性等,其目的是在有限的資源配置中實(shí)現(xiàn)價(jià)值最大化[1]。衛(wèi)生技術(shù)包括藥品、診療手段和設(shè)備、公共衛(wèi)生和其他衛(wèi)生干預(yù)措施,科學(xué)地評(píng)估這些技術(shù)可為決策者提供衛(wèi)生科學(xué)的信息。HTA可以回答該技術(shù)在真實(shí)環(huán)境里安全有效性如何,是否具有經(jīng)濟(jì)性,合適的價(jià)格是多少,對(duì)醫(yī)保資金預(yù)算影響多大,其創(chuàng)新性是否可以有效提升患者可及性和便利性,是否可以改善患者依從性等一系列問(wèn)題[2]。
1.2 MCDA
MCDA作為一項(xiàng)可以幫助決策者從多個(gè)角度對(duì)衛(wèi)生技術(shù)進(jìn)行評(píng)估的工具,通過(guò)一系列方法對(duì)衛(wèi)生技術(shù)進(jìn)行價(jià)值評(píng)估,從而確定最佳選擇[3-4]。在MCDA中,決策者根據(jù)研究主題,識(shí)別影響因素,制定適宜的評(píng)審標(biāo)準(zhǔn),并對(duì)每一標(biāo)準(zhǔn)進(jìn)行價(jià)值賦權(quán),形成某主題的MCDA評(píng)價(jià)體系。然后根據(jù)評(píng)價(jià)體系對(duì)每一候選方案逐一打分,通過(guò)打分與權(quán)重計(jì)算每一候選方案的分值。MCDA評(píng)價(jià)結(jié)果使得候選方案的優(yōu)缺點(diǎn)清晰明了,方便決策者選擇[5]。自2010 年以來(lái),關(guān)于MCDA的研究文獻(xiàn)也逐漸增多,主要為MCDA應(yīng)用于臨床診斷和治療、醫(yī)保報(bào)銷(xiāo)等決策領(lǐng)域[6-7]。
1.3 rHTA
rHTA又叫快速評(píng)估或快速證據(jù)評(píng)價(jià),是根據(jù)用戶需求,針對(duì)某一具體問(wèn)題,簡(jiǎn)化系統(tǒng)評(píng)價(jià)方法,獲取當(dāng)前最佳證據(jù)并快速合成證據(jù)以滿足決策者需求的方法。rHTA方法學(xué)可以在切實(shí)可靠證據(jù)的基礎(chǔ)上加速整個(gè)評(píng)估過(guò)程,整個(gè)rHTA的評(píng)估過(guò)程大約需要12~24 周,這使得及時(shí)、科學(xué)的政策決策成為可能[8]。由于rHTA 及時(shí)性強(qiáng)且成本相對(duì)較低,越來(lái)越多的國(guó)家或地區(qū)采用了rHTA以優(yōu)化其定價(jià)和調(diào)整醫(yī)保報(bào)銷(xiāo)目錄的決策,如加拿大、泰國(guó)、愛(ài)爾蘭等[9-10]。
簡(jiǎn)言之,HTA是證據(jù)生產(chǎn)的過(guò)程,MCDA是證據(jù)應(yīng)用的過(guò)程,而rHTA是HTA的一個(gè)分支,能夠快速收集與整合證據(jù),可以更有效、及時(shí)地滿足不同利益相關(guān)方的各種需求,并廣泛應(yīng)用于社會(huì)科學(xué)研究和實(shí)踐中。rHTA無(wú)疑更具時(shí)效性,但也存在固有的局限性,如文獻(xiàn)檢索受限、關(guān)注范圍狹窄、泛化能力有限、缺乏經(jīng)濟(jì)建模和預(yù)算影響分析等。因此,在決策中使用rHTA需要作更多考量。與HTA相比,rHTA的代價(jià)是在方法學(xué)上作出的權(quán)衡。
2 抗腫瘤用藥rHTA方法學(xué)構(gòu)想
2.1 基于HTA-MCDA評(píng)估經(jīng)驗(yàn)的EVIDEM框架
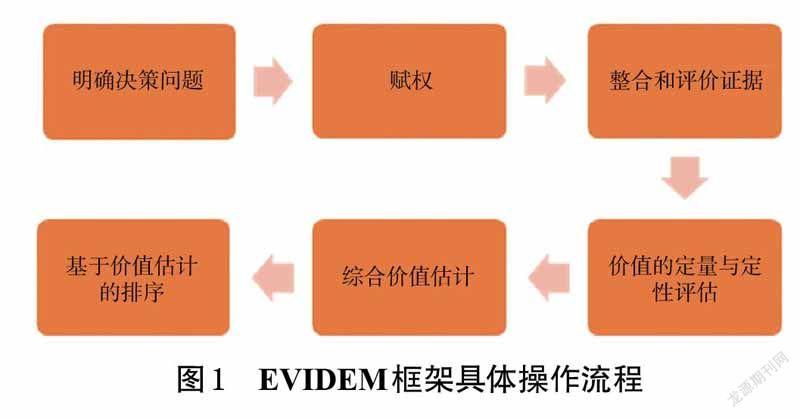
由Goetghebeur等[9]組成的EVIDEM協(xié)作組將MCDA模型與HTA結(jié)合,建立了EVIDEM框架,并用于衛(wèi)生決策過(guò)程。經(jīng)過(guò)10 多年的更新完善,目前研究者經(jīng)常采用的為2018 年發(fā)布的第10 版EVIDEM 框架[11],其準(zhǔn)則分為規(guī)范化的通用準(zhǔn)則和情景化準(zhǔn)則2 個(gè)層面。該框架通過(guò)定性定量相結(jié)合的方式對(duì)衛(wèi)生技術(shù)進(jìn)行價(jià)格評(píng)估[12]。
EVIDEM 框架的具體操作步驟包括選擇和構(gòu)建準(zhǔn)則、賦權(quán)、整合和評(píng)價(jià)證據(jù)、價(jià)值的定量與定性評(píng)估、綜合價(jià)值估計(jì)及基于價(jià)值估計(jì)的排序。選擇和構(gòu)建準(zhǔn)則是根據(jù)決策目的,調(diào)整或刪除部分維度和/或指標(biāo)確定評(píng)審體系的過(guò)程。賦權(quán)是利益相關(guān)者權(quán)衡各個(gè)維度、指標(biāo)重要性,賦予相關(guān)權(quán)重的過(guò)程——EVIDEM框架有2 種賦權(quán)方法,分別為5 分非層級(jí)結(jié)構(gòu)法和100 分層級(jí)結(jié)構(gòu)法。整合和評(píng)價(jià)證據(jù)是根據(jù)矩陣手冊(cè),對(duì)證據(jù)進(jìn)行整合、分析、評(píng)價(jià)。衛(wèi)生技術(shù)價(jià)值的定量與定性評(píng)估是根據(jù)評(píng)審體系及掌握證據(jù)進(jìn)行打分。衛(wèi)生技術(shù)的綜合價(jià)值估計(jì)是根據(jù)打分及權(quán)重測(cè)算干預(yù)措施的定量分值。基于價(jià)值估計(jì)的衛(wèi)生技術(shù)排序是根據(jù)綜合價(jià)值評(píng)估結(jié)果對(duì)所有干預(yù)方案進(jìn)行排序,供決策者選擇。EVIDEM 框架適用于疾病的診斷、治療、管理等領(lǐng)域,應(yīng)用范圍包括醫(yī)療保險(xiǎn)報(bào)銷(xiāo)、藥物遴選、政策制定、監(jiān)管決策等,可為更加系統(tǒng)、透明、科學(xué)的衛(wèi)生決策提
2.2 抗腫瘤用藥rHTA方法學(xué)構(gòu)想
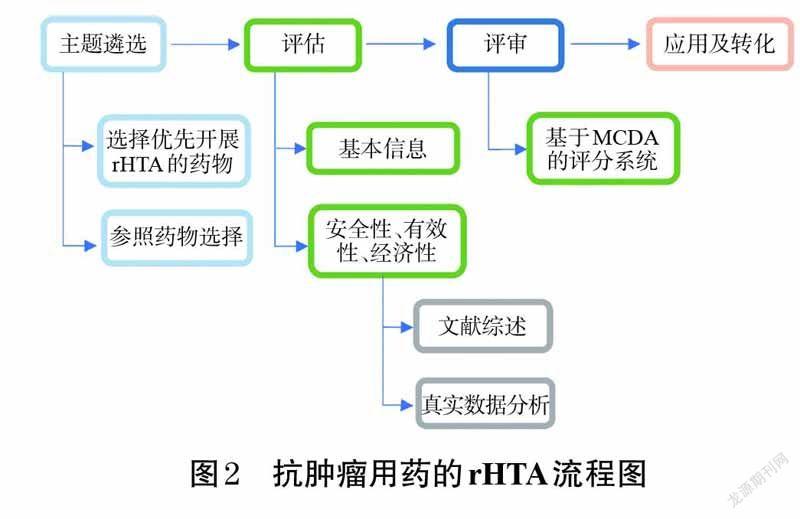
本研究基于以上HTA-MCDA評(píng)估經(jīng)驗(yàn)及相關(guān)文獻(xiàn)研究[16-17],結(jié)合當(dāng)前中國(guó)特色醫(yī)療衛(wèi)生體系,建立適合本研究需求的抗腫瘤用藥rHTA方法學(xué)操作流程。抗腫瘤用藥rHTA方法學(xué)包括4 個(gè)關(guān)鍵步驟:主題遴選、評(píng)估、評(píng)審、應(yīng)用及轉(zhuǎn)化(如圖2所示)。
2.2.1 主題遴選
(1)選擇優(yōu)先開(kāi)展rHTA的抗腫瘤用藥——選擇高優(yōu)先級(jí)藥物的過(guò)程即確定哪些藥物適合進(jìn)行rHTA的過(guò)程。用于評(píng)估的目標(biāo)藥物主要由醫(yī)療衛(wèi)生領(lǐng)域的專(zhuān)業(yè)人員和國(guó)家或地區(qū)決策者來(lái)確定,也可通過(guò)文獻(xiàn)檢索和國(guó)家HTA 機(jī)構(gòu)的橫向掃描(horizon scanning)來(lái)確定[18]。《基本醫(yī)療保險(xiǎn)藥物用藥管理暫行辦法》確定的基本醫(yī)療保險(xiǎn)用藥篩選標(biāo)準(zhǔn)旨在衡量國(guó)家醫(yī)療保險(xiǎn)基金的安全性、臨床價(jià)值、臨床可替代性、資金占用額度和可持續(xù)發(fā)展能力[5]。
(2)參照藥物選擇——參照藥物是用于治療相同病癥的替代藥物。HTA通常會(huì)對(duì)正在接受評(píng)估的擬談判藥物與其相應(yīng)參照藥物進(jìn)行比較。在選擇參照藥物時(shí),通常會(huì)優(yōu)先考慮相同適應(yīng)證的其他藥物。參照藥物遴選應(yīng)有其他證據(jù)來(lái)源作為支撐,如參考目前當(dāng)?shù)氐耐ㄓ媚J胶脱C醫(yī)學(xué)及臨床實(shí)踐指南[19]。
2.2.2 評(píng)估
評(píng)估內(nèi)容主要包括藥物基本信息、安全性、有效性、直接醫(yī)療費(fèi)用、增量成本-效果比、預(yù)算影響分析及在其他國(guó)家報(bào)銷(xiāo)情況等信息。綜合這些來(lái)自真實(shí)世界和文獻(xiàn)的證據(jù),為評(píng)審和形成建議提供了重要的參考依據(jù)。
(1)安全性——安全性信息側(cè)重收集3 級(jí)及以上的藥物不良反應(yīng)/事件和黑框警告、其他警告和退市情況。不良反應(yīng)/事件分類(lèi)主要參考常見(jiàn)不良事件評(píng)價(jià)標(biāo)準(zhǔn)(Common Terminology Criteria for Adverse Events,CTCAE)。藥物在獲批上市時(shí)會(huì)在說(shuō)明書(shū)中標(biāo)明不良反應(yīng)、禁忌證和注意事項(xiàng)等安全警告信息。美國(guó)FDA也會(huì)對(duì)該藥物的一些重要風(fēng)險(xiǎn)進(jìn)行警告,即黑框警告。對(duì)于上市后發(fā)現(xiàn)有嚴(yán)重安全問(wèn)題的藥物,如果風(fēng)險(xiǎn)大于治療效益,而風(fēng)險(xiǎn)管理措施不能有效降低風(fēng)險(xiǎn),可能會(huì)出現(xiàn)退市的情況。
(2)有效性——有效性信息側(cè)重收集主要臨床結(jié)局指標(biāo)改善情況及臨床實(shí)踐指南推薦情況。主要臨床結(jié)局指標(biāo)改善情況主要從國(guó)內(nèi)外公開(kāi)發(fā)表文章、關(guān)鍵臨床試驗(yàn)以及真實(shí)世界數(shù)據(jù)庫(kù)中提取。對(duì)該藥物國(guó)內(nèi)外臨床實(shí)踐指南進(jìn)行回顧,對(duì)方案及指南推薦情況進(jìn)行評(píng)估。
(3)經(jīng)濟(jì)性——經(jīng)濟(jì)性信息主要包括直接醫(yī)療費(fèi)用、增量成本-效果比、預(yù)算影響分析結(jié)果。根據(jù)患者基本診療信息計(jì)算患者臨床用藥方案的直接醫(yī)療費(fèi)用,包括藥物費(fèi)用、檢查檢測(cè)費(fèi)用、醫(yī)療服務(wù)費(fèi)用等;構(gòu)建增量成本-效果比指標(biāo),評(píng)估目標(biāo)臨床用藥方案的成本-效果;匯總試點(diǎn)統(tǒng)籌地區(qū)臨床用藥方案的報(bào)銷(xiāo)金額和藥物數(shù)量,衡量其對(duì)醫(yī)保基金的影響。
(4)證據(jù)質(zhì)量——證據(jù)等級(jí)可根據(jù)紐約州立大學(xué)醫(yī)學(xué)中心2001 年提出的證據(jù)金字塔[20]對(duì)入選研究進(jìn)行排序。在循證醫(yī)學(xué)的證據(jù)金字塔中系統(tǒng)評(píng)估和元分析(即Meta分析)等級(jí)最高,隨后是隨機(jī)對(duì)照雙盲研究,見(jiàn)圖3。
2.2.3 評(píng)審
評(píng)審是多個(gè)學(xué)科、多個(gè)利益相關(guān)方的融合,進(jìn)行評(píng)審時(shí)可先確定統(tǒng)一的評(píng)審維度及指標(biāo)。然后專(zhuān)家根據(jù)自己的專(zhuān)業(yè)判斷和來(lái)自審查報(bào)告的證據(jù),對(duì)評(píng)審維度和指標(biāo)進(jìn)行賦權(quán)賦分。通過(guò)對(duì)指標(biāo)評(píng)審結(jié)果的均值和異常值進(jìn)行判定,運(yùn)用統(tǒng)計(jì)分析方法匯總整理專(zhuān)家意見(jiàn)。
根據(jù)每一指標(biāo)的權(quán)重及指標(biāo)得分匯總計(jì)算該藥物的加權(quán)分值。最終,每個(gè)藥物得到唯一對(duì)應(yīng)的分值。
2.2.4 應(yīng)用及轉(zhuǎn)化
評(píng)審結(jié)束后,形成評(píng)審報(bào)告,遞交至評(píng)審委員會(huì),由評(píng)審委員會(huì)對(duì)評(píng)審結(jié)果進(jìn)行審查,形成最終評(píng)審意見(jiàn)。未來(lái)借助相關(guān)決策部門(mén)力量,促進(jìn)結(jié)果的轉(zhuǎn)化應(yīng)用。
3 抗腫瘤用藥rHTA方法學(xué)的實(shí)踐與探索
3.1 主題遴選
考慮到不同癌種的流行病學(xué)和經(jīng)濟(jì)負(fù)擔(dān)有所區(qū)別,本研究選擇肺癌進(jìn)行實(shí)踐研究。肺癌化療藥物目前在臨床的使用較為成熟、規(guī)范,因此擬評(píng)估藥物種類(lèi)聚焦在肺癌靶向藥物。本研究對(duì)2 個(gè)試點(diǎn)機(jī)構(gòu)——A醫(yī)院和B中心肺癌晚期患者使用的靶向藥進(jìn)行分析,結(jié)果發(fā)現(xiàn)C藥品的使用量排第1 位,而單價(jià)和費(fèi)用則低于D藥品、居于第2 位。基于以上維度考量并結(jié)合臨床專(zhuān)家咨詢意見(jiàn),遴選出在真實(shí)世界中實(shí)際用量大、總費(fèi)用金額高的C藥品作為本次rHTA的目標(biāo)藥物,D藥品為對(duì)照藥物。
3.2 評(píng)估
3.2.1 安全性
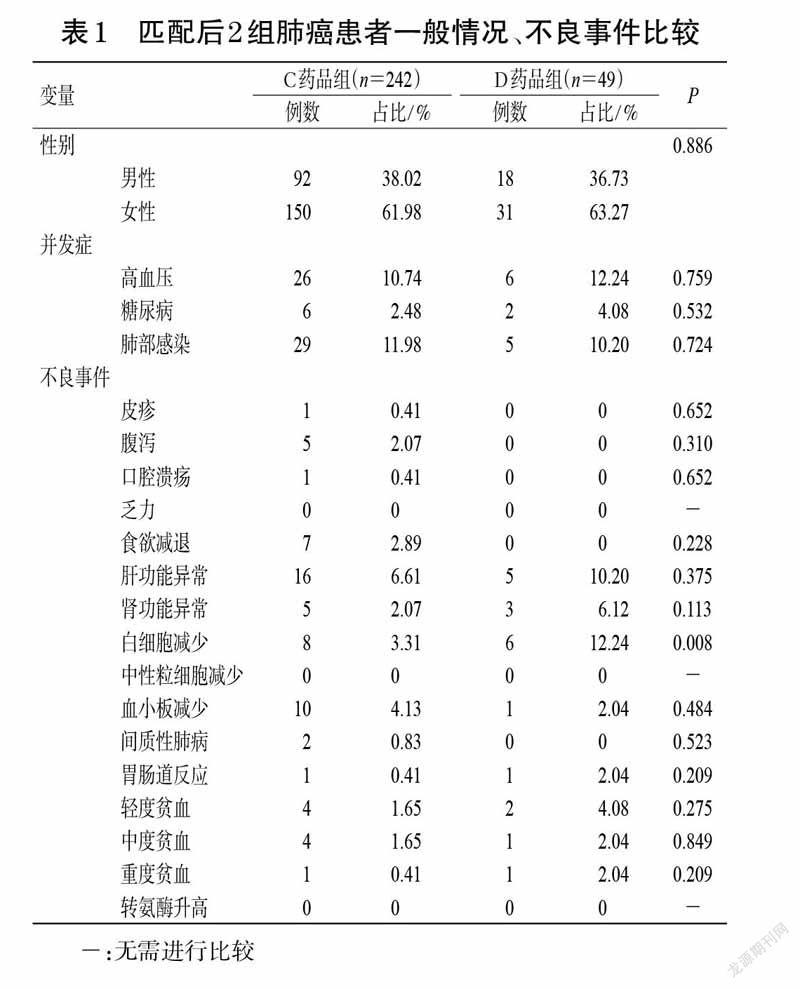
C藥品臨床試驗(yàn)中觀測(cè)到的3 級(jí)及以上的不良事件主要為腹瀉與間質(zhì)性肺病。僅有少量的患者會(huì)出現(xiàn)CTCAE中的3 級(jí)及以上不良事件。在A醫(yī)院和B中心的真實(shí)世界數(shù)據(jù)中,通過(guò)對(duì)患者診療記錄進(jìn)行清洗,使用Stata 15.0 軟件進(jìn)行統(tǒng)計(jì)分析,采用傾向性評(píng)分匹配(propensity score matching,PSM)控制C 藥品組患者和D藥品組患者組間數(shù)據(jù)偏差和混雜變量。以50 例使用D藥品的肺癌患者為基準(zhǔn)組,選擇年齡、性別、高血壓、糖尿病和肺部感染共5 個(gè)因素作為匹配的協(xié)變量,卡鉗值設(shè)置為0.05,采用1 ∶10 臨近匹配法成功篩選出242 例使用C藥品的肺癌患者作為試驗(yàn)組。匹配后共納入291例肺癌患者資料。顯著性差異分析顯示,經(jīng)匹配后2 組患者的年齡、性別、高血壓、糖尿病和肺部感染差異均無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。匹配后,D藥品組患者發(fā)生白細(xì)胞減少的概率仍然高于C 藥品組(12.24% vs. 3.31%),差異具有統(tǒng)計(jì)學(xué)意義(P=0.008);其他不良事件的發(fā)生率在2 組之間沒(méi)有統(tǒng)計(jì)學(xué)差異。匹配后患者一般情況、不良事件發(fā)生情況詳見(jiàn)表1[匹配后C、D藥品組患者年齡分別為(59±14)、(56±13)歲,P=0.091]。查詢各國(guó)說(shuō)明書(shū)及相關(guān)網(wǎng)站,結(jié)果并未在該藥的說(shuō)明書(shū)上發(fā)現(xiàn)相關(guān)的黑框警告及退市信息。
3.2.2 有效性
與C 藥品主要臨床結(jié)局指標(biāo)相關(guān)的文獻(xiàn)共有5篇[21-25],其中3 篇為關(guān)鍵臨床試驗(yàn),2 篇為近5 年內(nèi)的系統(tǒng)評(píng)價(jià)。2 篇系統(tǒng)評(píng)價(jià)具有較高的證據(jù)質(zhì)量等級(jí),3 篇臨床試驗(yàn)均為多中心臨床隨機(jī)對(duì)照試驗(yàn),證據(jù)等級(jí)為中等。結(jié)果表明,無(wú)論是一線還是二線使用C藥品,對(duì)特定群體的無(wú)進(jìn)展生存期和生活質(zhì)量均有積極的影響,特別是針對(duì)帶有EGFR基因突變的腫瘤患者。檢索國(guó)內(nèi)外腫瘤學(xué)會(huì)發(fā)布的最新版本指南,閱讀指南后對(duì)國(guó)內(nèi)外權(quán)威指南中關(guān)于C藥品治療非小細(xì)胞肺癌(non-small-celllung cancer,NSCLC)的情況進(jìn)行梳理。綜合評(píng)估美國(guó)國(guó)立綜合癌癥網(wǎng)絡(luò)(National Comprehensive CancerNetwork,NCCN)、歐洲臨床腫瘤學(xué)學(xué)會(huì)(EuropeanSociety for Medical Oncology,ESMO)、中國(guó)臨床腫瘤學(xué)會(huì)(Chinese Society of Clinical Oncology,CSCO)指南中對(duì)EGFR基因突變的NSCLC一線治療用藥推薦情況。
在A醫(yī)院和B中心真實(shí)世界數(shù)據(jù)中,D藥品組患者生存率高于C 藥品組。C 藥品組患者的1 年生存率為61.29% [95% 置信區(qū)間(confidence interval,CI):53.2%~68.41%],D藥品組患者的1 年生存率為75.77%(95%CI:59.36%~86.28%);C 藥品組患者的2 年生存率為33.42%(95%CI:22.3%~44.91%),D藥品組患者的2 年生存率為54.12%(95%CI:24.99%~76.20%)。但是2 組的生存曲線出現(xiàn)交叉,表明2 組生存時(shí)間的影響因素不全是用藥方案的不同所致,存在混雜因素。C藥品組患者中位生存時(shí)間為16.14 個(gè)月(95%CI:13.15~20.05 個(gè)月),D藥品組患者由于隨訪時(shí)間過(guò)短,尚未觀測(cè)到中位生存時(shí)間,其第四分位數(shù)間距的生存時(shí)間為17.39 個(gè)月。Log-rank 檢驗(yàn)結(jié)果顯示,2 組患者的生存時(shí)間差異無(wú)統(tǒng)計(jì)學(xué)意義(χ2=2.99,P=0.084)。
3.2.3 經(jīng)濟(jì)性
在A醫(yī)院和B中心真實(shí)世界數(shù)據(jù)中,D藥品組的人均總費(fèi)用高于C 藥品組(58 957.21 元vs. 22 726.93 元,P<0.001);D 藥品組的人均藥品費(fèi)(25 448.19 元vs.13 646.19 元,P<0.001)、人均檢查檢驗(yàn)費(fèi)(7 292.00 元vs. 3 748.09 元,P=0.025 )、人均診療耗材費(fèi)(4 451.32元vs. 2 003.19 元,P=0.005 )、人均其他費(fèi)用(3 230.28元vs. 1 135.50 元,P=0.011 )也高于C 藥品組,差異具有統(tǒng)計(jì)學(xué)意義。
在文獻(xiàn)研究中,檢索到此次評(píng)審藥物C藥品與參照藥品D藥品的經(jīng)濟(jì)學(xué)評(píng)價(jià)文獻(xiàn)共2 篇[26-27],研究結(jié)果表明C藥品是具有成本-效果優(yōu)勢(shì)的方案。暫未檢索到預(yù)算影響分析方面研究。
3.3 評(píng)審專(zhuān)家根據(jù)此次評(píng)審藥品C藥品及其適應(yīng)證NSCLC現(xiàn)階段診療情況,進(jìn)行了維度的賦權(quán)。對(duì)5 位專(zhuān)家賦權(quán)的結(jié)果進(jìn)行加權(quán)平均,得到C藥品各個(gè)價(jià)值維度及指標(biāo)下的唯一權(quán)重值,最終計(jì)算得到C藥品各維度下的平均權(quán)重。通過(guò)對(duì)指標(biāo)評(píng)分結(jié)果均值及異常值的分析處理,以各指標(biāo)評(píng)分的算術(shù)平均數(shù)乘以相應(yīng)的指標(biāo)權(quán)重和維度權(quán)重,得出指標(biāo)加權(quán)分值(具體結(jié)果略)。
3.4 應(yīng)用及轉(zhuǎn)化
最后,將上述rHTA結(jié)果以及價(jià)值量化的結(jié)果撰寫(xiě)成一份報(bào)告,提交給評(píng)審委員會(huì)。由該委員會(huì)專(zhuān)家對(duì)結(jié)果進(jìn)行審查,并結(jié)合其他證據(jù)和其他相關(guān)利益方的權(quán)益進(jìn)行最終價(jià)值判斷(具體結(jié)果略),供決策者參考。
4 討論
基于HTA與MCDA結(jié)合為出發(fā)點(diǎn)的rHTA,需要以問(wèn)題為導(dǎo)向,服務(wù)循證決策,原則是本土化、可操作、易實(shí)施。結(jié)合本次抗腫瘤用藥rHTA 實(shí)踐,為促進(jìn)未來(lái)rHTA方法學(xué)優(yōu)化與實(shí)施,筆者總結(jié)了4 點(diǎn)經(jīng)驗(yàn)與建議。
4.1 評(píng)審維度的確定需與HTA內(nèi)容相結(jié)合
HTA是一個(gè)證據(jù)生產(chǎn)的過(guò)程,綜合考量了評(píng)估對(duì)象的安全性、有效性、經(jīng)濟(jì)性等,從多視角實(shí)現(xiàn)了對(duì)相關(guān)證據(jù)的全面收集和分析。因此以HTA結(jié)果為基礎(chǔ)的維度確定,既可以發(fā)揮現(xiàn)有證據(jù)對(duì)決策的直接支撐,又保持了評(píng)估和評(píng)審環(huán)節(jié)的一致性,同時(shí)通過(guò)評(píng)審可以對(duì)評(píng)估內(nèi)容進(jìn)行反向驗(yàn)證。這樣一致性的保持,既得到了文獻(xiàn)驗(yàn)證,例如文獻(xiàn)綜述和專(zhuān)家咨詢結(jié)果顯示安全性、有效性和經(jīng)濟(jì)性是價(jià)值判斷的通用維度,又凸顯了評(píng)審工作的科學(xué)性、嚴(yán)謹(jǐn)性、緊密型和可操作性。
4.2 多方參與以確保決策公開(kāi)、公正、公平
決策是一個(gè)復(fù)雜的過(guò)程,不同利益相關(guān)者出于不同的利益考量,會(huì)對(duì)同類(lèi)型的研究證據(jù)進(jìn)行不同的權(quán)衡和取舍。而本模擬所借鑒的MCDA,目的就是在具有相互沖突、不可共度的利益相關(guān)者之間進(jìn)行選擇,目的是做出利益共融且具有“帕累托(Pareto)最優(yōu)”特點(diǎn)的決策。評(píng)審全流程要做到公開(kāi)、公正、公平,且多方參與。利益相關(guān)者尤其不能忽略非傳統(tǒng)意義評(píng)審代表——患者代表及企業(yè)代表的利益。
4.3 強(qiáng)調(diào)評(píng)審流程的可操作性
MCDA既是方法學(xué)的探索,同時(shí)更需要通過(guò)應(yīng)用實(shí)踐保持對(duì)價(jià)值維度和指標(biāo)結(jié)構(gòu)的持續(xù)優(yōu)化,這就需要在維度全面性和實(shí)操性之間進(jìn)行平衡。在應(yīng)用之初,可以按照由易到難的原則,二級(jí)指標(biāo)的設(shè)定不宜過(guò)多過(guò)細(xì),指標(biāo)過(guò)多會(huì)稀釋主要指標(biāo)的作用,而且會(huì)降低評(píng)審專(zhuān)家對(duì)評(píng)審參與的依從性和投入熱情。維度結(jié)構(gòu)和內(nèi)容的設(shè)定秉承簡(jiǎn)化、直接、準(zhǔn)確的原則,但是在評(píng)分計(jì)算方面應(yīng)更著重于體現(xiàn)科學(xué)性和嚴(yán)謹(jǐn)性。
4.4 信息化對(duì)評(píng)審流程的支撐
評(píng)審流程的信息化操作可以大大提高評(píng)審效率。在模擬實(shí)踐中,借助相關(guān)電子設(shè)備終端(例如手機(jī))和統(tǒng)計(jì)軟件的應(yīng)用(例如問(wèn)卷星),可以實(shí)現(xiàn)評(píng)審信息的快速收集、統(tǒng)計(jì)和調(diào)整。從當(dāng)前國(guó)際評(píng)審流程發(fā)展趨勢(shì)來(lái)看,隨著電子設(shè)備的普遍應(yīng)用,評(píng)審流程將借助信息化優(yōu)勢(shì)實(shí)現(xiàn)便捷化、可溯化和安全化。
5 結(jié)語(yǔ)
隨著循證醫(yī)學(xué)方法的發(fā)展,rHTA作為一種證據(jù)合成的新興方法,能夠在短時(shí)間內(nèi)整合現(xiàn)有的真實(shí)世界數(shù)據(jù)與相關(guān)文獻(xiàn)資料,快速評(píng)估藥物的安全性、有效性、經(jīng)濟(jì)性和其他關(guān)鍵信息,為決策者提供證據(jù)支持。目前主要應(yīng)用于指導(dǎo)新藥研發(fā)、藥品審評(píng)審批、藥品參考定價(jià)、醫(yī)保目錄調(diào)整、基本藥物遴選、臨床合理用藥等領(lǐng)域。但是目前國(guó)際上尚無(wú)公認(rèn)的rHTA方法和流程,多數(shù)國(guó)家和地區(qū)多基于自身決策需求因地制宜開(kāi)發(fā)相應(yīng)的快速評(píng)估指南。因此本研究基于我國(guó)醫(yī)療衛(wèi)生服務(wù)體系獨(dú)有特點(diǎn),開(kāi)發(fā)了rHTA方法學(xué)和操作流程,并通過(guò)2 個(gè)試點(diǎn)機(jī)構(gòu)的數(shù)據(jù),以C藥品為例對(duì)rHTA方法學(xué)的科學(xué)性、可行性進(jìn)行了全流程驗(yàn)證。但由于rHTA強(qiáng)調(diào)時(shí)效性,證據(jù)收集和評(píng)審方面可能存在偏倚,因此在結(jié)論推廣的同時(shí),應(yīng)積極進(jìn)行后效評(píng)價(jià),保持對(duì)評(píng)估結(jié)果的持續(xù)優(yōu)化或者必要時(shí)開(kāi)展完整的評(píng)估,用更多且全面的證據(jù)來(lái)驗(yàn)證和完善rHTA的方法和應(yīng)用。
- 中國(guó)藥房的其它文章
- 長(zhǎng)春瑞濱藥動(dòng)學(xué)及毒副作用研究進(jìn)展
- 嬰兒肝移植術(shù)后產(chǎn)金屬β-內(nèi)酰胺酶肺炎克雷伯菌腹腔感染治療1例及文獻(xiàn)復(fù)習(xí)
- 歷年《新型抗腫瘤藥物臨床應(yīng)用指導(dǎo)原則》概況與變遷
- 基于數(shù)據(jù)挖掘法對(duì)β受體阻滯劑藥物相關(guān)急性腎衰竭信號(hào)的分析
- 加用達(dá)雷妥尤單抗治療不適合干細(xì)胞移植的新診斷多發(fā)性骨髓瘤的藥物經(jīng)濟(jì)學(xué)評(píng)價(jià)
- 間變性淋巴瘤激酶陽(yáng)性非小細(xì)胞肺癌治療藥物經(jīng)濟(jì)性的系統(tǒng)評(píng)價(jià)

