一種混酸槽液的分析方法研究
呂淑芳,鄭付華
(成都航利實業有限公司,四川 成都 611930)
目前,隨著新裝備修理能力的不斷發展,為適應新裝備維修保障的需要,開發了大量表面處理新工藝,硝酸、氫氟酸的混酸溶液作為新開發的腐蝕檢查溶液,其分析方法無參考依據。而本文提出的分析方法,不僅能夠填補此溶液無分析方法的空白,解決此溶液只能通過換新來滿足工藝要求的弊端,而且能夠對表面處理現場使用的硝酸、氫氟酸的溶液提供技術支撐,增強整個表面處理的槽液使用控制能力。
本文重點分析了混酸溶液中氫氟酸的分析原理及方法,且測試結果準確可靠。
1 原 理
在鹵素元素中,最不易測定的就是元素氟。但是氟離子F-和氯離子Cl-能與Pb2+生成在水溶液中性條件下生成白色沉淀PbClF[1]。通過測定Cl-來間接測定F-。由于PbClF形成分子式的比值為Pb2+:Cl-:F-=1:1:1,溶解后Cl-是一種可測定的物質,加入硝酸銀標準溶液生成氯化銀沉淀,過量的硝酸銀選擇鐵銨釩做指示劑,利用KCNS返滴定[2]。
1.1 PbClF的定性檢測
(1)加水100 mL至300 mL燒杯中。
(2)加入氯化鈉2 g,加入氟化納2 g,攪拌至完全溶解。
(3)加入硝酸鉛20 g,攪拌使之完全反應,水浴加熱,溫度80~90 ℃,20 min,冷卻,靜置1 h。
(4)靜置后過濾,用去離子水清洗7~8次,將沉淀物移入500 mL燒杯中,加入100 mL去離子水,用玻璃棒充分攪拌,讓 PbClF充分溶解。過濾后(不沖洗)棄去沉淀,濾液保留,往濾液中加入1滴0.1 mol/L硝酸銀溶液,觀察是否有白色沉淀產生,如果沒有,過量加入1 mL的0.1 mol/L硝酸銀溶液,如果此次仍舊沒有白色沉淀產生,則證明PbClF的溶解度小于0.2 mg/L,滿足重量分析的要求。
(5)計算
PbClF溶解度<硝酸銀定性含量<2×10-4mg。
(6)數據計算

PbClF溶解度<1.25×10-5g/L<2×10-4g/L
式中:MPbClF=251.7
10-3×0.1×0.05——硝酸銀物質的量
0.01——溶液體積
0.2 mg——重量分析的沉淀溶解的上限值
試驗證明: PbClF的溶解度小于0.2 mg/L,滿足重量分析的要求。
1.2 試驗方法的可靠性分析
1.2.1 氟化鈉作為氫氟酸的標液
由于硝酸溶液和氫氟酸溶液的百分含量是一個較大的范圍值,因此不能配制和槽液一樣的標準液,因此選擇氟化鈉作為氫氟酸的標液,來驗證方法的可靠性。
經查[3],氟化納的溶解度為20 ℃/4.06 g,30 ℃/422 g,其分子量為49.99。
試驗方法如下:
(1)稱取0.4199 g氟化納溶解于100 mL容量瓶中,其濃度為0.1038 mol/L。
(2)依次稱取10 mL氟化納標準溶液于1#、2#、3#、4#、5#、6#燒杯中,分別加水80 mL。
(3)加入氯化鈉1.5 g攪拌溶解完全,在攪拌的情況下加入2.5 g Pb(NO3)2,使之完全溶解并與F-和Cl-生成沉淀,水浴加熱,溫度80~90 ℃,20 min,冷卻,靜置1 h。1 h后過濾,用熱水洗滌3~4遍,濾液棄之。
(4)將濾紙和沉淀一起轉移到300 mL(1#、2#、3#、4#、5#、6#)燒杯中,加水10 mL,加濃硝酸20 mL,攪拌使沉淀完全溶解,分別準確加入25 mL硝酸銀標準溶液,攪拌均勻。
(5)待反應完全后過濾,用少量去離子水洗滌3~4遍,收集濾液(這時濾液中只含有硝酸和硝酸銀),在濾液中加入鐵銨釩指示劑1 mL,用0.1 mol/L KCNS返滴定其中的硝酸銀至溶液出現穩定的微紅色為終點。
(6)空白實驗:使用的去離子水中的氯離子≤0.05 mg/L,因此可以將空白值設為0。
試驗數據如表1所示。
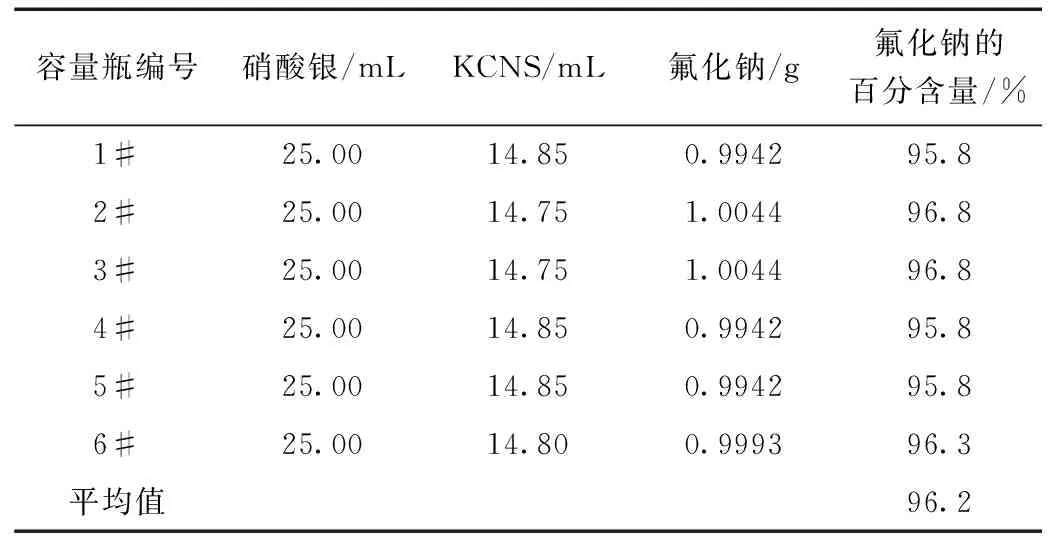
表1 試驗數據(氟化鈉)
由表1可知,氟化納(分析純)的百分含量大于98%,實驗結果為96.2%,因此實驗結果略小于理論數值,其主要原因在于氟化納沒有基準物質因此需選用一種基準物質代替氟化納。
1.2.2 氯化鈉作為氫氟酸的標液
選擇以氯化鈉工作基準物質試劑替代氟化納。同理,Pb2+:Cl-:F-=1:1:1。利用測定氟氯化鉛中氯離子的含量來測定氟離子[4]。試驗步驟如下:
(1)稱取0.5932 g已烘干的工作基準試劑氯化鈉,溶解于100 mL容量瓶中,搖勻,其濃度為0.1015 mol/L。
(2)取氯化鈉標準溶液10 mL于300 mL燒杯中,加水50 mL加入2 g氟化納,攪拌均勻,在攪拌的過程下加入Pb(NO)23 g使之完全溶解并與F-和Cl-生成沉淀,水浴加熱,溫度80~90 ℃,20 min,冷卻靜置1 h。1 h后過濾,用熱水洗滌3~4遍,濾液棄之。將濾紙和沉淀一起轉移到300 mL燒杯中,加水10 mL,加入濃硝酸20 mL,充分攪拌,使PbClF溶解,靜置5 min后再充分攪拌,確保 PbCIF全溶解。
(3)在上述燒杯中準確加入硝酸銀標準溶液25 mL,攪拌均勻,待反應完全后過濾,用少量去離子水洗滌3~4遍,收集濾液,在濾液中加入鐵銨釩指示劑1 mL,用0.1 mol/L KCNS返滴定其中的硝酸銀至溶液出現穩定的微紅色為終點。
(4)空白實驗:使用的去離子水中的氯離子≤0.05 mg/L,因此可以將空白值設為0。
試驗數據如表2所示。
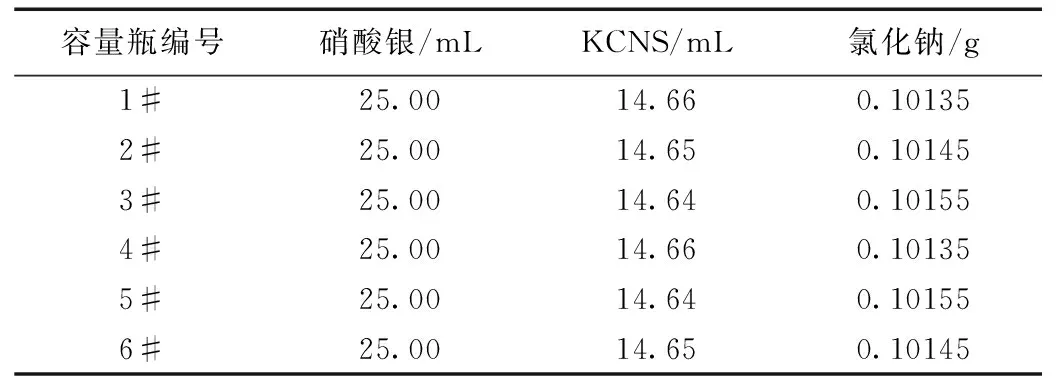
表2 試驗數據(氯化鈉)
由表2可知,氯化鈉工作基準試劑中氯化鈉的百分含量為99.95%~100.05%,雖然我們有兩個測定值不在范圍內,但誤差仍然遠遠小于1‰。試驗結果合格,證明了方法的可靠性。
2 氫氟酸的測定
2.1 樣品,試劑與設備
硝酸:127~169 mL/L、氫氟酸:120~130 mL/L。
硝酸銀標準溶液、氯化鈉標準溶液、氯化鈉工作基準試劑、鐵銨礬指示劑、硫氰化鉀。
電子秤、燒杯、漏斗、水浴鍋、電位滴定儀。
2.2 測定方法
(1) 取1 mL混酸溶液,加水50 mL,使用電位滴定儀,選擇pH擋用0.1 mol/L的氫氧化鈉中和至pH為7.0~7.4之間為終點。
(2) 加入氯化鈉1.5 g,攪拌至完全溶解,加入硝酸鉛3 g,攪拌使反應完全后在,水浴加熱,溫度80~90 ℃,20 min,冷卻靜置1 h后過濾,用熱水洗滌3~4遍,濾液棄之。將濾紙和沉淀一起轉移到300 mL燒杯中,加水10 mL,加入濃硝酸20 mL,充分攪拌,使PbClF溶解,靜置5 min后再充分攪拌,確保PbClF完全溶解。
(3) 在上述燒杯中準確加入硝酸銀標準溶液45 mL,攪拌均勻,待反應完全后過濾,用少量去離子水洗滌3~4遍,收集濾液。在濾液中加入鐵銨釩指示劑1 mL,用0.1 mo/L KCNS返滴定其中的硝酸銀至溶液出現穩定的微紅色為終點。其主要反應如下[5]:
HF+NaOH=NaF+H2O
Pb(NO3)2+NaF+NaCl=PbFClF↓+2NaNO3
PbClF+2HNO3=Pb(NO3)2+HF+HCl
Cl-+Ag+=AgCl↓
Ag++CNS-=AgCNS↓
Fe3++6KCNS=K3Fe(CNS)6(紅色)+3K+
(4) 計算公式
其中:C1——硝酸銀溶液的濃度,mol/L
V1——硝酸銀溶液的體積,mL
C2——KCNS溶液的濃度,mol/L
V2——KCNS溶液的體積,mL
20——HF的分子量
其中:1.14——HF的比重
40%——HF的百分含量
3 結 論
本文建立了混酸中氫氟酸的測定方法,通過向溶液中加入氯化鈉,測定溶液中的氯離子的含量間接測定氟離子的含量,從而得出混酸溶液中氫氟酸的含量。其方法操作簡單,數據可靠,填補此溶液無分析方法的空白,解決此溶液只能通過換新來滿足工藝要求的弊端,大大提高了此類溶液的管控能力。

