不同廠家奧美拉唑腸溶膠囊質量分析
劉 斌,魏 丹,符秀娟
(1 海南省食品藥品檢驗所海口分所,海南 海口 570311;2 海南職業技術學院,海南 海口 570216)
奧美拉唑是前瑞典Astra公司研發的第一個質子泵抑制劑,相對于傳統抗酸藥,質子泵抑制劑在分子生物學機制層面靶向抑制人體胃酸異常分泌,促進潰瘍愈合,廣泛應用于國內外臨床[1-2]。奧美拉唑在酸性溶液中不穩定,為增加藥物的穩定性,常將其制成腸溶制劑[3-4]。AstraZeneca公司未在我國上市原研奧美拉唑腸溶膠囊劑型,市面上流通的主要是其仿制劑型[5]。
為比較我國市面上已通過與未通過仿制藥一致性評價奧美拉唑腸溶膠囊的質量情況,本次隨機抽檢十個廠家的產品,其中兩個廠家已通過仿制藥一致性評價(廠家1和廠家2),其余八家均未通過,抽檢的規格均為市場占有率較大的20 mg。本實驗重點考察奧美拉唑腸溶膠囊的溶出度試驗和含量測定試驗。溶出度試驗是評價藥物制劑整體質量的重要手段[6-7],單點溶出度測定無法得知固體制劑的具體釋放過程,也難以區分出不同廠家藥品之間的內在質量,故本文采用多點取樣測定,繪制溶出曲線的方法,能有效評價不同廠家藥品內在質量。
1 儀器、試藥與試劑
RC806D溶出試驗儀,天大天發科技有限公司;Agilent 1260 Infinity高效液相色譜儀,安捷倫科技有限公司;XS205電子天平,梅特勒-托利多(上海)有限公司。
奧美拉唑對照品(批號:100367-201706),中國食品藥品檢定研究院;奧美拉唑腸溶膠囊(來自10個不同的廠家,批號見表2);甲醇、乙腈、乙醇均為德國默克公司色譜純級試劑;其他試劑均為國藥集團化學試劑有限公司分析純級;純水為Milli-Q Academic A10超純水系統制取。
2 方法與結果
查閱藥品說明書,10個廠家均執行《中國藥典》 2015 年版二部標準[8]。
2.1 溶出度與耐酸力測定
溶出度試驗方法:照溶出度與釋放度測定法(中國藥典通則0931第二法方法1) 操作,取膠囊6粒,以氯化鈉的鹽酸溶液(取氯化鈉l g,加鹽酸3.5 mL,加水至500 mL) 500 mL為溶出介質,轉速為100 r/min,經攪拌2 h,補加預熱至37 ℃的0.235 mol/L磷酸氫二鈉溶液400 mL(混合后溶出介質的pH值約為6.8),在繼續攪拌的第5、10、15、30和45 min時分別取樣濾過。
供試品溶液配制:精密量取溶出續濾液5 mL,精密加0.25 mol/L氫氧化鈉溶液1 mL,搖勻。
對照品溶液配制:精密稱取奧美拉唑對照品約20 mg,置100 mL容量瓶中,加10 mL乙醇溶解后,用混合溶出介質[氯化鈉鹽酸溶液-0.235 mol/L磷酸二氫鈉溶液(5:4)]稀釋至刻度,搖勻,精密量取1 mL,置10 mL量瓶,用混合溶出介質稀釋至刻度,搖勻,自“精密量取續濾液5 mL”后同供試品溶液配制。
照含量測定項下的方法測定,并計算出每粒膠囊的溶出量,限度應為標示量的80%。
若平均溶出度結果小于90%,需進行耐酸力檢測。檢測方法參照溶出度測定法的酸溶液中攪拌2 h后,取下轉籃,用水沖洗籃內顆粒至中性,用少量磷酸鹽緩沖液轉移至100 mL棕色量瓶,照含量測定項下方法,自“加約20 mL乙醇”起依法測定,檢測結果見圖1和表1。
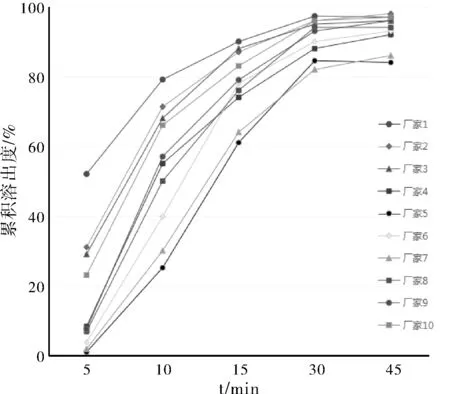
圖1 不同廠家奧美拉唑腸溶膠囊的溶出曲線測定結果
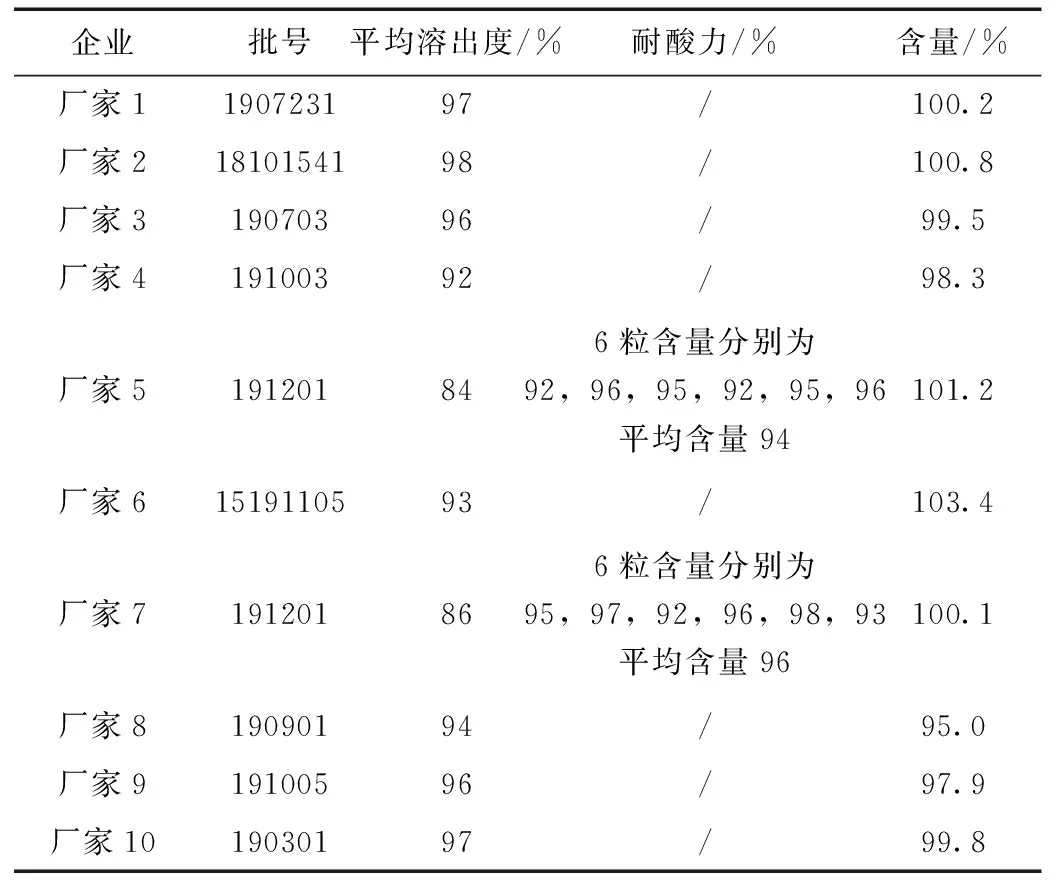
表1 奧美拉唑腸溶膠囊溶出度、耐酸力和含量測定結果
2.2 含量測定
色譜條件 采用ACE Excel 5 C8柱為色譜柱;以0.01 mol/L磷酸氫二鈉溶液(用磷酸調節pH 值至7. 6)-乙腈(75:25)為流動相;檢測波長302 nm,流速1.0 mL/min,進樣體積20 μL,主峰理論塔板數應不低于2000。
供試品溶液的配制:稱取20粒膠囊內容物,混勻研細,精密稱取細粉適量(約相當于奧美拉唑20 mg)置100 mL量瓶中,加約20 mL乙醇與60 mL磷酸鹽緩沖液(pH 11.0),超聲使奧美拉唑溶解,用磷酸鹽緩沖液(pH 11.0)稀釋至刻度,搖勻,濾過,精密量取續濾液 1 mL,置10 mL量瓶中,用水稀釋至刻度,搖勻。
對照品溶液的配制:另取奧美拉唑對照品約20 mg,同供試品溶液配制方法。測定結果見表1。
3 結果與討論
為進一步了解奧美拉唑的內在溶出行為,本次溶出度測定采用溶出曲線測定法,模擬人體胃腸道環境,即在酸性溶出介質(pH值約為1,相當于人胃內的pH環境)500 mL中攪拌2 h后,補加預熱至37 ℃的堿性溶出介質400 mL(混合后溶出介質pH值約為6.8,相當于人腸道pH環境),在繼續攪拌的5、10、15、30和45 min時分別取樣測定,繪制溶出曲線,以考察不同時間點的溶出情況。
溶出曲線(圖1)可看出,不同廠家制劑在各點的釋放度差別較大,廠家1、2、3和10的產品起步釋放速度明顯快于其他廠家制劑,可在人體迅速發揮療效;廠家4、5、6、7、8和9的產品前5 min的溶出度均在10%以下,其中廠家5和廠家7前5 min幾乎沒溶出;30 min時,大部分廠家的制劑已經基本達溶出極限,延長時間也不增加溶出度。
耐酸力檢查是腸溶制劑在溶出度檢查的平均溶出量小于90% 時,檢驗藥物是否在酸中降解還是堿中不溶出所致。本次抽檢的廠家5和廠家7生產的奧美拉唑腸溶膠囊因平均溶出量小于90%,進行耐酸力檢查,結果符合規定,表明溶出度不到90%主要是因為在堿溶液中溶出不完全,而非酸中降解,溶出不完全是影響藥物療效好壞的關鍵因素之一。
對比發現,10個廠家樣品含量測定結果差別不大,檢驗結果差異主要體現在生產工藝環節導致的溶出行為的差異,廠家1和2生產的奧美拉唑腸溶膠囊為通過仿制藥一致性評價品種,質量穩定,且療效已被證明同原研藥一致。未通過一致性評價的品種則質量差異較大,如含量偏低或偏高,以及溶出緩慢或不完全等,患者在隨機選擇這些藥品時,無法保證每次用藥療效均一。
4 結 論
按現行標準檢驗,十個廠家藥品均合格,難以區分不同產品間的內在質量,本文改變單點溶出度測定法,采用溶出曲線測定法明顯區分出不同廠家產品的溶出行為。從本次抽檢的十個廠家產品分析結果可知,通過仿制藥一致性評價的品種的質量和療效明顯優于普通廠家生產的產品。仿制藥一致性評價工作旨在提升我國仿制藥的品質,實現制藥業由低水平的制藥大國向高質量的制藥強國轉型,安全有效的仿制藥也將取代原研藥而減輕患者的用藥負擔[9-10];應加大政策鼓勵和市場引導以激發更多企業加入一致性評價的中來,讓醫藥改革惠及更多患者。

