黃瓜未授粉子房離體培養條件的優化及植株再生
曹冰東,付文苑,唐 兵,陶 蓮,王青青,歸俊娥,滕九翠,3,李魁印,鄧 英,孟平紅
(1.貴州大學農學院 貴陽 550025; 2.貴州省農業科學院園藝研究所 貴陽 550006;3.貴州大學生命科學學院 貴陽 550025; 4.貴州省安順學院 貴州安順 561000)
黃瓜(L.)是葫蘆科作物中具有重要經濟價值的蔬菜作物之一,在世界各地普遍種植。黃瓜為異花授粉作物,遺傳基礎狹窄,種質資源匱乏,雜種優勢明顯,在生產上幾乎全部采用雜交一代品種,但純化親本至少需要5 代的連續自交和定向選擇。利用單倍體育種可在1~2 年獲得純合的二倍體(Double Haploid,DH)株系,極大程度縮短了育種年限,提高了育種效率。同時,DH 系創制的群體材料能應用于抗病、抗蟲、抗旱等性狀的遺傳圖譜構建、分子標記篩選及基因定位等研究。
1976 年San首次通過未授粉子房培養獲得大麥單倍體植株。隨后,Metwally 等報道在10 個科植物中誘導出單倍體植株。目前,未授粉子房培養是黃瓜獲得雙單倍體的有效途徑。Sorntip 等通過未授粉子房的誘導、分化和再生培養獲得植株,其培養流程較繁瑣且效率較低。Deng 等報道了一套誘導效率較高的黃瓜未授粉子房離體培養獲得再生植株的技術體系,主要技術路線如下:子房4 ℃預冷4 d,MS+0.06 mg·LTDZ(噻苯隆)+蔗糖3%+瓊脂7%培養基培養,33 ℃熱激暗處理2 d 后轉入25 ℃,光照16 h/黑暗8 h 條件下培養直接誘導植株再生,但試驗過程中發現部分基因型不產胚或胚產量極低,最終不能獲得再生植株。這類現象在南瓜、西葫蘆等作物上也有報道,這說明提高胚狀體的誘導率是獲得再生植株的前提。蘇賀楠等以高出胚的材料為媒介與低出胚的材料雜交,提高了胚狀體誘導率。出胚能力具有加性效應,高出胚能力由顯性核基因控制。不少國內外學者研究或總結了瓜類作物未授粉子房胚胎發生的影響因素,但是較系統、全面的研究并不多。筆者比較了不同基因型、播種季節、栽培方式、取材時期、子房發育時期、培養基附加不同濃度TDZ、不同梯度熱激溫度和不同梯度熱激時間對黃瓜未授粉子房胚誘導和植株再生的影響;同時對再生植株的倍性水平、同質性,以及生根、馴化、移栽技術進行研究,以期建立適合多種基因型的高頻胚誘導體系,為單倍體育種技術的推廣應用奠定基礎。
1 材料和方法
1.1 材料
參試材料為貴州省農業科學院園藝研究所提供的9 個黃瓜材料,材料信息詳見表1。SG033、SG049、SG026 屬于早、中熟品種,適應性廣,強雌性,主蔓節瓜多,品質優良;SG002、SG035 屬于早、中熟品種,強雄性,植株長勢強,分枝少,葉色為深綠色,第一雄花節位3~6 節。試驗于2020—2021年在貴州省園藝研究所蔬菜試驗地及遺傳育種實驗室進行。
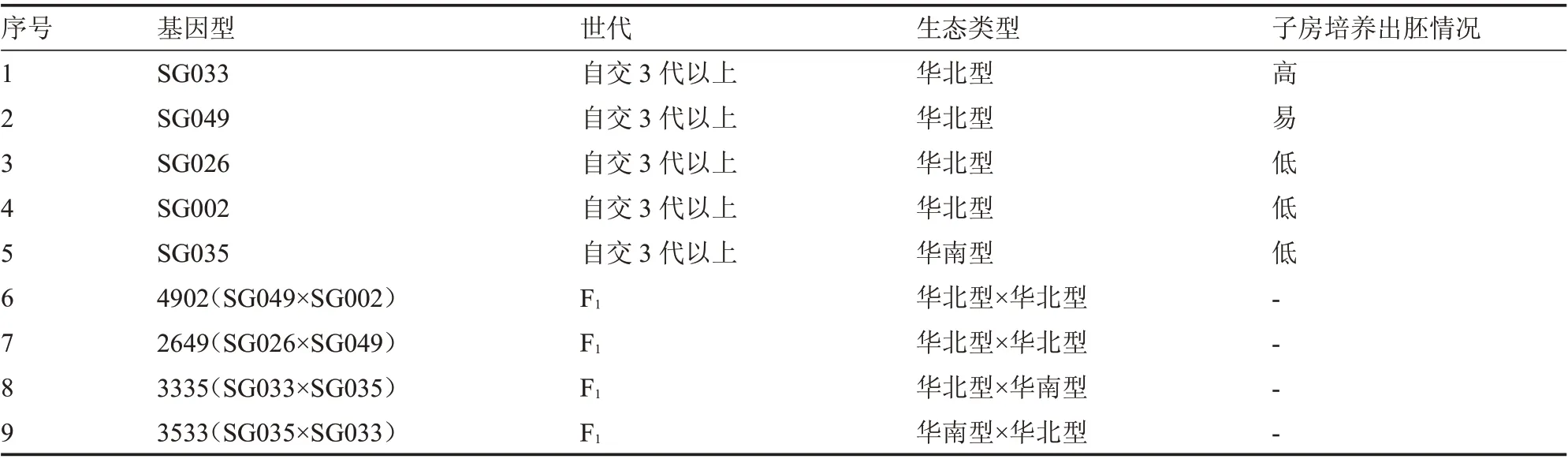
表1 黃瓜未授粉子房培養試驗材料
噻苯隆(98%)、6-芐氨基腺嘌呤(99%)、α-萘乙酸(96%)、氫氧化鈉、硝酸銀濃縮液購自貴州明涵生物科技有限公司;DNAsecure Plant Kit 試劑盒、2×Talent qPCR PreMix 購自天根生化科技(北京)有限公司;甲醛溶液購自重慶江川工(集團)有限公司;30%Acr/Bis 制膠液、10×TBE 緩沖液(pH=8.3)購自酷來搏;過硫酸銨、四甲基乙二胺購自阿拉丁試劑;SSR 標記引物由武漢金開瑞生物工程有限公司合成。
1.2 試驗設計
1.2.1 不同基因型對胚狀體誘導的影響 參照Deng 等的方法對上述9 個基因型進行未授粉子房培養(稍加改進),75%酒精浸泡時間改為30~50 s,1%次氯酸鈉溶液消毒15 min 左右。每個基因型3 次重復,每次重復接種90 個子房片(5 瓶,每瓶18 片)。
1.2.2 不同因素組合對胚狀體誘導的影響 以易出胚基因型SG049 為試材,對播種季節、種植方式、取材時期、子房發育時期、培養基附加不同濃度TDZ、不同梯度熱激溫度和不同梯度熱激時間等7因素(3 因素2 水平+4 因素4 水平)進行完全隨機試驗設計,共16 個處理,每個處理3 次重復,每重復接種90 個子房片(5 瓶,每瓶18 片)。播種季節:夏播時間為2020 年4 月19 日,5 月12 日定植,6月10 日開始取樣;秋播時間為2020 年8 月1 日,8月15 日定植,9 月10 日開始取樣。種植方式:塑料大棚、露地網室;取材時期:初花期(主蔓雌花開放少于15 朵)、盛花期(主蔓雌花開放15~35 朵之間)。子房發育時期:取開花前1 d(-2)、開花前6 h(-1)、開花當天(0)、開花后1 d(+1),其中開花當天及開花后1 d 的雌花需于開花前套袋防止授粉;不同熱激溫度處理子房:25、33、35、37 ℃,分別暗處理1、2、3、4 d;培養基中附加TDZ 質量濃度為:0.03、0.06、0.08、0.10 mg·L。以MS 培養基為基礎培養基(4.43 g·LMS 粉+30 g·L蔗糖+7 g·L瓊脂,pH=5.8~6.0)。
1.2.3 再生植株倍性鑒定 利用流式細胞儀(Partec,Münster,Germany)鑒定再生植株的倍性水平,參考Deng 等的方法進行試驗,根據呈現的峰值判斷再生植株的倍性。
1.2.4 SSR 分子標記分析 經倍性鑒定為二倍體的組培苗,隨機選取6 株用于同質性檢驗。采用DNA secure Plant Kit 試劑盒提取DNA 基因組,用濃度為1%瓊脂糖凝膠檢測DNA 基因組的完整性。從55 對SSR 物(表2)中篩選具有多態性的標記用于再生植株同質性檢驗。擴增總體系為20 μL:模板DNA 1 μL,前引物和后引物各1 μL,Mix 10 μL,ddHO 7 μL。擴增程序在PCR 儀中進行:95 ℃預變性1 min,95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸1 min,24 個循環;72 ℃延伸5min,最后4 ℃保存。擴增產物在7.2%聚丙烯酰胺電泳、銀染、顯色后進行分析。
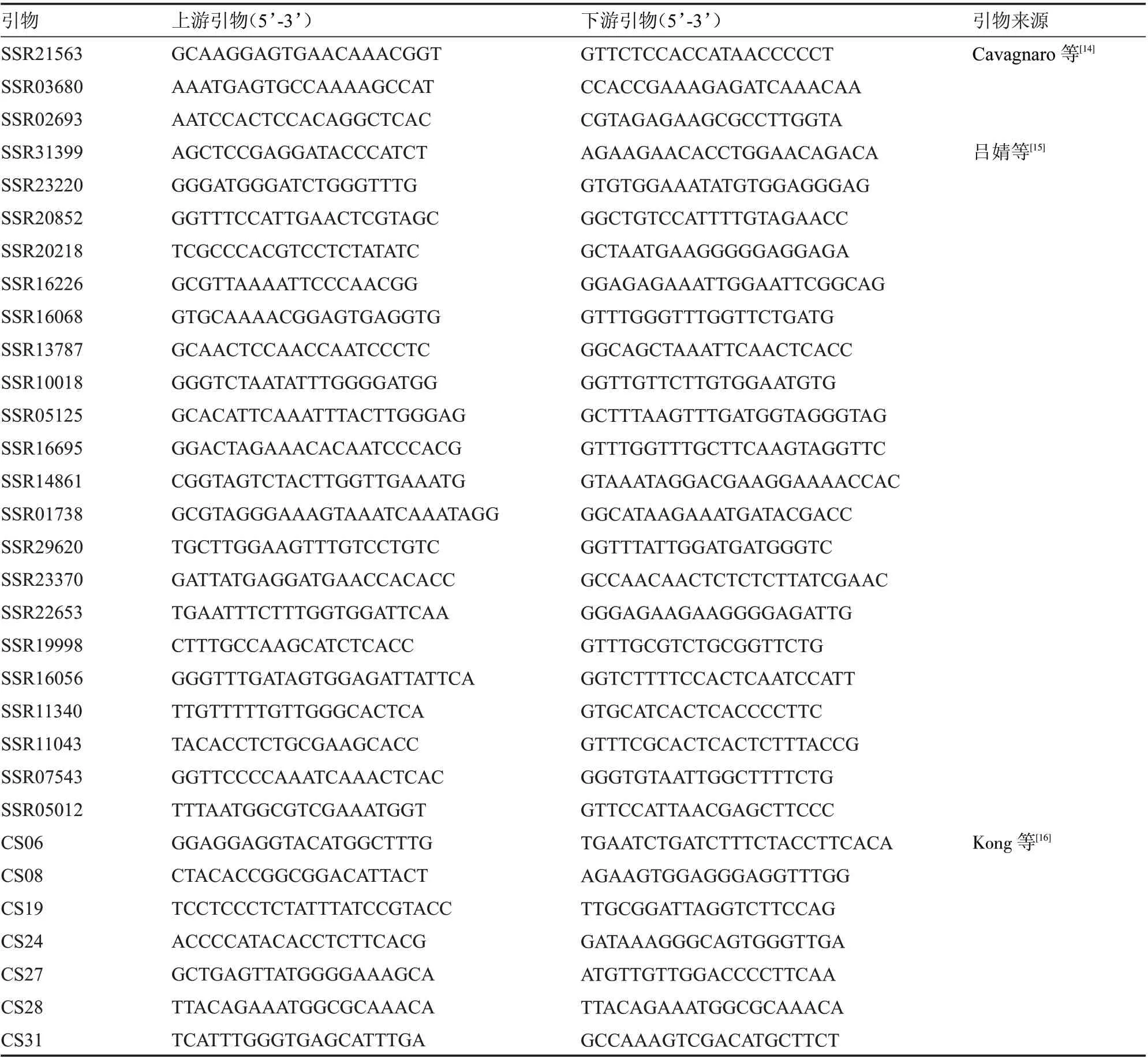
表2 SSR 標記引物的信息

續表2
1.2.5 生根、馴化及移植 每個基因型的再生植株擴繁80 株后進行生根及移栽試驗。2649 的再生植株接種于R 培養基(1/2 MS+0.02 mg·LNAA)、S培養基(MS+0.02 mg·LNAA)進行生根誘導,篩選最佳生根培養基。3533、3335、4902 的再生植株接種于最佳生根培養基在相同條件下進行誘導生根。每個處理接4 瓶,每瓶接5 株,設3 次重復。當生根充分且植株葉片生長至4~7 片時,擰松瓶蓋室內馴化1 d,再揭開瓶蓋室內馴化1 d,將其移植于含泥炭+珍珠巖+蛭石(體積比3∶1∶1)混合基質的營養缽(直徑12 cm,高9 cm)中,在人工氣候箱內(晝夜溫度25 ℃/18 ℃、光照度3500 lx,光照時間12 h)馴化14 d,將成活植株定植于溫室大棚,常規肥水管理。馴化前10 d 隔天噴施1 次自制營養液(4.43 g·LMS+30 g·L蔗糖,pH=5.8)。
1.3 測定指標及方法
1.3.1 出胚率 以子房片表面產生明顯胚狀體結構時記為出胚;出胚率/%=出胚子房數/接種子房總數×100。
1.3.2 植株再生率 當胚狀體誘導出具有莖、葉和芽的組織時記為植株再生;植株再生率/%=形成完整植株數/接種子房總數×100。
1.3.3 馴化成活率 營養缽中的植株生出新根和嫩芽時記為植株馴化成活;馴化成活率/%=馴化成活植株數/馴化植株總數×100。
1.3.4 定植成活率 定植于溫室大棚的植株能正常生長時記為植株定植成活;定植成活率/%=定植成活植株數/定植植株總數×100。
1.4 數據分析
利用Microsoft Excel 2019 對數據進行處理和作圖,用DPS 18.10 進行顯著性(Duncan)分析,用Photoshop 2019 軟件處理圖片。
2 結果與分析
2.1 黃瓜子房培養形成再生植株的過程
黃瓜子房接種到培養基后35 ℃熱激暗處理2 d,子房片表面顏色由綠變黃且胚珠開始膨大(圖1-A~B),轉入25 ℃光照培養室繼續培養7 d,膨大的胚珠從組織中突出并繼續發育(圖1-C)。繼續培養20 d,胚狀體突破珠被(圖1-D),發育成球形胚(圖1-E)、心形胚(圖1-F)、魚雷形胚(圖1-G)和子葉形胚(圖1-H)。子葉形胚分化形成具有明顯根和葉的組織(圖1-I),切取小植株進行增殖培養(圖1-J、K),形成具有莖、葉和芽的再生植株(圖1-L)。這一過程需要4 個月左右。
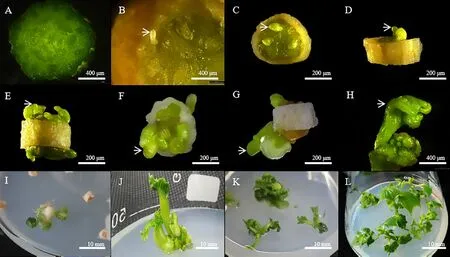
圖1 黃瓜子房離體培養形成再生植株的過程
2.2 不同基因型對胚發生及植株再生的影響
2.2.1 不同基因型對出胚率的影響 由圖2 可知,
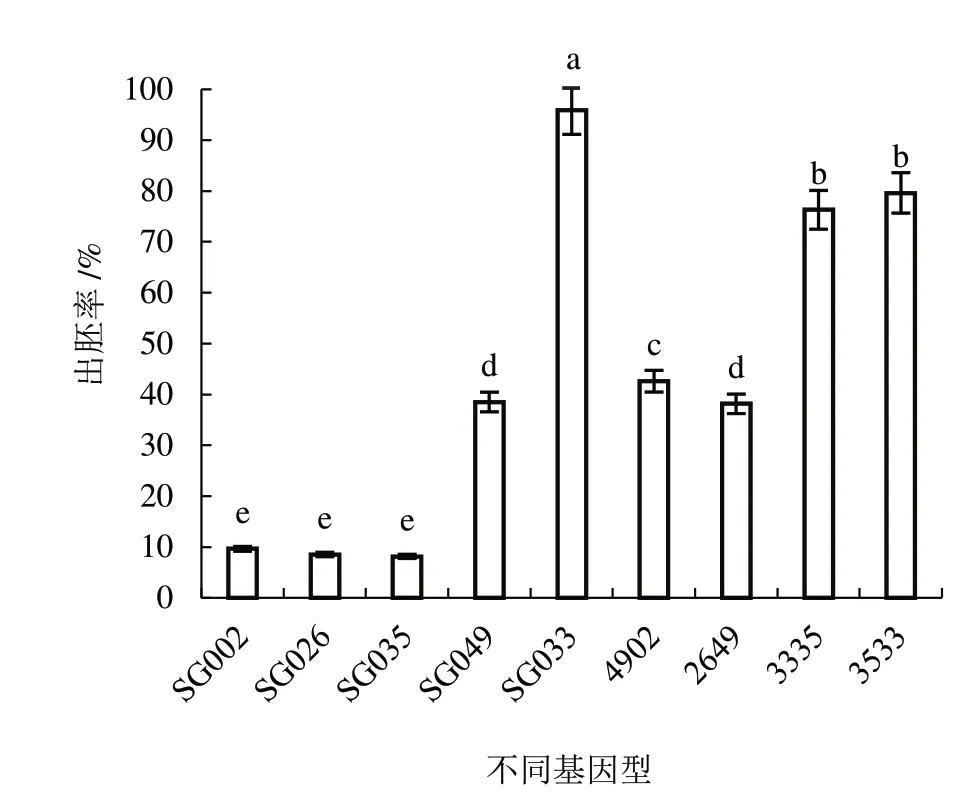
圖2 不同基因型對出胚率的影響
9 個基因型的出胚率差異顯著,其中,SG033 出胚率最高,為95.93%;SG035 出胚率最低,為8.15%。說明基因型是影響子房培養胚發生的主要因素。將低出胚材料SG035 與出胚能力強的基因型SG033正、反交,雜交種3533 和3335 的出胚率顯著高于出胚率低的親本材料。將低出胚材料與易出胚基因型雜交,雜交種4902 的出胚率顯著高于易出胚親本材料SG049。通過差異顯著性分析,將9 份材料分為高出胚(≥50.00%)、易出胚(≥25.00%~50.00%)、中等出胚(≥10.00%~25.00%)和低出胚(<10.00%)的4 類基因型。
2.2.2 不同基因型對植株再生率的影響 由圖3
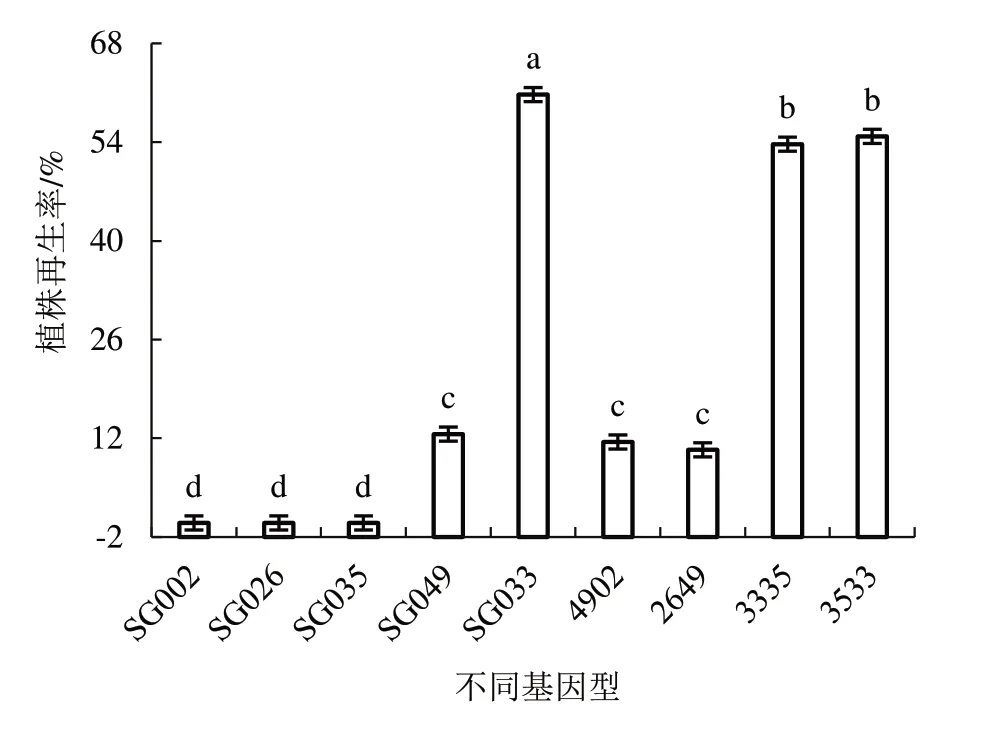
圖3 不同基因型對植株再生率的影響
可知,供試的9 個黃瓜材料中僅3 個低出胚基因型不能誘導出苗。其中,高出胚基因型SG033 與其他基因型植株再生率差異顯著,為60.74%;將其與低出胚基因型SG035 正、反交,雜交種3335、3533 植株再生率顯著高于低出胚親本材料,且2 個雜交種之間的植株再生率無明顯差異,分別為53.70%、54.81%。易出胚基因型SG049 的植株再生率相對較低(12.59%),將其與低出胚基因型SG002、SG026雜交后,2 個雜交種的植株再生率介于雙親之間,并顯著高于低出胚型親本,但與高出胚型親本無明顯差異。
2.3 不同因素組合對胚狀體誘導的影響
由表3 可知,16 個不同處理的出胚率有顯著差異,其中,處理11(秋季播種、定植于塑料大棚、盛花期取樣、開花前1 d 的未授粉子房、培養基中附加0.08 mg·LTDZ、35 ℃熱激處理2 d)出胚率最高,為52.22%;其次是處理6、14、3,出胚率分別為39.26%、22.22%、21.48%;最差的處理為1、8、10、15,不能誘導出胚(開花后1 d 的子房);其他8 個處理的出胚率較低,在1.48%~11.85%之間。
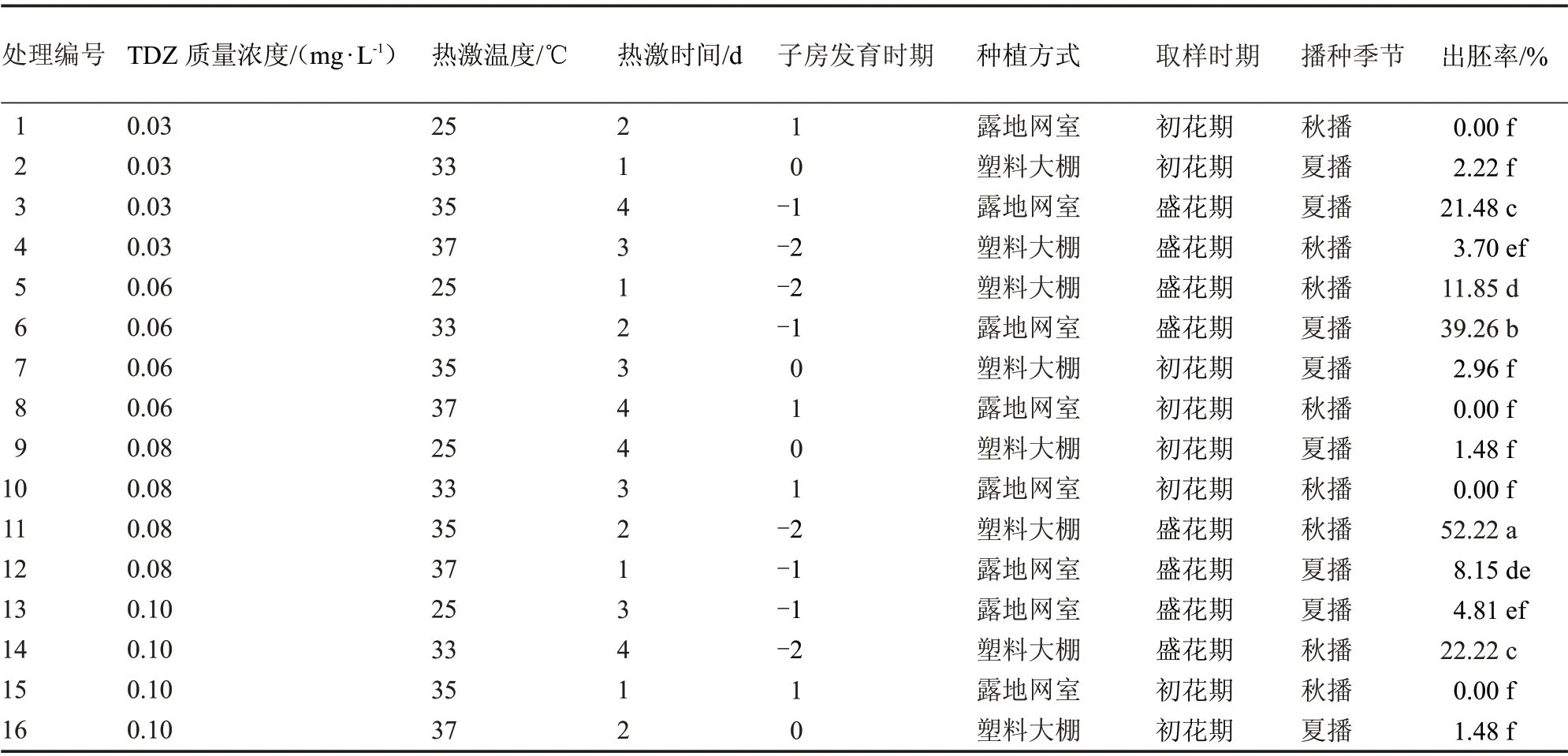
表3 不同因素組合對出胚率的影響
2.4 體系優化后的胚誘導率及植株再生率
2.4.1 體系優化后的胚誘導率 由圖4 可知,對影響因素進行優化后選用處理11 進行子房培養,4 個基因型胚發生效果較好。其中易出胚基因型SG049、2649、4902 出胚率分別為52.96%、51.48%、73.70%,達到了誘導高頻胚的效果。低出胚基因型SG002 出胚率為27.04%,達到了誘導易出胚基因型的效果。
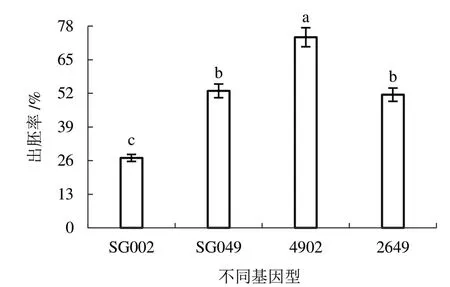
圖4 體系優化后的黃瓜子房出胚率
2.4.2 體系優化后的植株再生率由圖5 可知,對影響因素進行優化后選用處理11 進行子房培養,4 個基因型都能誘導出再生植株。其中,易出胚基因型SG049、2649、4902 植株再生率分別為25.93%、20.74%、33.70%,在原來的基礎上分別增加了1.06、1.00、1.94 倍;且低出胚基因型SG002 植株再生率突破零,提升至5.93%。
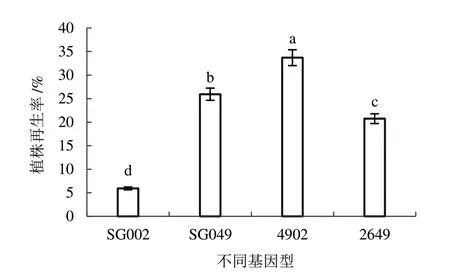
圖5 體系優化后的黃瓜子房植株再生率
2.5 再生植株倍性鑒定
以二倍體黃瓜植株葉片為對照(圖6-D),利用流式細胞儀鑒定來源于4902 和2649 的再生植株倍性。對照葉片DNA 在相對熒光強度200 處出現分離峰(圖6-F),由此推斷分離峰出現在相對熒光強度100 處的為單倍體(圖6-E),分離峰出現在相對熒光強度300 處的為三倍體(圖6-G)。測定結果顯示,4902 的再生植株存在單倍體(圖6-E)、二倍體(圖6-F),2649 的再生植株存在二倍體(圖6-F)、三倍體(圖6-G)。除了再生植株相對核計數的差異外,還觀察到不同的表型差異,單倍體再生植株的莖葉細小(圖6-A),三倍體再生植株的莖葉片粗大(圖6-C),二倍體再生植株表現為正常植株(圖6-B)。
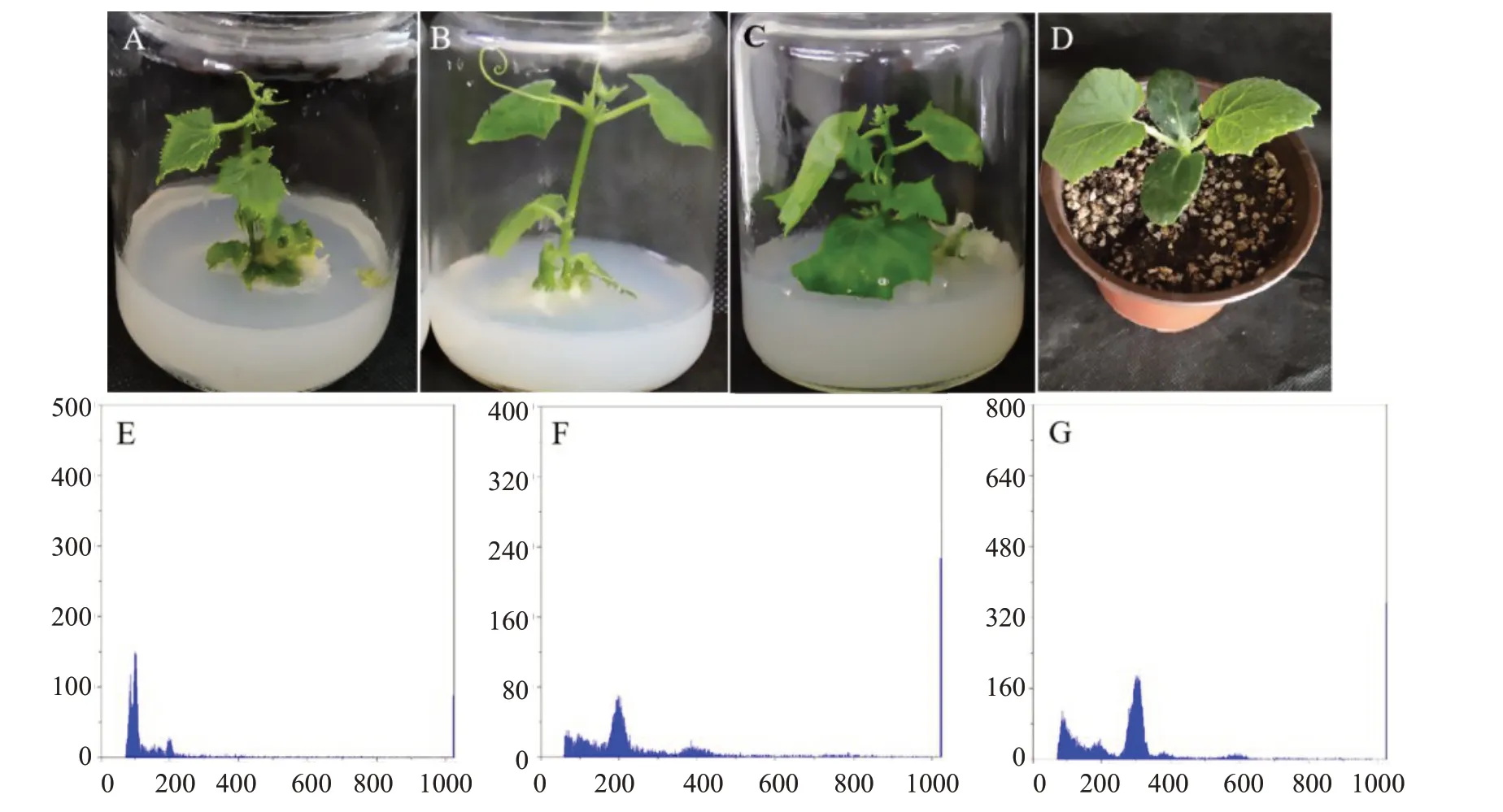
圖6 黃瓜再生植株的表型及DNA 分布
2.6 再生植株同質性檢驗
利用SSR 對來源于雜交種2649、4902 的二倍體組培苗同質性進行檢驗,首先在55 對引物中篩選在供體植株及雙親中具有多態性的標記。由圖7可知,引物CS24 在供體植株2649、母本SG026 和父本SG049 之間具有多態性,引物SSR21563 在供體植株4902、母本SG049 和父本SG002 之間具有多態性。PCR 產物電泳結果顯示,2649 的6 株再生植株條帶與父本一致,由此確定這6 株再生植株是由胚囊細胞發育而來的純合雙單倍體。4902 的6株再生植株條帶與雙親不同,而與供體植株一致,由此確定這6 株再生植株是由體細胞發育而來的雜合二倍體。
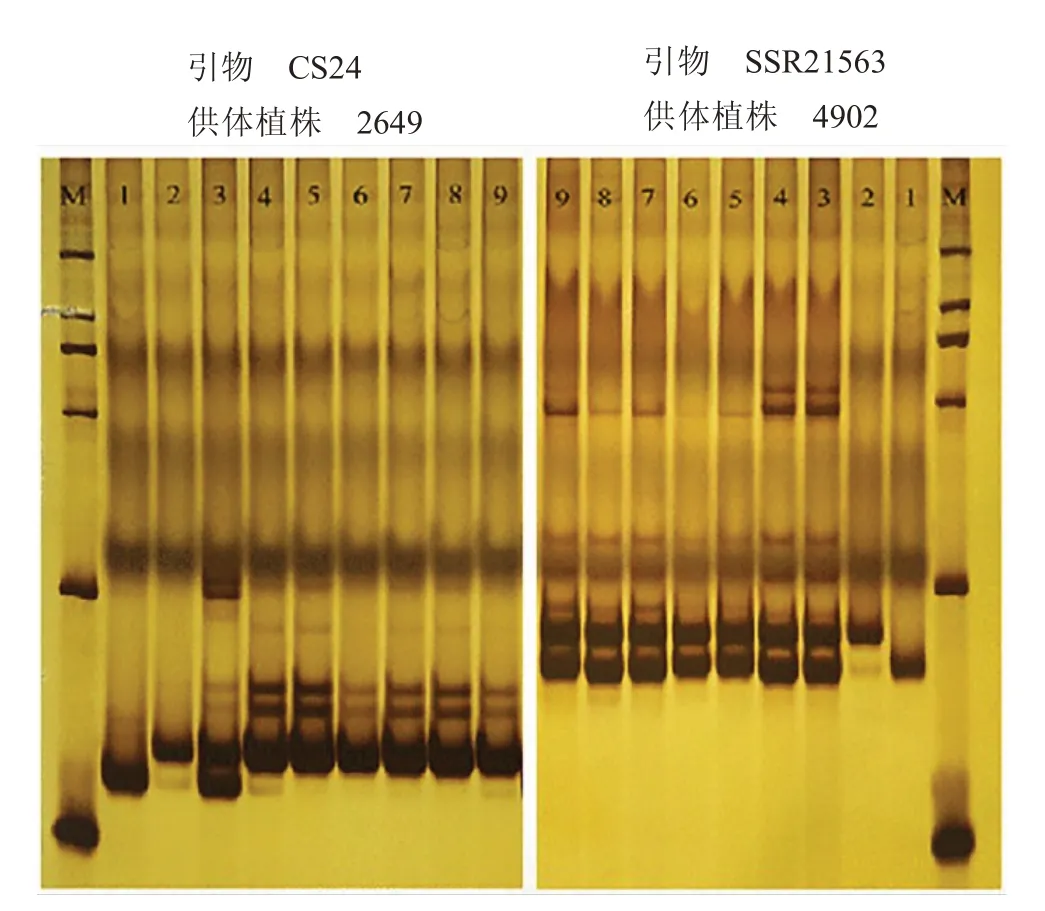
圖7 多態性引物CS24 和SSR21563 的電泳條帶
2.7 植株的生根、馴化及移栽
再生植株誘導生根3 周時,R 培養基中的植株生根快且根系較多(圖8-A),而S 培養基中的植株生根慢且根系少(圖8-B)。達到移栽水平的再生植株洗去根系表面培養基(圖8-C~D),移栽于含混合基質的營養缽中,在人工氣候箱內馴化14 d(圖8-E),植株馴化成活率為71.67%~85.00%,將成活植株定植于溫室大棚1 個月,植株定植成活率為95.83%~100%(圖9)。

圖8 再生植株生根及移栽情況
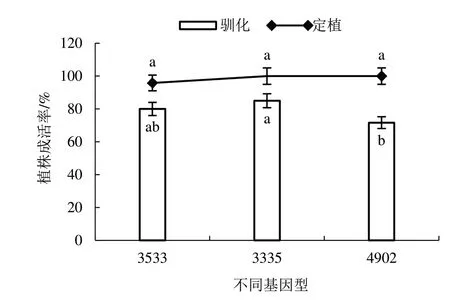
圖9 再生植株馴化成活率和定植成活率
3 討論與結論
基因型是影響雌核發育的關鍵因素,部分基因型較頑固,不能誘導出胚或出胚率極低,制約了未授粉子房培養技術在育種中的運用。本試驗結果表明,利用高出胚基因型與低出胚基因型進行雜交,其雜交后代的胚胎發生能力顯著提高,部分雜交種的出胚率優于出胚能力強的親本基因型,推測黃瓜高出胚能力可以遺傳并具有加性效應,這與蘇賀楠等和伍健繽等的報道一致;供試的9 份材料中有6 份基因型獲得再生植株,表明基因型是決定黃瓜未授粉子房誘導成功的主要因素。這種現象在蕓薹屬小孢子培養上也有類似報道。如果品種有滿足育種需求的目標性狀,但是材料不產胚或產胚量低,則可以通過與高胚胎發生能力的橋梁品種雜交,其雜交后代可能是既高出胚又滿足育種目標的基因型,以實現快速純化某些目標性狀,這對黃瓜的回交育種具有重要意義。
雌核發育培養中的熱激處理是一個重要的步驟,多數學者認為32~35 ℃熱激處理2~5 d 對瓜類作物雌核發育起著積極作用;然而,Tantasawat等卻認為35 ℃熱激3 d 降低了黃瓜胚狀體發生率。王璐等和刁衛平等培養黃瓜未授粉子房,在35 ℃熱激條件下,啟動雌核發育的最適TDZ 質量濃度分別為0.06、0.04 mg·L。TDZ 具有生長素和細胞分裂素的雙重功效,能有效誘導外植體的一系列分化。在南瓜、西瓜未授粉子房誘導培養基中添加TDZ 誘導形成的胚狀體畸形率較低,有利于成苗。因此,筆者只對TDZ 的處理效果進行了研究,發現子房培養的最優組合為處理11(秋季播種,定植于塑料大棚,盛花期取樣,以開花前1 d 的未授粉子房為外植體,4 ℃預冷處理4 d,接種于誘導培養基MS+0.08 mg·LTDZ+30 g·L蔗糖+7 g·L瓊脂,35 ℃熱激暗處理2 d);該組合培養易出胚基因型的胚誘導效果達到了誘導高頻胚的效果,且低出胚材料的植株再生率在Deng 等建立的培養體系中突破零提高到5.93%。
目前,雌核發育誘導技術還不能對單個卵細胞進行離體培養,由此獲得的再生植株倍性不確定。因此,需要利用流式細胞儀、根尖染色體計數等手段鑒定再生植株的倍性。筆者在形態學觀察的基礎上,采用流式細胞儀對再生植株倍性進行鑒定,發現再生植株是由單倍體、二倍體(或雙單倍體)及三倍體組成的混合群體,這與李玲等的研究結果相似。由于雙單倍體與正常二倍體有著相同數量的核和染色體數目,難以用流式細胞儀和細胞遺傳學來辨別二者,而利用SSR 分子標記能檢測雙單倍體和二倍體植株的同質性。SSR 標記已成功鑒定了梨、馬鈴薯、椰子等作物自發雙單倍體的純度,也成功用于黃瓜未授粉子房再生植株的同質性檢驗。筆者在本試驗中發現,引物SSR21563、CS24 能區分再生二倍體組培苗的同質性。
綜上所述,通過對黃瓜未授粉子房培養體系進行優化研究,獲得了最佳培養體系——將低出胚材料與出胚能力強的材料雜交,秋季播種,定植于塑料大棚,盛花期取樣,以開花前1 d 的未授粉子房為外植體,4 ℃預冷處理4 d,接種于誘導培養基MS+0.08 mg·LTDZ+30 g·L蔗糖+7 g·L瓊脂,35 ℃熱激暗處理2 d。

