核黃素通過激活SCAD抑制小鼠心力衰竭
徐慶萍, 鐘小藝, 秦 學, 馮靜韻, 彭 歡, 蘇永少, 馬智超, 周四桂
(廣東藥科大學1. 中藥學院,廣州 510006;2. 附屬第一醫院臨床藥學重點專科,廣東 廣州 510699)
心力衰竭是人類健康的“第一殺手”,是心血管疾病的終末階段。心力衰竭屬于發病率、住院率和死亡率高的疾病,甚至比許多癌癥還高[1],隨著現代社會老齡化趨勢逐漸增強,心血管疾病發病人數逐年上升,因此,尋找更有效的心力衰竭治療藥物迫在眉睫。
心肌能量代謝障礙與心力衰竭的發生密切相關[2]。短鏈酰基輔酶A脫氫酶(short-chain acyl-CoA dehydrogenase,SCAD)是脂肪酸β氧化的限速酶,催化短鏈酰基輔酶A的脫氫反應[3]。我們的前期研究發現,SCAD在慢性高血壓、心肌梗死后心力衰竭大鼠及心肌細胞凋亡模型中表達顯著下調[4-6],而SCAD重組腺病毒能明顯改善大鼠心肌梗死后心力衰竭[7]。核黃素(riboflavin)又稱維生素B2,其在體內代謝產物之一為黃素腺嘌呤二核苷酸(flavin adenine dinucleotide, FAD),FAD是真核細胞中大量脫氫酶的輔酶[8]。FAD參與酰基輔酶A脫氫酶家族發揮生理作用的過程,而SCAD是酰基輔酶A脫氫酶家族成員中和FAD綁定最緊密的一員[9]。本課題組前期研究表明,FAD可通過激活SCAD來抑制大鼠病理性心肌肥厚以及心肌纖維化[10]。研究發現,核黃素能減輕大鼠I型糖尿病心力衰竭和小鼠心肌梗死模型的心肌損傷[11-12]。然而,核黃素能否通過提高FAD含量,激活SCAD從而抑制壓力超負荷誘導的小鼠心力衰竭,尚不清楚。
本研究采用主動脈弓縮窄術(thoracic aortic constriction, TAC)構建壓力超負荷誘導的小鼠心力衰竭模型,術前1周及術后8周進行核黃素灌胃治療,觀察核黃素對壓力超負荷誘導小鼠心力衰竭的作用及其防治機制,為核黃素用于臨床防治心力衰竭提供實驗依據。
1 材料與方法
1.1 實驗動物與試劑SPF級C57BL/6J小鼠40只,♂,體質量(20±2)g,購自廣州中醫藥大學實驗動物中心。許可證號:SCXK(粵)2018-0034。核黃素(Sigma,批號:WXBD28883V)、SCAD酶活性試劑盒(GENMED,批號:1-2018412-10)、SYBR Green (TaKaRa,批號: AJ12457A)、多克隆兔抗SCAD(ProteinTech,批號:00012655)、多克隆兔抗Bcl-2(ProteinTech,批號:00083551)、多克隆兔抗Bax(ProteinTech,批號:00082363)、多克隆兔抗cleaved-caspase-3(ProteinTech,批號:00088666)、單克隆鼠抗GAPDH(ProteinTech,批號:10013030)、ATP試劑盒(碧云天,批號:082720201203)、FAD酶聯免疫吸附測定試劑盒(上海雙贏生物科技,批號:202106)、游離脂肪酸試劑盒(南京建成,批號:20210813)。
1.2 儀器紫外可見分光光度計(SHIMADZU),全自動酶標儀 (SpectraMax i3x),化學發光儀(上海勤翔),酶標儀(Thermo),熒光定量PCR儀(伯樂),電儀分析天平(SHIMADZU),微量分光光度計(ALLSHENG Nano-100)。
1.3 小鼠TAC術誘導心力衰竭模型構建以及核黃素干預選取8周齡C57BL/6J ♂小鼠48只,適應性飼養1周后,隨機分為4組:Sham組(10只)、Sham+核黃素組(10只)、TAC組(14只)以及TAC+核黃素組(14只)。采用TAC術構建壓力超負荷小鼠心力衰竭模型,用0.45%戊巴比妥鈉(45 mg·kg-1)腹腔注射麻醉小鼠后,打開小鼠胸腔,TAC組用0.5 mm孔徑的墊針結扎主動脈弓,Sham組只開胸穿線但不結扎。Sham+核黃素以及TAC+核黃素組術前1周以及術后8周進行灌胃給藥核黃素(20 mg·kg-1·d-1),Sham以及TAC組小鼠予以相同體積的生理鹽水灌胃,TAC組及TAC+核黃素組小鼠在手術過程和術后各死亡4只,而Sham組以及Sham+核黃素組在8周內無小鼠死亡情況,40只小鼠進行后續實驗。術后8周各組10只小鼠進行超聲心動圖檢測后取材,并進行心臟體重比檢測。后續實驗隨機選取每組各6只小鼠用于染色、蛋白表達及生化指標檢測。
1.4 超聲心動圖檢查TAC術后8周,各組小鼠經異氟烷(劑量控制:0%~5%)吸入麻醉后,進行心臟超聲檢測。測量小鼠的各心功能指標:心臟射血分數(ejection fraction, EF)和心臟的縮短分數(fractional shortening, FS)、收縮末期左心室內徑(left ventricular dimensions at end systole, LVIDs)和舒張末期左心室內徑(left ventricular dimensions at end diastole, LVIDd)、心博出量(cardiac output, CO)、心每博輸出量 (stroke volume, SV)、收縮末期左心室容積(left ventricular end systolic volume, LVESV)和舒張末期左心室容積(left ventricular end diastole volume, LVEDV)等。
1.5 動物取材各組小鼠取材前12 h禁食,用3.5%水合氯醛腹腔注射麻醉,經摘眼球取血后,靜置血樣分離血清,心臟用冷凍PBS充分灌注后,取出心臟。部分心臟組織以及全部血清及時速凍置于-80 ℃保存,部分心臟組織經4%多聚甲醛固定進行石蠟包埋切片。
1.6 心肌組織形態學檢查用組織固定液固定部分心臟組織,石蠟包埋后切片,之后采用TUNEL熒光染色法檢測心肌細胞凋亡情況并計算凋亡陽性細胞數占比,從而判斷心力衰竭程度。采用免疫熒光染色法檢測SCAD在心肌組織的表達。
1.7 線粒體膜腫脹程度檢測用組織線粒體分離試劑盒提取小鼠心肌組織線粒體,全波長酶標儀測定線粒體膜通透性轉換孔(mitochondrial permeablity transition pore,mPTP)開放情況,用BCA試劑盒測定線粒體蛋白含量。配制線粒體反應緩沖液,其組分為[150 mmol·L-1KCl、10 mmol·L-1Tris、20 mmol·L-1MOPS、5 mmol·L-1KH2PO4(pH 7.4)],加入相同質量濃度的線粒體后,在540 nm波長處,每間隔1 min,測試20 min,檢測吸光度值的下降幅度,設吸光值變化的量ΔA,初始為A,以ΔA/A表示小鼠心肌組織中線粒體膜腫脹程度。
1.8 線粒體膜電位檢測用上述線粒體提取試劑盒提取心肌線粒體后,具體步驟嚴格按照試劑盒進行,測定JC-1單體及其聚合物的熒光強度。統計各組相對對照組的JC-1聚合物與單體熒光強度比值,即為各組的心肌線粒體膜電位變化。
1.9 心肌中FAD含量檢測用生理鹽水搗碎心肌組織后,離心后取上清,得組織勻漿,之后嚴格按照試劑盒實驗步驟進行檢測。
1.10 ATP含量測定用試劑盒提供的ATP檢測裂解液裂解心肌組織后,把所測得的樣品熒光值代入根據試劑盒制得的標準曲線中,得ATP濃度,同時進行蛋白定量,檢測各組心肌組織中ATP含量。
1.11 SCAD酶活性檢測根據2,6-二氯靛酚鈉作為人工電子受體,在SCAD的催化下,由短鏈脂酰輔酶A乙酰輔酶A提供的電子,經過硫酸鉀脂吩嗪的傳遞,產生其還原產物的吸光度值降低的原理,采用比色法進行SCAD酶活性測定,具體操作嚴格按照說明書進行。
1.12 游離脂肪酸含量檢測游離脂肪酸能與銅試劑反應生成對應銅鹽,采用紫外分光光度計測定各組樣品OD數值,代入試劑盒提供的計算公式,得心肌與血清中游離脂肪酸含量,具體操作嚴格按照說明書進行。
1.13 Western blot分析用RIPA裂解液裂解心臟組織,提取蛋白,用BCA試劑盒蛋白定量后,100 ℃煮沸蛋白5 min。配濃縮膠以及分離膠,控制每塊膠的梳孔上等量蛋白樣品,隨后進行電泳,條件為濃縮膠70 V,30 min,分離膠120 V,90 min。按照快速轉膜法進行轉膜,轉膜條件為:330 mA,37 min。轉膜結束,TBST緩沖液洗膜,再用5%BSA溶液室溫封閉1.5 h。封閉后,一抗4 ℃孵育過夜,一抗的稀釋比為:SCAD抗體(1 ∶1 000)、Bcl-2(1 ∶1 000)、Bax(1 ∶2 000)、cleaved caspase-3(1 ∶1 000)、pro-caspase-3(1 ∶1 000)、GAPDH抗體(1 ∶100 000)。d 2用TBST緩沖液洗膜后,室溫孵育二抗1 h,二抗稀釋比為兔抗(1 ∶10 000)、鼠抗(1 ∶10 000)。最后TBST緩沖液洗膜后,用化學發光儀進行蛋白表達檢測。
1.14 Real-time PCR用裂解液TRIzol裂解心肌組織,提取RNA,隨后測定RNA的純度和濃度。根據試劑盒說明書操作,把RNA反轉錄后合成cDNA,保存于-20 ℃冰箱中。d 2,配制RT- PCR 反應體系,上機檢測。小鼠源SCAD基因引物序列見Tab 1。

Tab 1 Real-time PCR experimental gene primer sequences
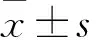
2 結果
2.1 核黃素對小鼠心臟體重比的影響由Fig 1所示,與Sham組相比,TAC誘導心力衰竭模型組的小鼠心臟體重比明顯增大(P<0.01);與TAC組相比,TAC+核黃素組小鼠心臟體重比明顯減小(P<0.01),表明核黃素明顯改善了壓力過載誘導心力衰竭小鼠的心臟體積與重量增加。
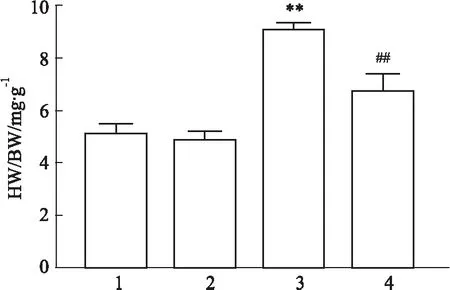
Fig 1 Comparison of ratios of heart weight (HW)/body weight (BW) of mice in each n=10)
2.2 核黃素對小鼠超聲心動圖的影響如Fig 2A所示,Sham組和Sham+核黃素組左心室壁收縮舒張功能正常,TAC組左心室壁出現收縮舒張功能障礙的情況,心室腔增大。與TAC組相比,TAC+核黃素組收縮舒張功能明顯增強,心室腔減小。如Fig 2B所示,與Sham組相比,TAC組的心輸出量、每搏輸出量、EF值和FS值均明顯減小(P<0.01),而收縮/舒張末期左心室內徑與容積均明顯增大(P<0.01),表明TAC術后8周小鼠心臟收縮舒張功能障礙,心臟射血能力及心功能指數明顯下降,心力衰竭模型構建成功。與TAC組相比,TAC+核黃素組的上述指標均得到明顯改善。以上結果表明,核黃素能明顯延緩TAC手術后小鼠發展為心力衰竭的病理進程。
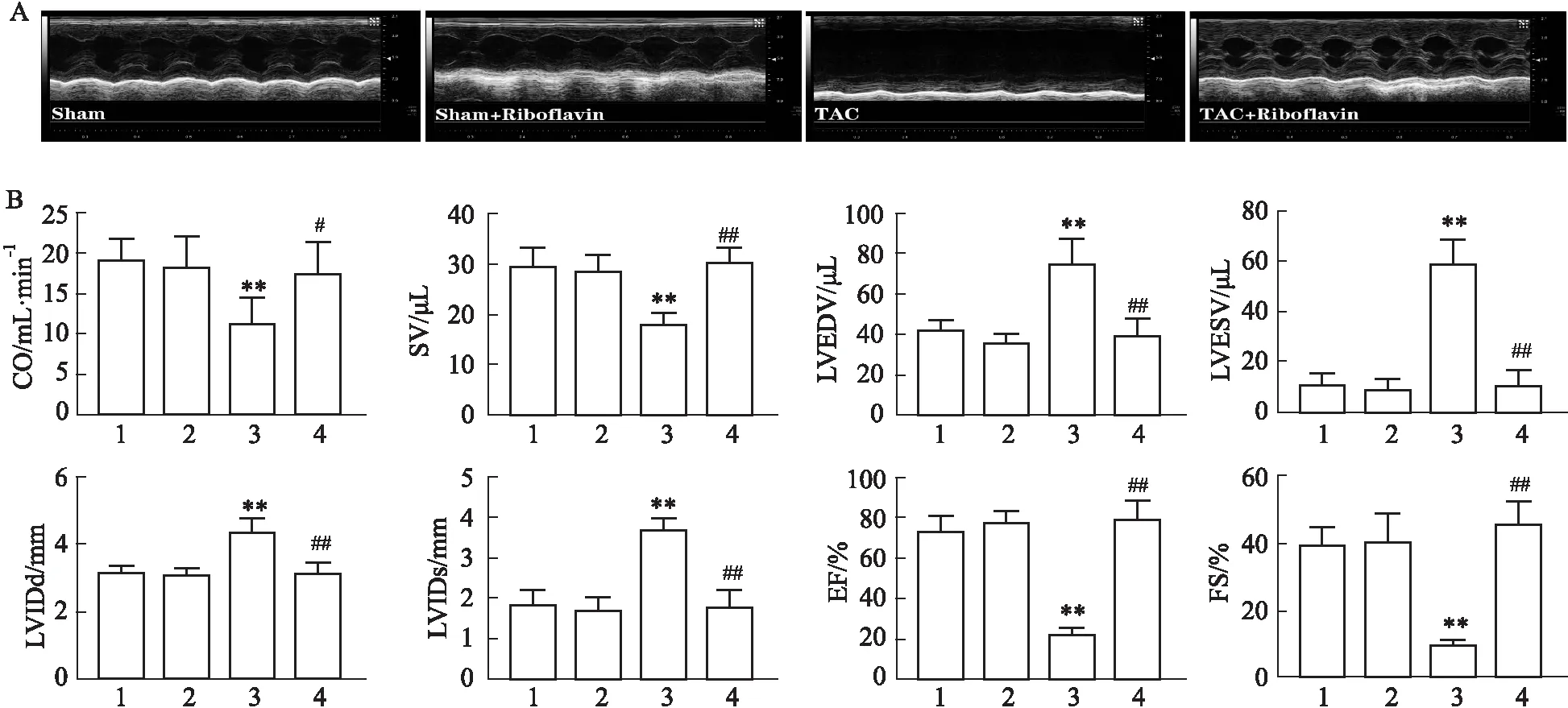
Fig 2 Changes of echocardiography in each group n=10)
2.3 核黃素對小鼠心肌細胞凋亡的影響由Fig 3 TUNEL熒光結果圖顯示,凋亡細胞呈現綠色熒光。其中Sham組及Sham+Riboflavin組左心室沒有出現明顯的細胞凋亡現象;與Sham組比較,TAC組左心室陽性凋亡細胞數明顯高于Sham組(P<0.01),出現大量細胞凋亡現象。與TAC組相比,TAC+Riboflavin組左心室心肌細胞凋亡情況得到明顯改善,陽性凋亡細胞數明顯下降(P<0.01),表明核黃素具有抗心肌細胞凋亡的作用。

Fig 3 TUNEL staining of mice in each group (400×) n=6)
2.4 核黃素對小鼠心肌組織凋亡蛋白表達的影響如Fig 4所示,與Sham組相比,TAC組小鼠的心肌組織促凋亡蛋白Bax與cleaved-caspase-3表達均明顯增加(P<0.01),抗凋亡蛋白Bcl-2表達明顯減少(P<0.01)。與TAC組相比,TAC+Riboflavin組心肌組織促凋亡蛋白Bax與cleaved-caspase-3表達均明顯減少(P<0.01),而抗凋亡蛋白Bcl-2表達明顯增加(P<0.01),以上變化與心肌組織TUNEL熒光染色結果一致,表明核黃素能夠明顯改善心肌細胞凋亡。
Fig 4 Expression of apoptotic protein in myocardial tissues of mice in each group n=6)
2.5 核黃素對小鼠心肌組織中SCAD表達、酶活性以及FAD含量的影響由Fig 5A-C所示,與Sham組相比,TAC組小鼠心肌組織中SCAD的蛋白、mRNA表達和其酶活性均明顯減少(P<0.01);與TAC組相比,TAC+Riboflavin組小鼠SCAD蛋白、mRNA在心肌組織中表達及其酶活性均明顯增加(P<0.01)。由Fig 5D所示,與Sham組相比,TAC組小鼠心肌組織中FAD含量明顯減少(P<0.01);與TAC組相比,TAC+Riboflavin組小鼠心肌組織中FAD含量明顯增加(P<0.01),表明核黃素可能通過提高FAD水平,從而激活SCAD,起到抑制壓力超負荷誘導的小鼠心力衰竭作用。
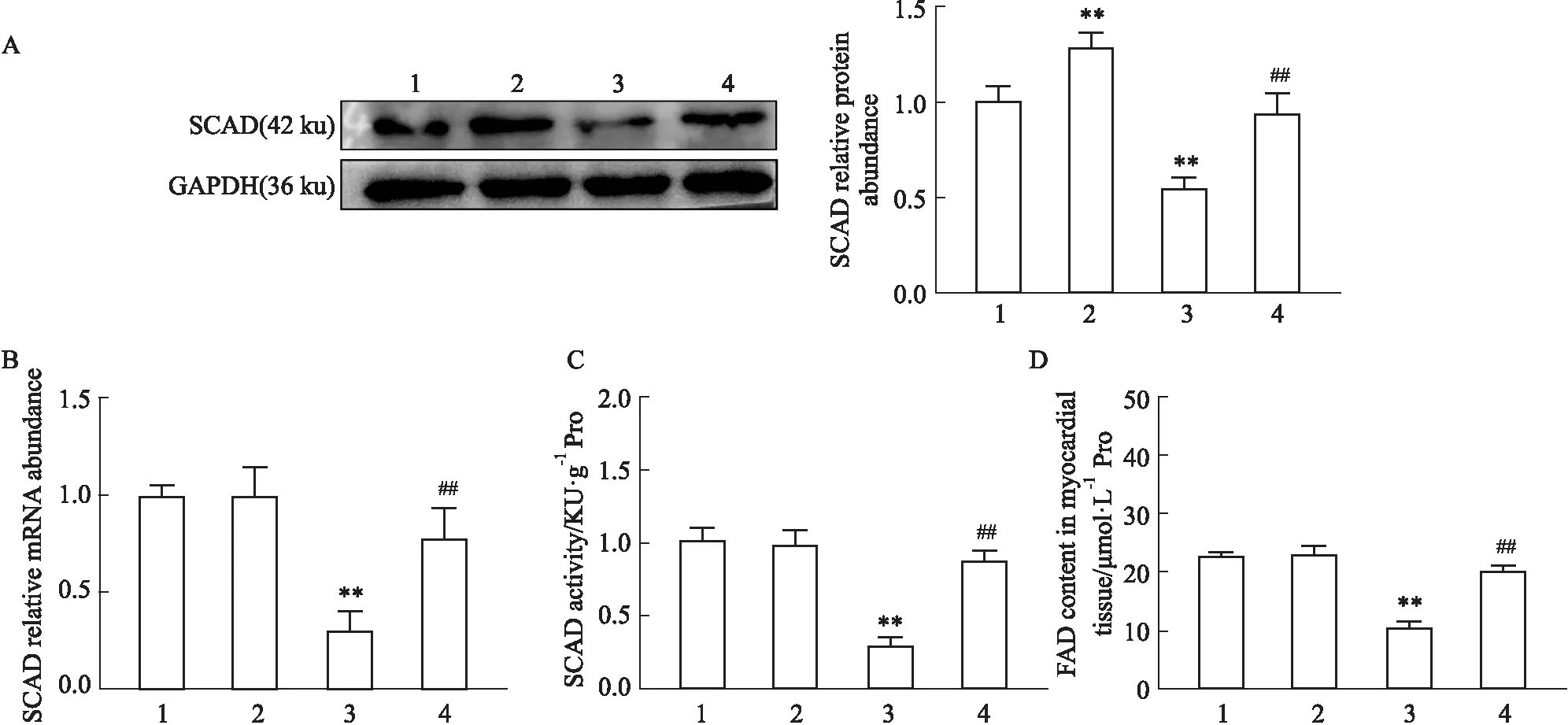
Fig 5 SCAD protein, mRNA, enzyme activity and FAD content in myocardial tissues of mice in each group n=6)
2.6 核黃素對小鼠心肌組織中SCAD免疫熒光的影響如Fig 6所示,與Sham組相比,TAC組小鼠心肌組織SCAD免疫熒光明顯減弱,SCAD表達明顯下調(P<0.01);與TAC組相比,TAC+Riboflavin組小鼠心肌組織SCAD免疫熒光明顯增強,SCAD表達明顯上調(P<0.01),與SCAD的mRNA及酶活性水平變化一致。

Fig 6 SCAD immunofluorescence staining in myocardial tissues of mice in each group n=6)
2.7 核黃素對小鼠心肌能量代謝的影響如Fig 7A、B所示,與Sham組相比,TAC組小鼠心肌線粒體膜電位明顯下降(P<0.01),膜腫脹程度明顯增加(P<0.01);與TAC組相比,TAC+Riboflavin組小鼠心肌線粒體膜電位顯著上升(P<0.01),膜腫脹程度明顯減少(P<0.01)。表明TAC組小鼠心肌線粒體功能障礙,核黃素干預后小鼠心肌線粒體功能得到明顯改善。如Fig 7C所示,與Sham組相比,TAC組心肌組織中ATP含量明顯減少(P<0.01);與TAC組相比,TAC+Riboflavin組心肌組織中ATP含量明顯增加(P<0.01)。與Sham組相比,TAC組心肌以及血清中的游離脂肪酸含量均明顯增加(P<0.01);與TAC組比,TAC+Riboflavin組心肌以及血清中的游離脂肪酸含量均明顯減少(P<0.01)。表明核黃素可能通過激活SCAD,改善心肌能量代謝,從而抑制小鼠心力衰竭。
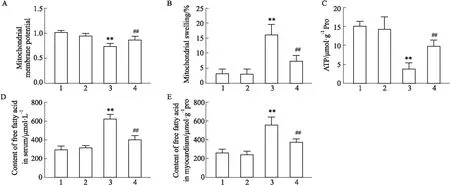
Fig 7 Changes of cardiac mitochondrial membrane potential and membrane swelling, myocardial tissue ATP, and free fatty acids in tissues and serum in each group of mice n=6)
3 討論
心力衰竭最基本的表現為心肌收縮舒張功能障礙,供血能力降低,不能滿足機體正常活動需要。心肌能量代謝障礙與心力衰竭發生密切相關。生理狀態下,心肌中線粒體脂肪酸β氧化提供70%能量供應。在心力衰竭情況下,心肌代謝方式由脂肪酸β氧化轉變成葡萄糖氧化,此時,脂肪酸大量積累,其氧化能力減弱,而葡萄糖氧化產生的能量卻不足以供應心肌正常能量需要[13]。
SCAD是脂肪酸β氧化限速酶,也是黃素蛋白之一,在心肌能量代謝中發揮重要作用。我們前期研究顯示,SCAD對心力衰竭具有負性調控作用。FAD為核黃素在體內代謝的產物,是體內多種黃素蛋白參與氧化還原反應的輔助因子,而FAD可調節SCAD的基因表達[14]。核黃素作為FAD的前體,在體內可轉化成FAD。臨床上,核黃素主要用于防治口、眼和外生殖器部位的炎癥如口角炎、眼結膜炎和陰囊炎等核黃素缺乏病。近年來,研究發現核黃素與許多新的臨床疾病相關,如秋季腹瀉、燒傷以及心血管疾病等[15]。其中心力衰竭與核黃素的關系近年來似乎得到研究者的青睞。相關研究表明,大多數心衰病人存在微量營養素缺乏癥,而且心衰病人比普通人群更易患有B族維生素缺乏癥[16]。核黃素作為B族維生素之一,參與機體大量的能量代謝過程,同時也是心衰病人的營養補充劑。缺乏B族維生素可能是心衰病人心肌能量供應不足的原因之一,給予心衰病人適當補充B族維生素有利于改善患者心肌能量代謝[17]。因此,本研究進一步探索核黃素對壓力超負荷誘導小鼠心力衰竭的作用及其作用機制。
本研究發現,在TAC誘導壓力超負荷導致心力衰竭病理狀態下,TAC組小鼠出現了明顯的心肌收縮舒張功能以及線粒體功能障礙,線粒體膜電位減少,膜腫脹程度增加,心肌細胞出現大量凋亡。核黃素治療后小鼠的心肌收縮舒張功能以及線粒體功能均得到明顯改善,心肌細胞凋亡數明顯減少,表明核黃素能有效延緩心力衰竭的病理進程。TAC組小鼠心肌中FAD含量明顯降低,ATP含量明顯減少,心肌和血清中游離脂肪酸含量明顯增加, SCAD表達明顯減少、酶活性降低,表明壓力超負荷小鼠出現了明顯的心肌能量代謝障礙。經核黃素治療后,小鼠心肌中FAD含量明顯增加、SCAD酶活性及ATP含量顯著增加,游離脂肪酸含量明顯減少,表明核黃素能顯著改善TAC誘導壓力超負荷小鼠的心肌能量代謝障礙。
已有研究表明,核黃素可通過提高血紅素氧合酶-1蛋白表達和超氧化物歧化酶活性,從而降低心肌氧化應激,減輕大鼠經單次注射鏈脲佐菌素誘發Ⅰ型糖尿病的心力衰竭,顯著改善左心室收縮舒張功能[11]。此外,有學者采用冠狀動脈左前降支結扎術建立小鼠急性心肌梗死后心力衰竭模型,證實核黃素能減輕小鼠心肌梗死模型的心肌損傷[12],這一作用是通過激活賴氨酸特異性脫甲基酶1的活性、調節相關磷脂代謝基因的表達來實現。本研究采用TAC術模擬長期壓力超負荷誘導的心力衰竭,觀察到核黃素對慢性心力衰竭具有相似的保護作用,且從心肌能量代謝新視角闡明了核黃素通過提高FAD含量、激活SCAD,促進線粒體脂肪酸β氧化反應,改善心肌能量代謝,抑制心肌細胞凋亡發揮作用,這可能是核黃素具有心臟保護作用的關鍵機制之一。以上研究結果為核黃素在臨床上用于防治心力衰竭提供了實驗基礎和理論依據,具有十分重要的臨床意義。然而,本研究由于樣本量相對較少,得出的初步結果還有待于進一步驗證。此外,有關核黃素通過激活SCAD抑制小鼠心力衰竭的分子機制,尚需進一步深入研究。

