腹腔熱灌注化療對進展期胃癌療效的臨床研究
趙磊 王玉彬
[摘要] 目的 研究腹腔熱灌注化療治療進展期胃癌的臨床效果。方法 回顧性分析2016年9月至2020年9月在錦州醫科大學附屬第一醫院接受手術治療的進展期胃癌患者80例。根據治療方式的不同分為試驗組和對照組,其中試驗組接受腹腔鏡下D2根治術+腹腔熱灌注化療+全身靜脈化療共50例,對照組接受腹腔鏡下D2根治術+全身靜脈化療共30例。比較兩組的治療效果及不良反應發生情況。 結果 治療后,試驗組患者的CD3+、CD4+和CD4+/CD8+水平高于對照組及治療前(P<0.05),CD8+水平低于對照組及治療前(P<0.05)。試驗組的總有效率為90.00%,明顯高于對照組的73.33%,差異有統計學意義(P<0.05)。術后3年試驗組的功能評分、整體生活質量評分、單項測量項目評分均高于對照組(P<0.05),癥狀評分低于對照組(P<0.05)。 兩組患者術后不良反應及并發癥總發生率比較,差異無統計學意義(P>0.05)。試驗組3年無進展生存率高于對照組(P<0.05),局部復發和遠處轉移率低于對照組(P<0.05)。結論 腹腔熱灌注化療治療進展期胃癌較為安全有效。
[關鍵詞] 進展期胃癌;腹腔熱灌注化療;化療;腹腔鏡
[中圖分類號] R735.2? ? ? ? ? [文獻標識碼] B? ? ? ? ? [文章編號] 1673-9701(2022)11-0099-05
[Abstract] Objective To study the clinical efficacy of hyperthermic intraperitoneal chemotherapy in the treatment of advanced gastric cancer. Methods A retrospective analysis of 80 patients with advanced gastric cancer underwent surgery in our hospital from September 2016 to September 2020 was conducted. According to the different treatment methods,they were divided into the experimental group with 50 patients received laparoscopic radical D2+intraperitoneal hyperthermic chemotherapy + systemic intravenous chemotherapy,and the control group with 30 patients received laparoscopic radical D2 + systemic intravenous chemotherapy. The efficacy and occurrence of adverse events were compared between the two groups. Results After treatment, the levels of CD3+, CD4+ and CD4+/CD8+ in the experimental group were higher than those in the control group and before treatment(P<0.05), The level of CD8+ in the experimental group was lower than that in the control group and before treatment(P<0.05). The total effective rate in the experimental group was 90.00%, which was higher than that of 73.33% in the control group, with significant difference(P<0.05).Three years after operation, the scores of function, overall quality of life , individual measurement item in the experimental group were higher than those in the control group(P<0.05), the symptom score was lower than that in the control group(P<0.05).There was no significant difference of incidence of postoperative adverse reactions and complications?between the two groups(P>0.05).Three year progression-free survival rate in the experimental group was higher than that in the control group(P<0.05), the rates of local recurrence and distant metastasis were lower than that in the control group(P<0.05). Conclusion The intraperitoneal hyperthermic chemotherapy is safe and effective in the treatment of advanced gastric cancer.40DC3F6B-C66E-4942-BF89-9BA2D2FB7293
[Key words] Advanced gastric cancer; Hyperthermic intraperitoneal chemotherapy; Chemotherapy; Laparoscopic
胃癌(gastric carcinoma,GC)是臨床常見的惡性腫瘤,其居于第5位的高發病率及居于第4位的高病死率使許多胃癌患者談癌色變[1]。手術、放化療、分子靶向治療等被認為是GC的有效治療方法,但復發率較高。腹腔熱灌注化療(hyperthermic intraperitoneal che- motherapy, HIPEC)可有效殺滅腹腔內癌細胞,防止轉移擴散,且不會引起術后嚴重并發癥和不良反應,其治療效果得到許多學者和臨床醫生的肯定[2]。一些研究發現,化療會在一定程度上影響免疫細胞的數量,如CD3+、CD4+、CD8+等免疫細胞與患者的生存、預后等密切相關[3-5]。CD4+/CD8+比值下降代表患者免疫功能降低[6]。本文回顧性分析80例進展期胃癌患者T淋巴細胞亞群的免疫分子在接受不同治療方式及治療前后的變化,為進展期胃癌的治療提供幫助,現報道如下。
1 資料與方法
1.1 一般資料
收集2016年9月至2020年9月間在錦州醫科大學附屬第一醫院辦理入院的進展期胃癌患者80例的臨床資料,均經醫院醫學倫理會審核及患者知情同意后納入本研究。根據治療方式的不同分為試驗組和對照組,其中試驗組接受腹腔鏡下D2根治術+腹腔熱灌注化療+全身靜脈化療共50例,對照組接受腹腔鏡下D2根治術+全身靜脈化療共30例。納入標準:①術后經病理學診斷為腺癌,分期為Ⅱ~Ⅲ期;②嚴格按照《腹腔鏡胃癌手術操作指南》(2016版)[7]由同一醫師團隊行腹腔鏡下胃癌D2根治術,淋巴結清掃數目≥15枚;③既往無手術史,肝腎功、心肺功能及免疫功能等無明顯異常;④臨床資料完整,并積極配合隨訪。排除標準:①伴有遠處轉移的晚期胃癌者;②術前接受過新輔助放化療、內分泌治療及各種免疫治療者;③術中中轉開腹、術后因各種原因二次手術、行姑息手術、聯合脾臟或胰腺等其他臟器切除者。
1.2 方法
1.2.1 試驗組? ?腹腔鏡下胃癌D2根治術畢,術中從左右膈下、左右盆腔放置4根引流管供灌注用。將順鉑(江蘇豪森藥業集團有限公司,規格:30 mg /瓶,國藥準字H20040812)2瓶共60 mg/m2與0.9%氯化鈉溶液3000 ml充分混合,倒入灌注機的專用袋。將設備提前啟動預熱(BR-TRG1型系統,廣州保瑞醫療技術有限公司),設定溫度43℃、速度 400~600 ml/min、時間60 min。此期間由手術醫師及麻醉師密切監測患者的生命體征及灌注液的顏色變化。術后在患者病情和各項體征平穩的情況下分別于術后第1、3天在局部麻醉下行第2、3次灌注化療,藥物及劑量與首次相同。灌注過程中在醫護人員在場的情況下予心電監護、吸氧等監護措施,同時肌內注射地佐辛5 mg(揚子江藥業集團有限公司,規格:5 mg/瓶,國藥準字YBH06-342 018)+鹽酸異丙嗪 25 mg(上海禾豐制藥有限公司,規格:25 mg/瓶,國藥準字H31021490)止痛、鎮靜。
1.2.2 對照組? 由同一手術醫師行腹腔鏡下胃癌根治術畢僅以0.9%氯化鈉注射液3000 ml術中進行腹腔沖洗。兩組患者均于術后第21~28天內接受XELOX 的全身靜脈化療方案。具體方案為:奧沙利鉑(江蘇恒瑞醫藥股份有限公司,規格:50 mg/瓶,國藥準字H20050962)130 mg/m2,于化療第1天靜脈滴注2 h。卡培他濱(上海羅氏制藥有限公司,規格:0.5 g/片,國藥準字H20073023)1000 mg/m2,于化療的第1~14天早晚各一次口服。每次化療間隔21d,共重復6個療程。分別采集兩組患者手術當天及灌注結束后靜脈化療前的空腹靜脈血,采用流式細胞術檢測兩組患者治療前后的CD3+、CD4+、CD8+水平,計算CD4+/CD8+比值,檢測方法參見文獻[8]。
1.3 觀察指標及評價標準
①記錄兩組患者一般資料,包括性別、年齡、體質量指數、病理分級(高分化腺癌、中分化腺癌、低分化腺癌)、浸潤深度(T3、T4)、腫瘤部位(胃底賁門、胃體、胃竇幽門)、脈管癌栓(有、無)、手術方式(近端胃癌根治術、遠端胃癌根治術、全胃切除術)、腫瘤大小(>5 cm、≤5 cm)及pTNM分期(Ⅱ期、Ⅲ期)。②免疫功能。采用CD3+、CD4+、CD8+水平及CD4+/CD8+比值評定。③生活質量評價。根據歐洲癌癥治療研究組織研制的 EORTC 生活質量測定量表(quality of life scale of European Organization for Research and Treatment of Cancer,EORTC QLQ-C30),評分標準參考文獻[9],具體包括功能評分、整體生活質量評分、單項測量項目評分和癥狀評分,分數越高提示癥狀越輕,即術后生活質量越好。④療效評價標準。依據WHO實體瘤療效判定標準[10],具體包括完全緩解(CR)、部分緩解(PR)、穩定(SD)和進展(PD),總有效率=(CR+PR)例數/總例數×100%。⑤安全性評價。以術后并發癥及不良反應發生率作為評價安全性的指標。⑥遠期預后。以患者術后3年腫瘤局部復發、遠處轉移及生存率作為評價指標。通過門診和電話方式隨訪,定期復查腫瘤標志物、胸片、CT、電子消化道鏡、MRI,填寫生活質量測定量表等。本研究隨訪時間終點為2020年9月,為期共3年。
1.4 統計學分析
采用SPSS 22.0統計學軟件對數據進行統計分析,計量資料以均數±標準差(x±s)表示,組間比較采用t檢驗;計數資料以[n(%)]表示,組間比較采用χ2檢驗;采用 Kaplan-Meier 法繪制生存曲線,以Log-rank 檢驗比較生存情況;P<0.05為差異有統計學意義。40DC3F6B-C66E-4942-BF89-9BA2D2FB7293
2 結果
2.1 兩組患者一般資料比較
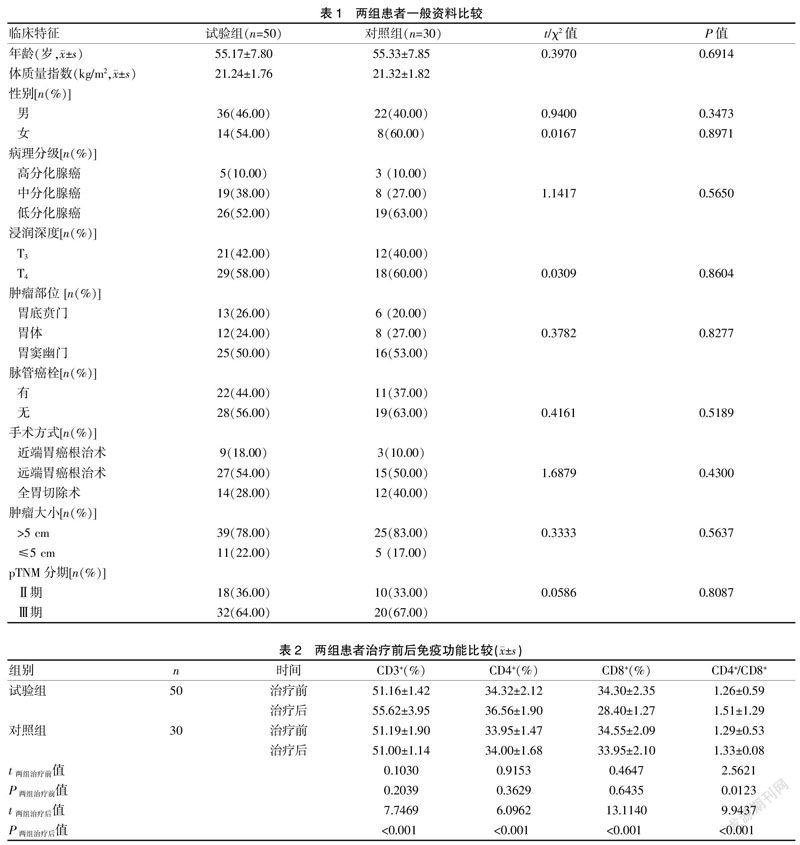
兩組患者的一般資料比較,差異無統計學意義(P>0.05),具有可比性。見表1。
2.2兩組患者治療前后免疫功能比較
治療后,試驗組患者的CD3+、CD4+和CD4+/CD8+水平高于對照組及本組治療前(P<0.05),CD8+水平低于對照組及治療前(P<0.05)。見表2。
2.3兩組患者臨床療效比較
試驗組的總有效率為90.00%,明顯高于對照組的73.33%,差異有統計學意義(P<0.05)。見表3。
2.4 兩組患者治療后QLQ-C30 評分比較
術后3年試驗組的功能評分、整體生活質量評分和單項測量項目評分均高于對照組(P<0.05),癥狀評分低于對照組(P<0.05)。見表4。
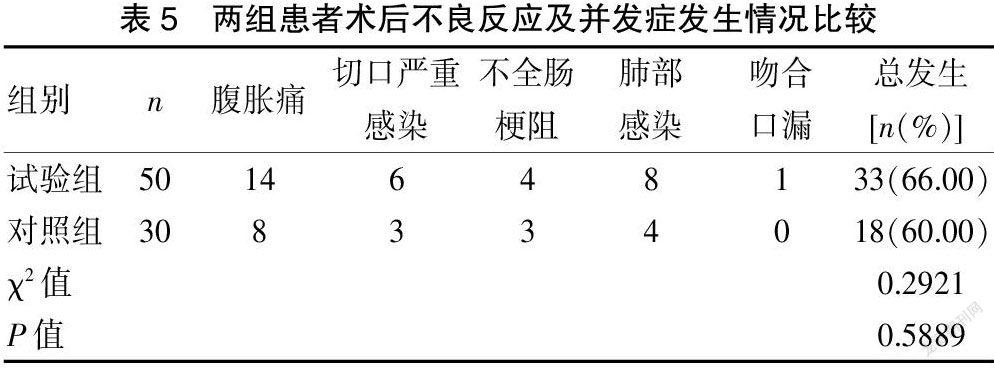
2.5兩組患者術后不良反應及并發癥發生情況比較
兩組患者術后均出現不同程度的不良反應及并發癥,組間比較差異無統計學意義(P>0.05)。見表5。
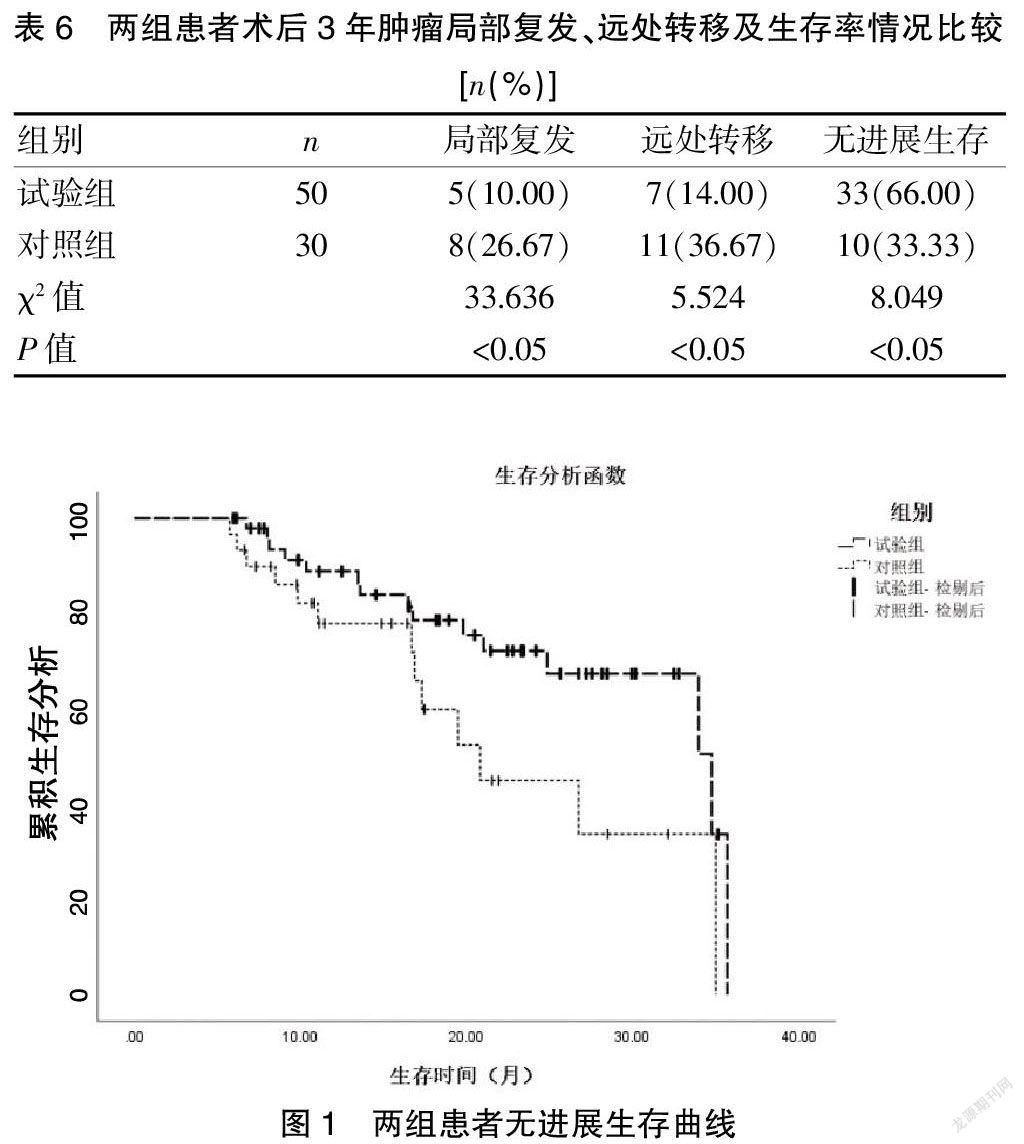
2.6兩組患者術后3年腫瘤局部復發、遠處轉移及無進展生存率情況比較
試驗組患者術后3年無進展生存率高于對照組(P<0.05),局部復發和遠處轉移率低于對照組(P<0.05)。見表 6、圖 1。
3 討論
以往手術被認為是治療胃癌的最佳療法,但其術后較高的復發率和較低的遠期生存率使得治療效果不盡人意,雖然術后化療及部分分子靶向治療可有效改善預后,但其術后較高的不良反應和并發癥使患者的生活質量大幅下降。隨著近年來外科手術醫師水平的提高、醫療器械領域的進步革新、放化療方案的不斷完善,患者的預后及遠期生存率大幅度提升。
化療主要有全身靜脈化療和腹腔灌注化療兩種方式。 XELOX和SOX方案被日本ACTS -GC和韓國CLASSIC確定為臨床一級化療方案[11-12],其作用機制是通過靜脈給藥發揮治療作用。單純采用靜脈化療,藥物經靜脈到達肝臟、腎臟代謝后被排出體外,其作用時間較短、腹腔內濃度低。
近年來HIPEC已成為許多學者的研究熱點,目前在伴腹膜轉移的多種惡性腫瘤的治療中取得良好的效果。其機制主要有以下幾點:①利用灌注液沖刷患者腹腔內殘存的癌細胞,使其稀釋并隨著沖洗液排出體外,降低復發轉移率[13]。②熱效應使膜蛋白變性,細胞內釋放大量溶菌酶,可直接分解殺滅癌細胞[14]。③在43 ℃時膜通透性增加,利于藥物滲透[15]。滲透入血的化療藥物最終回流到門靜脈,殺滅已經入肝的癌灶。④高溫刺激細胞合成熱休克蛋白,激活免疫系統,直接殺滅腫瘤細胞[16]。隨著科技的進步,HIPEC相關設備及各項技術參數大幅提升,HIPEC的優越性得到越來越多臨床醫生的關注,促進其推廣和應用。
Gill等[17]學者對HIPEC的有效性及安全性進行系統性的回顧分析,結果顯示HIPEC治療進展期胃癌患者的中位生存時間為15個月,1年生存率為 43%(22%~68%)。盡管目前該治療方式、理念、相關技術在不斷革新,但對HIPEC的安全性仍有諸多爭議。一旦發生嚴重并發癥,會增加再次入院率,還可能影響到患者的遠期生存率[12]。國際上關于HIPEC仍沒有統一的治療標準,國內許多醫療單位設備比較落后、控溫精度差、安全系數低,使得HIPEC尚未被部分臨床醫生接受。隨著科技水平的提升,近年來HIPEC在性能和安全性方面有了明顯提升。
本研究結果顯示,治療后試驗組無論是免疫細胞水平、近期生活質量評分,還是3年生存率均高于對照組,而局部復發率、遠處轉移率均低于對照組(P<0.05),說明HIPEC可有效刺激免疫系統,利于疾病的恢復,且不會增加各類不良反應和并發癥的發生。與Satake 等[18]學者的研究結果相似。標準輔助化療聯合HIPEC可有效提高自身對腫瘤的殺傷力,增強免疫力。本研究隨訪過程中發現,試驗組患者出院后的身體和心理狀態均較對照組患者好,這種現象可歸因于聯合治療能更好地消滅腹腔內殘余的腫瘤細胞,腹腔內殘存的癌細胞被殺滅會緩解患者的臨床癥狀,因此試驗組的術后生活質量較對照組更高。
綜上所述,進展期胃癌患者接受根治術聯合HIPEC可提高其免疫功能、生存質量和3年無進展生存率,沒有出現臨床醫師所擔心的嚴重不良后果,較為安全。
[參考文獻]
[1]? ?Sung H,Ferlay J,Siegel RL,et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2021,71(3):209-249.
[2]? ?中國抗癌協會腹膜腫瘤專業委員會,廣東省抗癌協會腫瘤熱療專業委員會. 中國腹腔熱灌注化療技術臨床應用專家共識(2019版)[J].中華醫學雜志,2020,100(2):89-96.
[3]? ?Baggio L,Laureano áM,Silla LMDR,et al. Natural killer cell adoptive immunotherapy: Coming of age[J].Clin Immunol,2017,177:3-11.
[4]? ?Mi D, Ren W,Yang K. Adoptive immunotherapy with interleukin-2 & induced killer cells in non-small cell lung cancer:A systematic review & meta-analysis[J].The Indian Journal of Medical Research,2016,143(Suppl.):1-10.40DC3F6B-C66E-4942-BF89-9BA2D2FB7293
[5]? ?Berruti A,Amoroso V,Gallo F,et al. Pathologic complete response as a potential surrogate for the clinical outcome in patients with breast cancer after neoadjuvant therapy:A meta-regression of 29 randomized prospective studies[J].Journal of Clinical Oncology Official Journal of the American Society of Clinical Oncology,2014,32(34):3883-3891.
[6]? ?張全超,孫學軍. 腹腔鏡手術對進展期胃癌患者圍術期免疫功能及血凝狀態的影響[J].中國腫瘤臨床與康復,2018,25(11):99-102.
[7]? ?中華醫學會外科學分會腹腔鏡與內鏡外科學組,中國研究型醫院學會機器人與腹腔鏡外科專業委員會. 腹腔鏡胃癌手術操作指南(2016版)[J].中華消化外科雜志,2016,15(9):851-857.
[8]? ?孔小麗,陳思,陳瑋琳,等. 免疫細胞分離鑒定綜合實驗設計[J].實驗室研究與探索,2021,(1):218-220,284.
[9]? ?萬崇華,陳明清,張燦珍,等. 癌癥患者生命質量測定量表EORTC QLQ-C30中文版評介[J].實用腫瘤雜志,2005,20(4):353-355.
[10]? Therasse P,Arbuck SG,Eisenhauer EA,et al. New guidelines to evaluate the response to treatment in solid tumors[J].Breast Cancer,2000,12(3):S16-S27.
[11]? Luo HY,Xu RH, Wang F,et al. Phase II trial of XELOX as first-line treatment for patients with advanced gastric cancer[J].Chemotherapy,2010,56(2):94-100.
[12]? Oh SY,Kwon HC,Jeong SH,et al. A phase II study of S-1 and oxaliplatin (SOx) combination chemotherapy as a first-line therapy for patients with advanced gastric cancer[J].Invest New Drugs,2012,30(1):350-356.
[13]? Brandl A,Yonemura Y,Glehen O,et al. Long term survival in patients with peritoneal metastasised gastric cancer treated with cytoreductive surgery and HIPEC:A multiinstitutional cohort from PSOGI[J].European Journal of Surgical Oncology,2020,47(1):172-180.
[14]? Facchiano E,Scaringi S,Kianmanesh R,et al. Laparoscopic hyperthermic intraperitoneal chemotherapy (HIPEC) for the treatment of malignant ascites secondary to unresectable peritoneal carcinomatosis from advanced gastric cancer[J].Eur J Surg Oncol,2008,34(2):154-158.
[15]? Roviello F,Caruso S, Neri A,et al. Treatment and prevention of peritoneal carcinomatosis from gastric cancer by cytoreductive surgery and hyperthermic intraperitoneal chemotherapy:Overview and rationale[J].European Journal of Surgical Oncology the Journal of the European Society of Surgical Oncology & the British Association of Surgical Oncology,2013,39(12):1309-1316.
[16]? González-Moreno S,González-Bayón LA,Ortega-Pérez G. Hyperthermic intraperitoneal chemotherapy:Rationale and technique[J].World Journal of Gastrointestinal Onco-logy,2010,2(2):68.
[17]? Gill RS,Al-Adra DP,Nagendran J,et al. Treatment of gastric cancer with peritoneal carcinomatosis by cytore-ductive surgery and HIPEC:A systematic review of survival,mortality and morbidity[J].Journal of Surgical Oncology,2011,104(6):692-698.
[18]? Satake H,Kondo M, Mizumoto M,et al. Phase I study of neoadjuvant chemotherapy with capecitabine and oxali-platin for locally advanced gastric cancer[J].Anticancer Research,2017,37(7):3703.
(收稿日期:2021-07-06)40DC3F6B-C66E-4942-BF89-9BA2D2FB7293

