鞣酸對異丙腎上腺素誘導小鼠心肌肥厚的抑制作用*
厲博文,屈鑫亮,司明東,李菁,馬東來,2
(1.河北中醫學院藥學院,石家莊 050200;2.河北省中藥組方制劑技術創新中心,石家莊 050091)
藥理研究表明,多種心血管疾病,如心肌梗死、心肌病、高血壓等均表現出心肌肥厚的特征[1]。心肌肥厚是心臟代償功能改變發生的心肌形態結構變化,其病理生理過程涉及許多生物因子,包括氧化應激的增加、神經激素的過度激活、炎癥因子的增加和非選擇性β-腎上腺素受體(β-AR)激活等。其中,非選擇性β-AR激活是形成心肌肥厚的重要因素之一[2]。動物實驗研究表明,持續使用β-AR激動劑異丙腎上腺素(isoproterenol,ISO)可誘發心臟炎癥和心肌細胞肥厚[3-4]。實驗動物皮下注射ISO,可快速形成心肌肥厚的病理特征,模擬心血管疾病早期階段的病理狀態。而長期病理性心肌肥厚可導致細胞間肌纖維和血管周圍纖維化[5]。心肌纖維化常為心血管系統疾病終末期的病理表現,可導致心力衰竭、心律失常及心源性猝死等[6]。Toll樣受體(Toll-like receptor 4,TLR4)是與心血管疾病的發生和發展密切相關,核轉錄因子(NF-κB)為引起心肌肥厚的刺激因子之一[7],兩者間存在著緊密聯系,王紀文等[8]發現在鼠肥厚的左室心肌細胞中,TLR4與NF-κB表達同時增高,當抑制NF-κB表達時,TLR4的表達降低。鞣酸(tannic acid,TA)是一類來源植物的水溶性多酚類化合物,廣泛分布于谷物、水果、中藥、茶葉和紅酒等[9],具有抗脂過氧化、抗炎、抗腫瘤等藥理活性[10-11]。前期實驗[12]曾采用蘇木精-伊紅(HE)染色、免疫組織化學法、免疫印跡法(Western blotting,WB)技術等測定TA對ISO誘導小鼠心肌纖維化的作用機制,發現TA可以降低ISO誘導的小鼠心肌細胞中TLR4、p38、NF-kB (p65)蛋白的表達水平。目前文獻多數報道TA對心肌損傷的保護作用[13],然而對TA抑制心肌肥厚的文獻報道較少。因此,筆者在本實驗旨在探討TA是否通過TLR4/NF-κB信號通路減輕ISO誘導的小鼠心肌肥厚癥狀,為TA臨床應用提供實驗依據,為心血管疾病早期階段病理性心肌肥厚的有效防治提供藥物來源。
1 材料與方法
1.1實驗動物 50只雄性昆明種小鼠,體質量20~22 g,由河北醫科大學實驗動物學部提供,于河北中醫學院實驗動物中心清潔級動物實驗室飼養,實驗動物生產許可證號:SCXK(冀)2018-004,實驗動物使用許可證號:SYXK(冀)2017-005。小鼠飼養環境條件:室溫(22~24 ℃)、相對濕度40%~70%,明暗交替為12 h,自由飲水攝食。
1.2藥品與試劑 TA(Sigma-Aldrich公司,批號:V900190-100G,含量>98%);ISO(Cayman Chemicals公司,批號:I0600000,含量>99%);普萘洛爾(Afar Sally公司,批號:H26645,含量>98.5%);蘇木精(Solarbio公司,批號:H8070);山羊血清(Solarbio公司,批號:SL038);DAB顯色液(Solarbio公司,批號:DA1010);TLR4(ABclonal公司,批號:A5258);NF-κB p65(Wanleibio公司,批號:WL01980);HRP標記山羊抗兔IgG(thermo Fisher公司,批號:#31460);二甲苯、過氧化氫、無水乙醇曙紅Y(醇溶)等均為國產分析純。
1.3儀器 RM2235型石蠟切片機(Leica公司);DP73型顯微鏡拍照系統(OLUMPUS公司);QH01-9030A型電熱恒溫鼓風干燥箱(上海精宏實驗設備公司);DH36001B型電熱恒溫培養箱(天津泰斯特公司);Chemi Doc Touch化學發光凝膠成像系統(Bio-Rad公司)。
1.4實驗分組與給藥 50只昆明小鼠按照隨機數字表法分為5組,分別為空白對照組、模型對照組、普萘洛爾組、TA小劑量組和TA大劑量組,每組10只。參照文獻[14-15]方法,將ISO和TA分別溶于無菌0.9%氯化鈉溶液中,除空白對照組外,其他組每天皮下注射ISO10 mg·kg-1,空白對照組則每天皮下注射相同體積無菌0.9%氯化鈉溶液;普萘洛爾組每天腹腔注射普萘洛爾10 mg·kg-1·d-1,TA小劑量組和TA大劑量組每天分別腹腔注射20,40 mg·kg-1·d-1TA溶液,空白對照組和模型對照組每天分別腹腔注射相同體積無菌0.9%氯化鈉溶液,連續給藥14 d。每天稱取質量,并計算體質量增加情況。
1.5取材與心臟質量指數(HMI)測定 給藥結束后,停止給予飼料,自由飲水12 h。記錄小鼠體質量(BW),小鼠腹腔注射0.5%戊巴比妥鈉45 mg·kg-1,在室溫下眼眶收集血液,在3000 r·min-1(r=10 cm)條件下離心,取上層血漿保存于-20 ℃冰箱。操作時將心臟快速分離,并用冰0.9%氯化鈉溶液清洗,去除多余組織,然后,用濾紙吸干表面水分,測定心臟質量(HW),保存于-80 ℃冰箱或用10%多聚甲醛進行固定,待用。計算HMI[16],HMI=HW/BW。
1.6TTC染色觀察心肌梗死面積(myocardial infarction size,MIS) 以TTC染色的方法測定MIS,先將小鼠心臟分離,用0.9%氯化鈉溶液沖洗,去除心房和右心室,置于-20 ℃的冰箱中,20 min后取出,沿房室溝的平行方向,將左心室切成厚度約0.2 mm的組織切片,得切片5片,置于37 ℃條件下0.2%TTC磷酸緩沖液(pH為7.4)中,水浴加熱20 min后,以0.9%氯化鈉溶液沖洗,去除切片表面TTC磷酸緩沖液,再置于4%甲醛溶液中,固定24 h,增強染色效果。最后,染色切片攝像,應用BI-2000圖像分析儀計算MIS占心肌片總面積的百分比。MIS百分比(%)=(MIS/心肌片總面積)×100。
1.7HE染色觀察心臟組織變化 將小鼠心臟從多聚甲醛固定液中取出,依次經過乙醇梯度脫水、石蠟包埋后切片、切片脫蠟和二甲苯透明處理,采用常規HE染色的方法進行切片染色,在光學顯微鏡下觀察心臟組織學變化。
1.8免疫組化實驗 制備小鼠心臟石蠟切片,依次經過常規脫蠟、洗片、沖洗、修復抗原、沖洗、加過氧化氫液、沖洗、加封閉液和沖洗處理,然后分別加兔抗大鼠TLR4(1:1000)、NF-κB(p65)(1:3000),且37 ℃、40 min反應、沖洗、SABC法染色后,顯微鏡觀察染色效果。使用DP73 OLUMPUS型顯微鏡攝像系統隨機記錄5張心臟圖像,并應用Las-version 4.2病理圖像分析系統觀察發現TLR4、NF-κB(p65)的蛋白表達位置及平均吸光度值。
1.9酶聯免疫吸附測定法(ELISA)測定吸光度 按照ELISA試劑盒說明書方法,將樣品置于96孔反應板中,空白對照組、模型對照組、普萘洛爾組、TA小劑量組和TA大劑量組分別加入血清樣品50 μL,分別吸取腫瘤壞死因子-α(TNF-α)、白細胞介素(IL)-6和IL-1β抗體10 μL,加入96孔反應板中,依次經過孵育、洗板、顯色液顯色等操作,于波長450 nm處,應用全自動酶標儀測定吸光度,并計算樣品濃度。
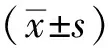
2 結果
2.1HMI的測定結果 空白對照組HMI值為(4.92±0.09) mg·g-1,模型對照組HMI值為(5.99±0.33) mg·g-1,普萘洛爾組HMI值為(5.51±0.38) mg·g-1,TA小劑量組HMI值為(5.91±0.22) mg·g-1,TA大劑量組HMI值為(5.83±0.33) mg·g-1。模型對照組HMI值顯著高于空白對照組(P<0.01),表明已建立小鼠心肌肥厚的模型。與模型對照組比較,TA大劑量組和TA小劑量組HMI值雖然降低,但差異無統計學意義(t=-7.56,P>0.05),表明小、大劑量TA雖然具有一定的阻抑心肌肥厚作用,但作用效果不如普萘洛爾組顯著。
2.2TTC染色觀察心肌梗死情況 TTC染色結果見圖1。樣品均未出現明顯的心肌梗死,但從圖1中可以看出普萘洛爾組、TA小劑量組和TA大劑量組心臟組織均比模型對照組有變小趨勢。
2.3組織學觀察結果 見圖2。空白對照組小鼠心臟大小正常,心肌細胞結構清晰可見;與空白對照組比較,模型對照組心肌細胞排列紊亂,心肌細胞間隙明顯增寬,心肌纖維和細胞質出現溶解現象;與模型對照組相比,TA大劑量組和TA小劑量組心肌細胞排列趨于正常,細胞間隙變小,其中TA大劑量組變化明顯,心肌纖維排列較為整齊,心肌肥厚程度明顯改善。
2.4NF-κB(p65)和TLR4的表達 采用免疫組織化學染色法測定NF-κB(p65)(圖3)、TLR4(圖4)的蛋白水平。實驗結果顯示,與空白對照組比較,模型對照組NF-κB(p65)、TLR4蛋白水平明顯增加(P<0.01);與模型對照組比較,普萘洛爾組、TA大劑量組和TA小劑量組心肌組織中NF-κB(p65)、TLR4蛋白水平均顯著降低(P<0.01)。
2.5TNF-α、IL-6和IL-1β含量 TNF-α、IL-6和IL-1β含量結果見圖5。實驗結果顯示,與空白對照組比較,模型對照組血清中TNF-α、IL-6和IL-1β含量升高,說明心肌肥厚的形成伴有炎癥因子的激活(P<0.01);與模型對照組比較,TA大劑量組、TA小劑量組和普萘洛爾組都能夠降低心肌肥厚小鼠血清中TNF-α、IL-6和IL-1β水平,其中TA大劑量組效果優于TA小劑量組。

A.空白對照組;B.模型對照組;C.普萘洛爾組;D.TA小劑量組;E.TA大劑量組。

A.空白對照組;B.模型對照組;C.普萘洛爾組;D.TA小劑量組;E.TA大劑量組。

A.空白對照組;B.模型對照組;C.普萘洛爾組;D.TA小劑量組;E.TA大劑量組。①與空白對照組比較,t=-9.36,P<0.01;②與模型對照組比較,t=7.18,7.39,P<0.01;③與模型對照組比較,t=5.99,P<0.05。
3 討論
心肌肥厚是冠心病、心肌梗死等多種心血管疾病的共同病理過程[17],因此,尋找預防或改善心肌肥厚的藥物是防治老年心血管疾病的關鍵途徑之一。
筆者在文獻[18]小鼠心肌肥厚模型基礎上進行改良,即每天分兩次小劑量皮下注射ISO,提高小鼠的耐受力和成活率。皮下注射ISO 14 d后小鼠心臟病理學結果顯示,模型對照組小鼠心臟全心質量指數明顯升高,HE染色結果顯示心肌細胞排列紊亂,心肌細胞間隙明顯增寬。此外,本研究參考心肌肥厚患者的臨床檢測方法[19],采用免疫組織化學染色法,對實驗小鼠中NF-κB(p65)、TLR4蛋白進行定性、定位和定量的檢測[20]。免疫組化結果顯示心肌組織膠原含量明顯增加,以上實驗結果均表明ISO誘導的心肌肥厚形成。TTC染色結果顯示,注射ISO(10 mg·kg-1·d-1)在2周內小鼠已經形成心肌肥厚,但未出現心肌梗死。
TA具有抗氧化、抗炎和抗腫瘤等藥理活性,廣泛應用于醫藥、食品和保健品等領域。本實驗結果顯示,腹腔注射不同劑量TA 2周后小鼠HMI有所下降,心肌組織HE染色和免疫組化結果顯示TA能明顯改善心肌組織形態和減少膠原沉積,說明TA能夠減輕ISO誘導的心肌肥厚。

A.空白對照組;B.模型對照組;C.普萘洛爾組;D.TA小劑量組;E.TA大劑量組;①與空白對照組比較,t=-3.83,P<0.01;②與模型對照組比較,t=3.02~3.79,P<0.01。

A.空白對照組;B.模型對照組;C.普萘洛爾組;D.TA小劑量組;E.TA大劑量組。①與空白對照組比較,t=-14.10~-6.62,P<0.01;②與模型對照組比較,t=1.77~1.83,P<0.05;③與模型對照組比較,t=3.42~10.06,P<0.01。
研究表明,在機體長期處于應激狀態下,可激活TLR4,從而導致TNF-α、IL-6和IL-1β等黏附因子和炎癥介質的釋放增加。NF-κB作為心肌肥厚刺激因子的下游靶點,可以進一步誘導TNF-α、IL-6和IL-1β等炎癥因子的產生與釋放,產生的部分炎癥因子使NF-κB繼續活化,加重炎癥反應[21-22];因此TLR4和NF-κB的過度表達與心肌肥厚嚴重程度密切相關。TLR4與NF-κB之間存在密切關系,NF-κB信號通路為TLR4信號通路下游的關鍵轉錄因子[23]。它的激活與TLR4信號通路的激活有關[24]。實驗研究發現,模型對照組小鼠血清中TNF-α、IL-6和IL-1β的含量顯著增加,免疫組化顯示心肌中TLR-4和NF-κB(p65)的表達水平顯著升高,經過不同劑量TA處理后,以上檢測指標都有不同程度降低,說明TA減輕或治療心肌肥厚的作用機制可能與TLR-4/NF-κB信號通路有關。

