對某些無機物熱力學穩定性的教學研究*
江 濤,蔣遼川
(廣東第二師范學院化學系,廣東 廣州 510303)
無機化學的元素化合物部分,內容多、瑣碎繁雜,教與學都存在一定的困難。對一些無機物的熱穩定性討論,也散落在元素化合物知識的部分章節中,不成系統。將某些無機物的熱穩定性進行歸納總結,找出變化規律,分析影響因素,對教師教學、學生學習元素化合物性質大有幫助。
1 熱穩定性的量度
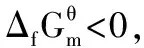
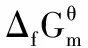
2 對一些無機物的熱穩定性討論
2.1 離子型鹵化物的熱穩定性
堿金屬、堿土金屬及若干鑭系和錒系元素,它們的電負性小,離子半徑大,形成的鹵化物主要是離子型的,它們普遍具有較高的熱穩定性。
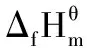
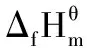
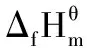
同周期其他金屬鹵化物從左到右,熱穩定性降低。
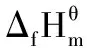
2.2 氧化物的熱穩定性
堿金屬元素的氧化物、過氧化物、超氧化物的熱穩定性不同。從 Li+→ Cs+氧化物的熱穩定性降低 ,而超氧化物的熱穩定性恰好相反。
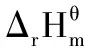
堿土金屬的氧化物過氧化物、超氧化物的熱穩定性在同族中的變化趨勢與堿金屬相同,但堿土金屬的氧化物MO比堿金屬氧化物 M2O穩定, 且在同族中變化不大, 堿土金屬與氧直接作用, 一般都生成氧化物[1]。

2.3 共價型氫化物的熱穩定性
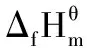
同一周期從左到右,共價型氫化物熱穩定性增強。同一主族從上到下,共價型氫化物熱穩定性減弱。
討論:共價型氫化物的熱穩定性也可由其分子的極性判斷,非金屬與氫的電負性相差越大,分子的極性越大,所生成的氫化物越穩定;反之,不穩定。這個變化規律,與非金屬電負性的變化規律一致,也與標準生成焓的變化規律基本符合,如果按照SHAB(軟硬酸堿)原則討論,結果也是一致的[3]。
2.4 無機含氧酸鹽熱穩定性
無機含氧酸鹽通常包括硝酸鹽、硫酸鹽、碳酸鹽、磷酸鹽等。影響無機含氧酸鹽熱穩定性的因素非常復雜,金屬離子的結構、半徑、電荷,酸根離子的空間構型、變形性,離子晶體的晶格能等,不僅與金屬離子的結構有關,而且與含氧酸根的結構和性質有關。對無機含氧酸鹽熱穩定性的變化規律一般可以從熱力學角度及離子極化理論解釋,也可以根據酸根離子的結構穩定性進行討論。
同種金屬離子與不同含氧酸根組成的鹽熱穩定性一般順序為:硅酸鹽,磷酸鹽 > 硫酸鹽 > 碳酸鹽 > 硝酸鹽,鹵酸鹽。
討論:酸根離子的結構穩定性主要決定于酸根的對稱性。一般認為,具有高對稱性的酸根離子,其成酸元素位于中心,完全被屏蔽,金屬離子與它的排斥作用小,其鹽熱穩定性高,熱分解溫度高。反之,含氧酸根結構不對稱,成酸離子部分被屏蔽,金屬離子與它的排斥作用大,其鹽熱穩定性較差,熱分解溫度較低[4]。
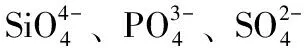

表1 部分酸根離子構型與其鹽熱穩定性

同一周期,不同金屬離子和相同含氧酸根組成的含氧酸鹽的熱穩定性一般順序為:堿金屬鹽(Li+除外)> 堿土金屬鹽 > d區、ds區和p區重金屬的鹽>銨鹽,如Na2CO3>CaCO3> ZnCO3>(NH4)2CO3。
討論:同一類含氧酸鹽的熱穩定性由金屬離子的極化能力大小決定。過渡金屬離子不是8電子穩定構型,一般來說,電荷高,半徑小,極化能力大,爭奪酸根離子中O2-能力較強,其含氧酸鹽熱穩定性較差;堿土金屬離子比堿金屬離子電荷高,半徑小,極化能力更大,所以堿土金屬含氧酸鹽熱穩定性比堿金屬含氧酸鹽熱穩定性差。
同一主族,不同金屬離子和相同含氧酸根組成的含氧酸鹽的熱穩定性一般順序為:從上到下,熱穩定性增加。如堿土金屬的硫酸鹽、碳酸鹽,自上而下,熱穩定性依次增大。
討論:對于同一主族來說,金屬離子電子構型相同,電荷相同,半徑自上而下依次增大,極化能力依次下降,酸根離子被極化而發生的變形程度依次減弱,離子鍵成分依次增加,熱穩定性依次增大。
同一成酸元素,一般來說高氧化數的含氧酸比低氧化數的含氧酸穩定,其相應含氧酸鹽的熱穩定性規律也相同。如HClO4> HClO3> HClO,KClO4> KClO3> KClO。

表2 Cl-O 鍵的性質
討論:一般來說,含氧酸分子的穩定性與分子中R-O鍵的強度和鍵的數目有關。鍵的數目越多,R-O鍵的強度越大,要斷裂這些鍵就越困難,見表2[5],在HClO4、HClO3、HClO2、HClO系列中,酸分子中R-O鍵數目依次減小,R-O鍵的鍵長增大,鍵能減小,穩定性依次減小。
同種金屬離子和同種含氧酸根組成的鹽熱穩定性順序為:正鹽> 酸式鹽> 酸。如Na2CO3(分解溫度為1800 ℃) > NaHCO3(分解溫度為270 ℃)> H2CO3(常溫分解)。
討論:根據離子極化理論,氫離子半徑比一般金屬陽離子半徑小幾個數量級,又是一個“裸核”,它對酸根離子的反極化作用非常強,破壞了酸根離子的穩定性,使R-O鍵容易斷裂,正鹽中沒有氫離子,酸中氫離子多過酸式鹽,所以熱穩定性順序為: 正鹽>酸式鹽>酸。
3 結 語