荷瘤小鼠不同時期T淋巴細胞亞群水平及臨床意義
溫軍業 張曼 范曉燕 陳旭光
T淋巴細胞(T lymphocyte)亞群的功能,在惡性腫瘤、血液系統疾病、自身免疫性疾病、感染性疾病、免疫缺陷病中發揮著積極的重要作用[1]。在多種惡性腫瘤(如乳腺惡性腫瘤、胃惡性腫瘤、肝惡性腫瘤、食管惡性腫瘤、腸道惡性腫瘤)患者的外周血或腫瘤組織中,CD4+T 細胞、CD8+T細胞、CD4+/CD8+比值與患者的腫瘤分化程度、生存及預后密切相關[2,3]。因此,研究T淋巴細胞亞群的數量、分類及功能對于了解患者是否患有惡性腫瘤、免疫疾病、功能缺陷、感染性疾病及血液系統疾病等具有重要的意義。另外,其數值及變化規律對臨床診療、病情監測和預后具有較好的臨床指導價值。然而,動態監測荷瘤小鼠不同時期T細胞的變化過程,特別是初始T細胞的變化及作用機制,這方面的研究相對較少。本研究通過使用流式細胞技術,對荷瘤小鼠不同時期脾臟T細胞亞群水平進行動態監測,其數值的變化規律,可以有效的對荷瘤小鼠進行病情監測、判斷其免疫狀態及預后。
1 材料與方法
1.1 實驗動物與分組 實驗小鼠均為C57BL/6小鼠,6~8周齡,體重18~20 g,為雌性健康小鼠,購自河北省實驗動物中心(許可證編號:SCXK冀2013-0051),飼養于河北省實驗動物中心(SPF級動物實驗室,動物飼料及墊料均經放射線照射滅菌。實驗室許可證號:SYXK(冀)2013-1-003)。飼養條件為:溫度24℃~26℃,高效過濾器每5分鐘換氣1次,濕度40%~60%,每日保持12 h光照、12 h黑暗,交替進行。選取120只健康小鼠,挑選6只正常小鼠,為無瘤組,測其無瘤狀態(Normal)的各項T淋巴細胞數值;其余小鼠隨機分成2組,每組57只,A組為荷瘤組,B組為對照組。所有分組小鼠背部毛發都用備皮刀去除,去毛面積約為4 cm2,75%乙醇消毒小鼠背部頸后區域皮膚。
1.2 藥品與試劑 黑色素瘤B16細胞由中國醫學科學院上海細胞庫提供,活細胞數至少占總細胞數的96%,培養于保濕箱中(37.0℃,5% CO2),培養液中培養(含10%滅活胎牛血清、100 U/ml 青霉素和100 μg/ml 鏈霉素的RPMI-1640)。
1.3 動物模型 (1)無瘤組,去除毛發及消毒后,不做任何注射處理。(2)A組荷瘤組,取濃度調節好的瘤細胞懸液0.2 ml接種于荷瘤組(A組)小鼠背部頸后皮下區域。(3)B組對照組,小鼠背部頸后皮下區域注射等量0.9%氯化鈉溶液。
1.4 實驗方法
1.4.1 黑色素瘤細胞液制備:將對數生長期的黑色素瘤細胞,0.25%胰蛋白酶消化后,PBS洗滌2次,濃度控制在5×106/ml。
1.4.2 黑色素瘤荷瘤小鼠模型建立:黑色素瘤荷瘤小鼠模型建立成功的條件為皮下植瘤后7~9 d,小鼠背部頸后皮下區域可及直徑約2 mm左右質硬黑色結節,不能活動,界限清楚,視為建模成功。觀察荷瘤組(A組)小鼠出瘤情況,出瘤當天(D0)從荷瘤組(A組)中,隨機選取5只用于測量繪制荷瘤曲線,剩余荷瘤組(A組)出瘤小鼠及對照組(B組)小鼠自出瘤當天(D0)開始,每隔5天隨機選出6只小鼠,分別處死、取出脾臟、流式儀行流式細胞學檢測,得到CD3+T、CD4+T、CD8+T、CD4+/CD8+、初始T細胞在脾淋巴細胞懸液中所占比例,至荷瘤組(A組)剩余小鼠中出現半數以上死亡時終止試驗觀察。
1.4.3 小鼠脾臟淋巴細胞懸液制備:將小鼠脫頸處死,乙醇浸泡5 min,逐層切開小鼠腹壁,暴露脾臟,無菌分離脾臟,將脾臟放于盛有Hank’s液的滅菌EP管中剪碎,然后準備好200目無菌不銹鋼細胞篩網,下置無菌培養皿。無菌吸管吸出剪碎的脾臟組織,置于不銹鋼細胞篩網上,玻璃無菌注射器針芯研磨,培養基沖洗收集細胞,然后添加紅細胞裂解液裂解2 min,加入0.9%氯化鈉溶液10 ml以終止裂解,Hank’s液洗滌細胞2次,1 200 r/min離心10 min,棄去上清液,用含有10%胎牛血清的RPMI-1640培養液重懸,計數。
1.4.4 流式細胞學檢測:應用FACS Calibur流式細胞儀進行脾臟淋巴細胞檢測。
2 結果
2.1 黑色素瘤B16細胞初期和中期的生長比較 在顯微鏡下觀察黑色素瘤的培養過程,細胞培養3 d后,可于無菌培養瓶底見樹突狀細胞貼與其上,呈片狀細胞團,不能活動;培養7~8 d后,細胞鋪滿瓶底,胰酶消化后細胞收縮成顆粒、球狀、可活動的細胞。見圖1。

培養3d后 培養7~8d后
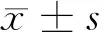
2.2 時間對小鼠腫瘤生長體積的影響 種植腫瘤前(正常),背部硫化鈉脫毛處理,以便觀察及種植;腫瘤生長階段可以分為四個階段。第一階段:D0~D9,平緩發展階段;第二階段:D9~D17緩慢增長階段;第三階段:D17~D27加速度增長階段;第四階段:D27,小鼠致死階段。荷瘤當天(D0),小鼠背部無明顯變化,小鼠背部可見直徑約2 mm黑斑狀,表面平坦、無隆起,小鼠活動無異常;荷瘤第5天(D5),小鼠背部可見黑色腫瘤突出表面,直徑3~5 mm,小鼠活動無異常;荷瘤第10天(D10),黑色腫瘤生長較快,直徑增大至約10 mm,活動略顯笨拙;荷瘤第15天(D15),腫瘤增大至15 mm,行動緩慢;荷瘤第20天(D20),腫瘤增大至25 mm,較前更加緩慢;荷瘤第25天(D25),腫瘤長徑增大至約33 mm,小鼠目光呆滯、行動極其緩慢,走路來回晃動,不平衡,精神萎靡、背部皮膚可見轉移結節,表面潰破、滲液、出血,并有血痂形成。見圖2。
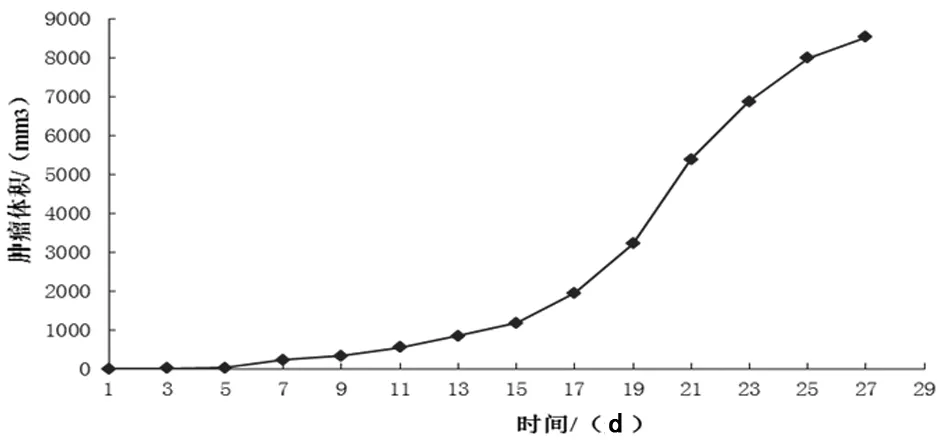
圖2 小鼠腫瘤生長曲線
2.3 時間對CD3+T、CD4+T、CD8+T及初始T細胞值的影響
2.3.1 無瘤狀態的各項指標與荷瘤組A組以及對照組B組的D0的數值幾乎接近。荷瘤組和對照組,在D5、D10、D15、D20、D25時,小鼠脾臟CD3+T、CD4+T、CD8+T、初始T細胞在脾淋巴細胞懸液中所占比例及CD4+/CD8+差異均有統計學意義(P<0.05);而D0時各指標在2組間差異無統計學意義(P>0.05)。
2.3.2 荷瘤組中, CD3+T、CD4+T、CD8+T、初始T細胞在脾淋巴細胞懸液中所占比例及CD4+/CD8+的比例在D0、D5、D10、D15、D20、D25差異均有統計學意義(P<0.05),且隨時間延長而逐漸下降。
2.3.3 對照組中,CD8+T的比例在D0、D5、D10、D15、D20、D25間無統計學差異(P>0.05);CD3+T、CD4+T、初始T細胞的比例及CD4+/CD8+在D0、D5、D10、D15間差異均無統計學意義(P>0.05),從D20開始顯著下降,差異有統計學意義(P<0.05)。
2.3.4 隨著時間的延長,D0-D25,荷瘤組和對照組,所有指標CD3+T、CD4+T、初始T細胞以及CD4+/CD8+的比值均呈下降趨勢。從D5開始,所有指標顯示,荷瘤組比對照組下降得更快。見圖3,表1、2。
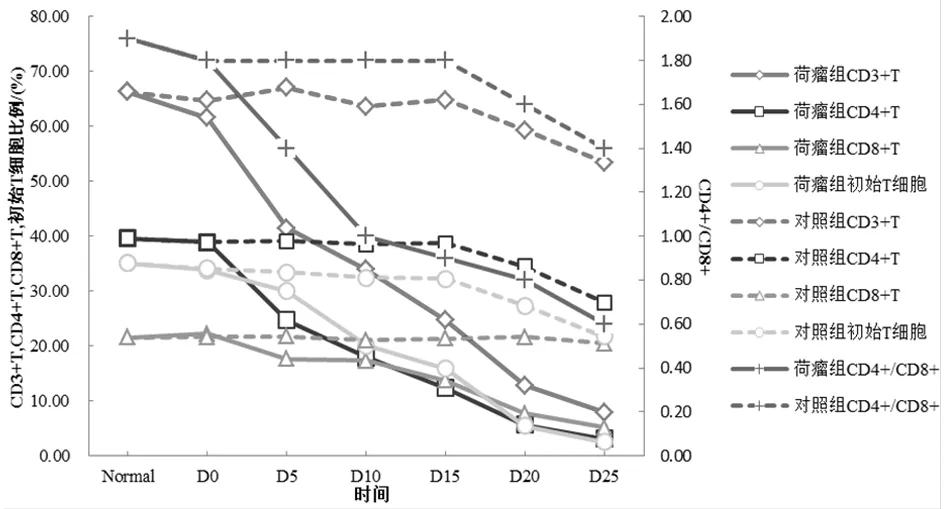
圖3 CD3+T、CD4+T、CD8+T、初始T細胞在脾淋巴細胞懸液中的比例及CD4+/CD8+數值隨時間的變化

表1 小鼠無瘤狀態(Normal)各項T淋巴細胞的數值

表2 CD3+T、CD4+T、CD8+T、初始T細胞在脾淋巴細胞懸液中所占比例(%)隨時間的變化
2.4 小鼠不同時期的流式細胞圖分析 荷瘤組(A組)中,CD4+/CD8+的比例在D0、D5、D10、D15、D20、D25之間差異均有統計學意義(P<0.05),且隨時間延長而逐漸下降;對照組(B組)中,CD4+/CD8+在D0、D5、D10、D15間差異均無統計學意義(P>0.05),從D20開始顯著下降,差異有統計學意義(P<0.05);對于荷瘤組和對照組小鼠,隨著時間的延長,從D5至D25,CD4+/CD8+的比值均呈下降趨勢,且下降幅度高于對照組,差異有統計學意義(P<0.05)。見表4,圖4。

表4 不同時期CD4+/CD8+T數值的變化
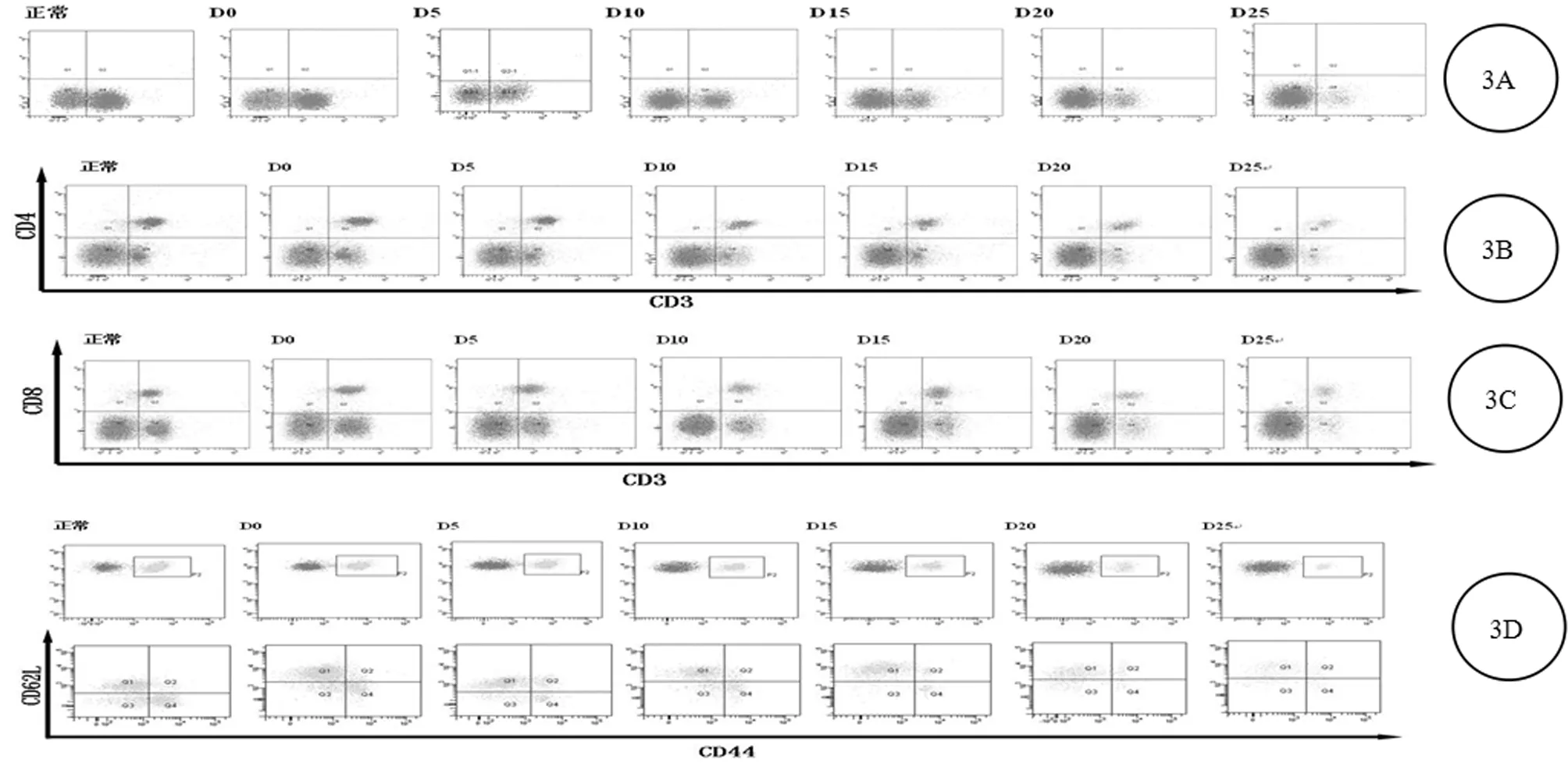
圖4 黑色素瘤小鼠不同時期的流式細胞圖;A:CD3+C;B:CD4+T;C:CD8+T;D:初始T細胞
3 討論
T細胞亞群主要包括CD4+T 細胞與 CD8+T 細胞。CD8+T是T淋巴細胞的一個亞群,活化后分化為CD8+的細胞毒性T細胞(cytotoxic T cell,CTL),輔助T細胞受體識別抗原并參與活化信號轉導,能識別腫瘤細胞,可以破壞靶細胞的膜和細胞核而起到特異性殺傷腫瘤細胞的作用,是抗腫瘤免疫的主要效應細胞。CD4+T 細胞是表達CD4抗原的T淋巴細胞,主要功能是輔助CD8陽性的T淋巴細胞,具有不同功能的細胞群,活化的 CD4+T 細胞可以分為 CD4+的輔助性T細胞和 CD4+CD25+的調節性T 細胞(T regulatory cell,Treg)。研究表明,CD4+的輔助性T細胞,如Th1、Th2 和 Th17細胞均具抗腫瘤免疫功能,可經過一系列過程可激活CTL,進一步殺傷腫瘤細胞[2,4];而CD4+CD25+Treg 細胞是一種免疫抑制細胞,最多時約占正常人CD4+T細胞的10%,能特異性抑制CD8+CTL和非特異性抑制NK細胞殺傷腫瘤細胞的作用,具有免疫抑制性和免疫無能性,降低腫瘤免疫治療的效果,起腫瘤免疫逃逸作用,促進腫瘤的發生及發展[5];CD8+T 細胞的活化部分依賴于CD4+T細胞,二者之間的平衡維持著機體正常的免疫應答。初始T細胞是已離開胸腺、但尚未受到其他抗原刺激的T淋巴細胞,它通過在血液和周圍淋巴器官(脾、淋巴結)之間的再次循環,起執行免疫監視的功能。
本研究以黑色素瘤小鼠及正常小鼠為研究對象,采用流式細胞術動態監測T淋巴細胞亞群的變化,結果表明,荷瘤組小鼠CD3+T、CD4+T細胞水平和CD4+/CD8+降低,與劉夏青等[6-8]學者研究結果一致,與Cao等[9]研究結果不一致,其中,CD4+/CD8+T值的下降提示T 細胞亞群的紊亂,機體免疫力受到損傷,免疫狀態失衡[3];荷瘤組小鼠CD8+T細胞水平降低,揭示荷瘤小鼠對腫瘤細胞的殺傷作用較差,與肖體先等[10]學者的研究結果一致;與劉夏青等[6,11,12]研究結果不一致。可能有以下結果可能:(1)機體中CD4+T的低水平導致大量CD8+T細胞沒有活化;(2)腫瘤惡性程度較高,荷瘤小鼠產生免疫耐受,導致 CD8+T 細胞表達降低[13];(3)腫瘤微環境中趨化因子水平較低,浸潤的CD8+T細胞數量下降[14]。荷瘤組小鼠初始T細胞水平降低。對于對照組,正常小鼠在前期生長過程中,T細胞亞群未發生變化,而在后期(從荷瘤第20天開始),CD3+T、CD4+T、初始T細胞的比例及CD4+/CD8+均開始顯著下降,考慮與老鼠胸腺功能下降、免疫力下降有關。
本研究發現,從D5開始,所有指標均顯示,荷瘤組比對照組下降的更快,說明病程發展較迅速,其中D5-D10階段是病程發展的轉折點,可視為臨床上加強治療和用藥的關鍵性契機。因此,監測惡性腫瘤狀態、感染性疾病、血液系統疾病、免疫系統疾病患者的免疫功能,尤其是T淋巴細胞免疫功能的狀態及功能,對疾病的判斷、療效、病情監測、預后評估等均具有積極意義,隨著分子生物學和免疫學的發展,細胞免疫治療會成為腫瘤等疾病治療研究的熱點[11,15-20]。

