秦嶺太白山不同植被帶土壤團聚體碳庫變化及溫度敏感性
王福慧,周林燕,胡 汗,王 俊,郭垚鑫,任成杰,白紅英,孫昊田,趙發珠,*
1 陜西省地表系統與環境承載力重點實驗室,西安 710127 2 西北大學城市與環境學院,西安 710127 3 西北大學生命科學學院,西安 710127 4 西北農林科技大學,楊凌 712100
森林土壤作為陸地生態系統中最大的有機碳庫(約800—1200 Pg C),占全球土壤碳庫的40%,每年向大氣中排放約40 Pg C,相當于大氣CO2存量的5%[1]。因此,即使森林SOC礦化速率產生微小的變化也會對大氣環境中CO2含量和全球的碳儲量產生深遠的影響[2]。在氣候變暖的背景下,研究人員開始關注溫度對土壤碳庫分解速率產生的影響,這是因為升溫可能會加速土壤SOC的礦化[3]。通常把SOC礦化速率對變暖的響應稱為溫度敏感性,定義為溫度升高10℃時SOC礦化速率的相對之比[4],表示為Q10。近些年來,全球范圍內開展了一些的探究Q10影響因素的研究,但是由于樣地環境因素的差異導致了一些有爭議的結論[5]。例如,周學雅的研究認為團聚體的物理保護對土壤微生物呼吸速率及Q10具有顯著性影響[6];Ghosh等人的研究則認為Q10主要受到胞外酶活性的控制[7];而Haddix等人認為不同緯度或海拔梯度造成的環境差異也會顯著影響Q10[8]。這些研究使我們提高了對Q10及其潛在影響因素的理解,但是結論的不確定性促使我們需要對Q10的影響因素進行全面綜合的研究,以揭示土壤有機碳礦化受到溫度控制的固有本質[9]。
海拔梯度的本質是在氣候梯度的差異下形成的不同的植被帶,并且在相似的海拔梯度上聚集了很多的微生物群落。全球變暖下,土壤碳庫沿海拔梯度的分解具有很多的影響因素,其中包括土壤團聚、碳庫組成差異等生物及非生物因素[10]。其中土壤團聚作用會造成團聚體粒徑差異并限制氧氣擴散、底物接觸對有機碳提供的物理保護,根據土壤團聚體粒徑的大小將其分為大團聚體、中團聚體、小團聚體[11]。土壤有機碳庫根據其周轉時間的長短將其分為活性碳庫,緩效碳庫和惰性碳庫[4]。據C quality-temperature(CQT)假設,具有較高分解能的惰性碳庫具有較高的Q10[4],這種假設的機制不僅受到土壤微生物群落和胞外酶活性的影響,還會受到海拔梯度造成的土壤團聚、土壤底物、植被類型和土壤特性等的影響,但其中的具體機制我們尚不清楚。并且,在對沿海拔梯度變化導致的升溫引起不同粒徑團聚體的Q10變化的綜合性研究很少,這降低了CQT假設的適用范圍和結論的準確性[4]。
因此,為了研究沿海拔梯度不同粒徑團聚體各碳庫的Q10的差異及其影響因素,本研究將選取太白山北坡的四個不同海拔植被帶(銳齒櫟林Quercus aliena var.acuteserrata、遼東櫟林Quercus liaotungensis、紅樺林Betula albo-sinensis、牛皮樺林Betula albo sinensisvar.septen-trionalis)的0—10 cm表層土壤[2]。在土壤處于原位溫度條件下培養的同時,并且為了保證Q10計算的準確性及便捷性,本研究將土壤樣品分別在5℃、15℃、25℃進行培養。本研究目的是:(1)確定各碳庫組分和Q10在不同粒徑團聚體之間和海拔梯度上的變化差異;(2)探討各碳庫Q10受到微生物特性的影響機制;(3)探究海拔梯度上環境因子對各碳庫Q10的潛在影響。
1 材料與方法
1.1 研究區概況與樣品采集
研究區處于陜西省秦嶺山脈中段太白山(N 33°49′—34°10′,E 107°19′—107°58′),太白山是秦嶺山脈的主山峰,也是中國西部的最高峰,年均氣溫為1.8—2.1℃,年均降雨量為800—900 mm,降雨主要集中在夏季。太白山具有極其豐富的生物多樣性、巨大的植被固碳潛力、完整的垂直植被帶梯度,可以典型代表國內森林生態系統,為展開森林碳庫分解、土壤呼吸的一系列研究提供得天獨厚的實驗平臺。本研究選取了四個沿海拔梯度分布完整、林帶明顯且樣地皆以棕壤為主的不同典型垂直植被林帶,分別是銳齒櫟林(1100—1800 m)、遼東櫟林(1800—2200 m)、紅樺林(2200—2600 m)和牛皮樺林(2600—2800 m)[12]。
本研究于2018年7月進行植物樣品采集,選擇每一個采樣點內典型代表植物為調查對象,于上述樣地內分別設置喬木層樣方(10 m×10 m)、灌木層樣方(2 m×2 m,灌木層樣方設置于每一個喬木層樣方的中心和四角,灌木層樣方數量是喬木層樣方數量的5倍)、草本層樣方(1 m×1 m,草本層樣方設置于每一個灌木層樣方的中心和四角,草本層樣方數量是灌木層樣方數量的5倍)。統計各個樣方內的喬木層、灌木層、草本層中所有植物的種類數。以上方法均是由相同的2名觀察者同時觀察與鑒定(即如果存在誤差,則所有海拔都存在相同的誤差),并記錄這些樣方中每個物種的總數。
本研究于2019年7月進行土壤采樣,在海拔1503,1915,2405,2600m處選取了地形、地貌、坡向基本相似的采樣點(采樣地的具體信息詳見表1)進行土壤、凋落物、葉片、根系的樣品采集。采樣的具體步驟為:在每個海拔的采樣地選擇3個采樣樣方(25 m×25 m),然后在每個樣方中以“S”型設立10個采樣點(1 m×1 m),先去除采樣點的棄土層,在表層土樣上蓋住厚鋁盒,使用橡膠錘將鋁盒打入土壤,接著用工兵鏟清除周圍土壤后,將厚鋁盒取出得到原狀土。運回實驗室后依照紋理將土壤掰開,剔除石塊以及其雜質等,然后過8 mm篩網,并混合同一樣地的樣品。
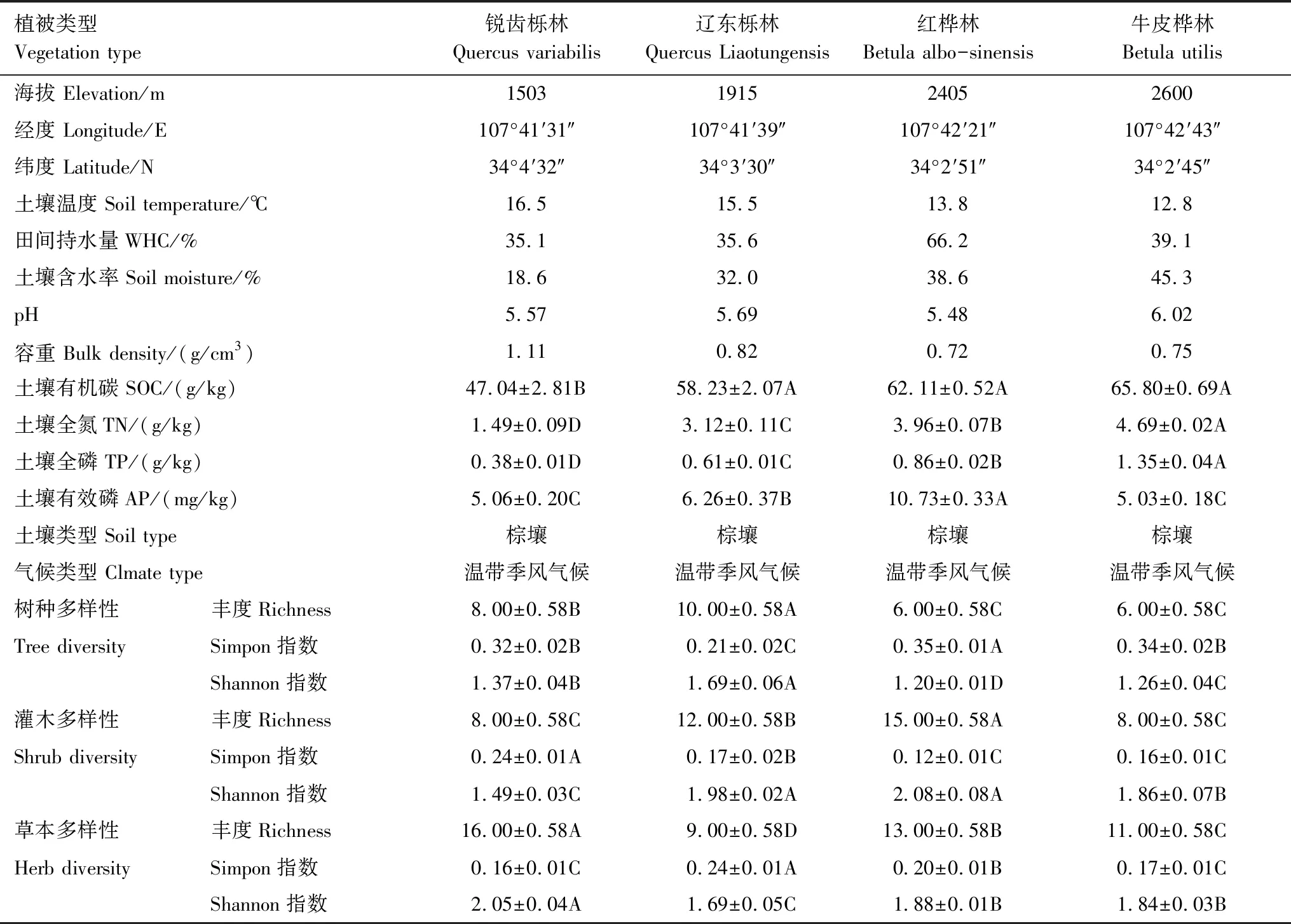
表1 采樣地基本信息Table 1 Basic information of sampling point
土壤樣品的分離采用干篩法[13]。在土壤半干狀態下,將大塊土壤捏碎,避免結成硬塊,待土壤相當干燥時進行篩分,以保持團聚體的結構強度,避免破壞團聚體結構[14—15]。將風干的土樣混勻,取500 g。用孔徑分別為2 mm、0.25 mm篩子進行篩分(篩子附有底和蓋)。篩完后得到大團聚體(>2 mm)、中團聚體(0.25—2 mm)和小團聚體(<0.25 mm)[11,16]。將篩分后的不同粒徑的各團聚體的土壤分成三份相等的部分:第一部分儲存于4℃下,測量土壤初始微生物量碳和土壤胞外酶活性;第二部分在室溫下避光風干,接著測量其初始土壤理化性質;第三部分儲存于厚鋁盒中,進行培養實驗(具體方法詳見1.2)。
1.2 團聚體微生物呼吸及其相關環境因子測定
土壤預培養實驗前1天測量土壤樣品到達田間持水量時的土壤重量。預培養實驗正式開始后,調節RXM-280A型培養箱保持恒濕,前20天每天進行測重并補充差量水分,從第20—60天每3天進行補水,第60天到實驗結束每7天進行補水,從而保證持水量達到田間持水量的60%[17]。將預培養好的每個重復的土壤分為兩個部分:第一部分為400 g,用于培養期間進行采樣;第二部分為300 g,用于測定土壤呼吸。兩個部分分別裝在不同的500 mL玻璃培養瓶中,所有實驗條件等同。將這些培養瓶在3個不同的恒定溫度下進行培養(5℃,15℃,25℃),共計103天。期間使用LI-8100A碳通量自動測量儀(產自LI-COR,美國)測量其土壤呼吸,每個呼吸瓶測量3次。103天中,總計測量呼吸66次,于前1—39天每天測量,40—68天每兩天測量,70—103天每三天測量。此外,在培養的第5,10,20,30,40,60,80,100天,分別在3個重復的取樣瓶中每一個取出50 g土壤(共計150 g土壤×4個海拔×3個溫度×3個粒徑),測定培養期間的土壤理化性質、微生物量碳和胞外酶活性。
土壤水分(SM)通過在105℃下干燥24 h后稱重進行測量。土壤容重采用環刀法測定。土壤有機碳(SOC)采用K2Cr2O7氧化法進行測定[18]。采用氯仿熏蒸-K2SO4提取和過硫酸鉀消化法估算微生物量碳(MBC)[19—20]。采用96孔微孔板熒光法測定團聚體中3種碳獲取水解酶活性(β-葡萄糖苷酶,β-1,4-glucosidaseBG;β-木糖苷酶,β-1,4-xylosidase,BX;纖維二糖水解酶,cellobiohydrolase,CBH);采用吸光光度法測定2種碳獲取氧化酶活性分別是過氧化物酶(Peroxidase,PER)和多酚氧化酶(Polyphenol oxidase,PPO)。
1.3 數據處理與分析
1.3.1植物群落多樣性
通過計算不同物種的重要值(Importance value,IV,單位為%),以用于反映該物種在采樣樣方中的優勢程度。具體而言,分別將菊科、豆科和禾本植物的物種重要值相加,以計算3種植物科在不同海拔上的植物群落的占比。物種重要值的計算公式如下:
(1)物種重要值:

式中,相對蓋度、相對高度、相對密度計算公式如下:

(2)物種豐富度:
物種豐富度(richness)=出現在樣地內的物種數
(3)植物α多樣性:
本研究用Simpson index(D)和Shannon-Wiener diversity index(H)來描述物種多樣性。這兩個值用以下公式計算:
式中,S、Pi和Ni分別是物種i的總數、i物種的密度比例和個體總數。
1.3.2土壤呼吸與三庫模型
根據駐留時間的不同,本研究將SOC分為3個獨立的碳庫:活性碳庫、緩效碳庫、惰性碳庫。三庫的具體計算方式如下[10,21]:
Ri=Ci×e-ki×t
式中,Rcum表示土壤呼吸的累積量,其值為3個庫的土壤呼吸之和;Ci表示3個碳庫的碳庫分解速率(i=1、2、3代表活性碳庫、緩效碳庫、惰性碳庫);Ch和Cl分別是高溫(Th)和低溫(Tl)時的土壤呼吸速率;Q10表示溫度升高10℃時SOC分解速率的相對比例變化[4],fi表示3個碳庫的碳庫分解速率占總分解速率的比例,且fi的總和為1;ki表示3個池的分解率。fi和ki是根據Bayes′ theorem來計算的[21]。
P(θ|z)∝P(z|θ)P(θ)
該模型的參數(θ)(包括f和k)和后驗概率密度函數PDFP(θ|z),其來源于prior knowledge of parameters-PDFP(θ)以及本研究在336天內測量的土壤呼吸的似然函數P(z|θ)。其中,該似然函數P(z|θ)的計算是基于模型擬合值和觀測值之間的誤差彼此獨立,并且服從均值為0的多元高斯分布(multivariate Gaussian distribution):
式中,Xi(t)和Zi(t)是模型擬合和測量出的累積呼吸的值,而σi(t)是測量值的標準偏差。使用Metropolis-Hastings(M-H)算法構造posterio-rPDFs參數[22]。具體步驟如下:
(1)依照以下公式得出θnew:
θnew=θold+d(θmax-θmin)/D
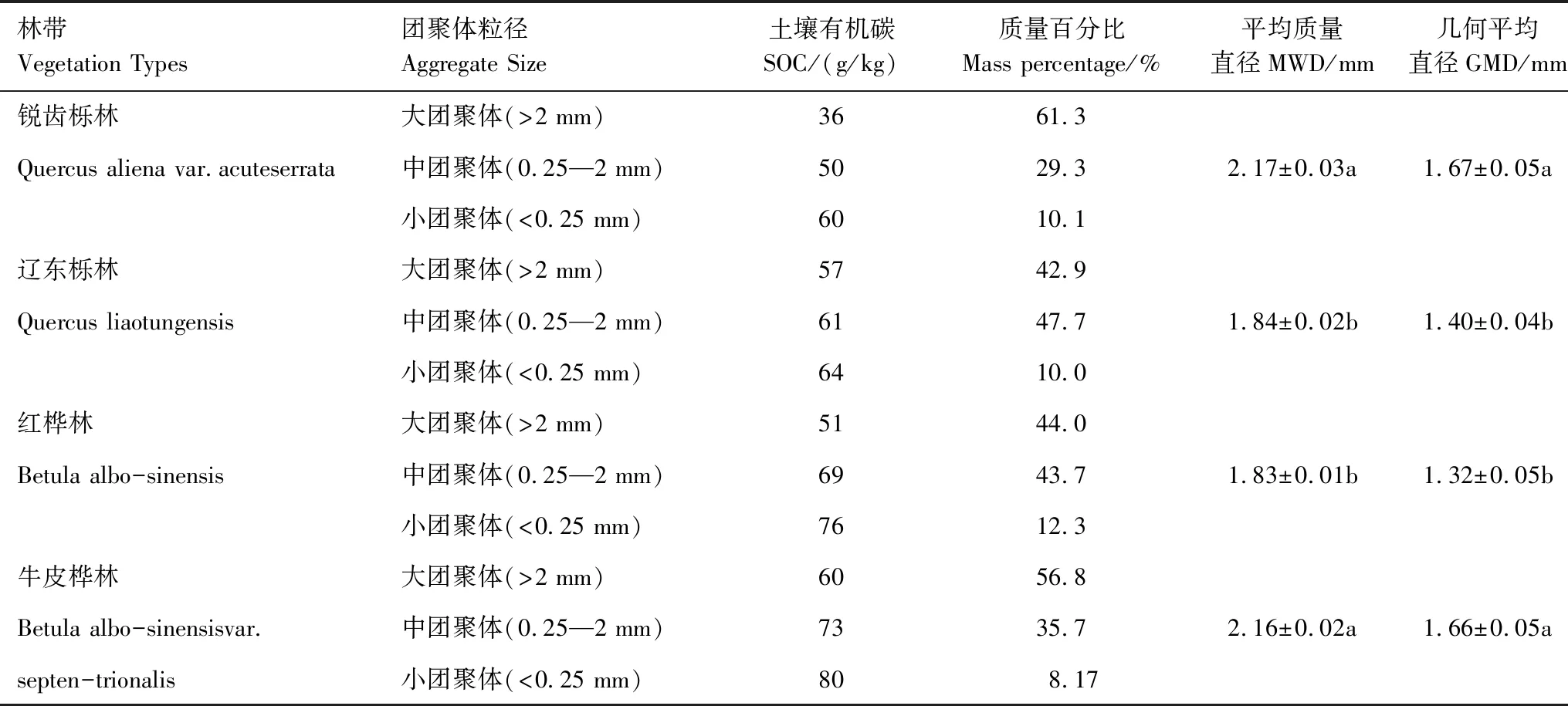
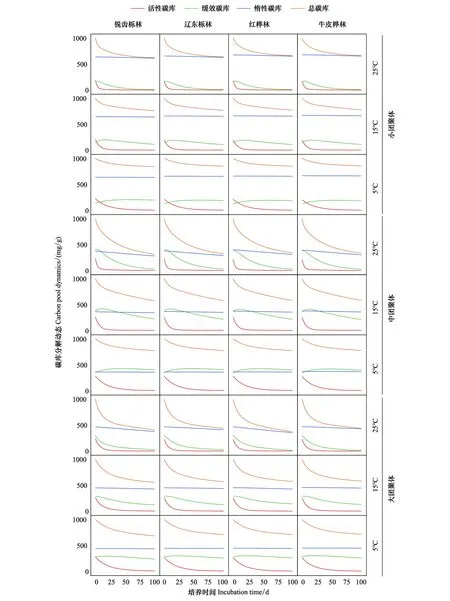
式中,θmax和θmin分別是給定參數范圍內的最大值和最小值;d是一個隨機變量(-0.5 (2)本研究檢驗該θnew是否服從上述多元高斯分布,如果是,則接受該參數,如果否,則舍棄該參數。 將上述過程多次重復(本研究中重復了100萬次,其中接受參數優化大約在15萬次),可以使參數得到有效的優化,使得本實驗中的土壤呼吸值與三庫模型累積值的擬合度r2均達到99以上。 1.3.3胞外酶活性 為了達成實驗目的,本研究將木質素酶的活性由PER和PPO的活性平均值代表,纖維素酶的活性由BG、BX、CBH的活性平均值代表,通過以下公式來表示并計算生態化學計量比(木質素酶:纖維素酶(Ligninase:Cellulase))[23]: 式中,BG表示β-葡萄糖苷酶的活性,BX表示β-木糖苷酶的活性,CBH表示纖維二糖水解酶的活性,PER表示過氧化物酶的活性,PPO表示多酚氧化酶的活性。 1.3.4Mantel 分析 以上公式通過歸一化如下: 式中,r即為距離矩陣的相關性,取值范圍為(-1,1);x是四個植被帶、三種培養溫度、三種粒徑團聚體下的Q10、MBC、胞外酶活性組成的12×10矩陣;y是植被類型、土壤環境、土壤特性、土壤底物四類因子各數據按x矩陣i排列順序相對應組成的12×17矩陣;i、j代表元素在矩陣中的位置;ˉx、ˉy代表矩陣元素的均值;n是距離矩陣中的元素數;s是矩陣的標準差[24]。 1.3.5數據分析 使用基于鄧肯檢驗(Duncan′s multiple range test)的單因素方差分析(one-way analysis of variance,ANOVA)以用于分析土壤、凋落物、根系、葉片的理化性質的差異性。使用斯皮爾曼相關性(Spearman′s correlation)探究碳庫溫度敏感性和微生物量、胞外酶以及其計量比之間的相關性。以上分析均在SPSS 22.0中完成(SPSS 22.0 for Windows,Chicago,IL,US)。使用MATLAB(MATLAB 2017b,MathWorks,US)計算三庫模型中的參數,包括Pi,Ri,fi,ki以及三庫的駐留時間。使用Origin 9.4繪制圖1、圖2、圖3,使用Rstudio(Rstudio for Windows,version 1.2.5033)繪制圖4。 由表2可知,各粒徑團聚體占全土比例隨團聚體粒徑增大而增大,四個海拔上小團聚體、中團聚體、大團聚體平均占全土比例分別為10.0%、39.0%、51.3%。四個海拔上團聚體平均質量直徑(MWD)以及幾何平均直徑(GMD)出現最大值的均是銳齒櫟林,分別為2.17、1.67 mm,出現最小值的均是紅樺林,分別為1.83、1.32 mm。本研究發現,各粒徑團聚體間土壤有機碳含量的變化規律與團聚體分布規律相反,呈隨粒徑增大而減小的規律,其中銳齒櫟林上有機碳含量減小最多為66.7%,遼東櫟林上減小最少為12.2%。對于相同粒徑的團聚體,土壤有機碳含量會隨著海拔的升高而升高,具體地說以牛皮樺林各團聚體有機碳含量最多,大團聚體、中團聚體、小團聚體有機碳含量分別為60、73、80 g/kg;銳齒櫟林上各團聚體有機碳含量最小,大團聚體、中團聚體、小團聚體有機碳含量分別為36、50、60 g/kg。 表2 不同植被帶團聚體顆粒組成Table 2 Aggregate particle composition of different vegetation belts 在100天的培養過程中,本研究發現在溫度相同的條件下,團聚體SOC累計礦化量均隨海拔梯度升高而增加,具體地說隨著海拔升高,大、中、小團聚體礦化量在5℃下增加了7.33%、5.08%、2.81%;在15℃下增加了10.35%、9.53%、3.80%;在25℃下增加了14.64%、17.45%、3.63%(圖1)。值得注意的是,本研究發現在四個海拔、3個培養溫度下均以小團聚體的SOC礦化率最低,在四個海拔上小團聚體礦化率在5℃、15℃、25℃分別為14.08%—15.56%、21.71%—23.79%、33.56%—37.62%(圖1)。在各團聚體之間,以小團聚體中惰性碳庫比例最大,各海拔平均為66.08%;活性碳庫比例最小,各海拔平均為14.20%,有趣的是,本研究觀察到隨著海拔的升高,大團聚體、中團聚體、小團聚體的惰性碳庫比例分別升高5.89%、17.41%、23.94%,大團聚體、中團聚體、小團聚體的活性碳庫比例降低7.15%、7.05%、16.31%,(圖1)。本研究還發現在三種培養溫度下各碳庫的SOC礦化速率均隨培養時間下降,以活性碳庫表現的最明顯,具體地說活性碳庫礦化速率在最初達到最大值,短期內迅速下降,隨后穩定下來處于緩慢下降狀態,在5℃、15℃、25℃培養20天后礦化速率平均下降了58.25%、80.92%、93.08%(圖1)。 圖1 四個植被帶上各粒徑團聚體土壤有機碳礦化動態Fig.1 Soil organic carbon decomposition dynamics of aggregates with different particle sizes on four vegetation zones 由圖2可知,團聚體的Q10值介于1.47—5.26,團聚體的Q10隨著海拔的升高而增加,并且相同粒徑團聚體中各碳庫的Q10均隨海拔升高而變大,具體地說惰性碳庫T1Q10、T2Q10值分別平均增加了0.51、0.32;緩效碳庫T1Q10、T2Q10值分別平均增加了0.22、0.27;活性碳庫T1Q10、T2Q10值分別平均增加了0.34、0.19。在不同碳庫之間Q10存在顯著性差異(P<0.05),表現出惰性碳庫>緩效碳庫>活性碳庫,惰性碳庫的T1Q10、T2Q10分別平均為5.24、4.52;緩效碳庫的T1Q10、T2Q10分別平均為4.25、3.59;活性碳庫的T1Q10、T2Q10分別平均為2.93、1.92(圖2)。在相同海拔、同一粒徑團聚體中,T1Q10與T2Q10存在顯著性差異(P<0.05),表現出隨溫度升高而降低的現象即T1Q10>T2Q10(圖2)。此外,在相同海拔、同一溫度梯度中,不同粒徑團聚體的Q10之間無顯著性差異(P>0.05)(圖2)。 圖2 四個植被帶上各粒徑團聚體土壤有機碳礦化溫度敏感性(Q10)Fig.2 Temperature sensitivity of soil organic carbon decomposition(Q10)of aggregates of various sizes on four vegetation zones QVA:銳齒櫟林Quercus aliena var.acuteserrata;QW:遼東櫟林Quercus liaotungensis;BA:紅樺林Betula albo-sinensis;BAV:牛皮樺林Betula albo-sinensisvar.septen-trionalis;T1指5℃與15℃的溫差,T2指15℃與25℃的溫差;不同字母表示不同植被帶上,相同碳庫Q10差異顯著,P<0.05 團聚體的MBC隨著培養時間,各海拔、各溫度下均呈現先升高后下降的趨勢,且在不同粒徑團聚體之間MBC無顯著性差異(P>0.05)(圖3)。本研究觀察到MBC在開始的20—30天內達到最大值,在培養的第20天,5℃、15℃、25℃培養溫度下的MBC相對于第1天升高了16.81%、36.98%、40.33%;在培養的第40天,5℃、15℃、25℃培養溫度下的MBC相對于第1天升高了14.04%、6.74%、9.83%;在整個培養期末期各團聚體的MBC達到最低值,5℃、15℃、25℃培養溫度下的MBC相對于第1天降低了50.76%、49.56%、59.30%(圖3)。此外,本研究發現ln(Ligninase):ln(Cellulase)隨培養時間呈現緩慢升高的趨勢,在培養的第10天其相對于第1天平均升高了2.21%,在培養的第40天其相對于第10天平均升高了2.79%,在培養的第100天其相對于第40天平均升高了2.71%(圖3)。 圖3 四個植被帶上各粒徑團聚體微生物量碳及ln(Ligninase):ln(Cellulase)變化動態Fig.3 MBC and ln(Ligninase):ln(Cellulase)change dynamics of aggregates of various sizes on four vegetation zonesMBC:微生物量碳Microbial biomass carbon;Ligninase:木質素酶;Cellulase:纖維素酶 本研究發現在4個海拔上活性碳庫的Q10與MBC、BG呈極顯著性相關(P<0.01),與CBH、PPO、ln(Ligninase):ln(Cellulase)呈顯著性相關(P<0.05),然而與BX、PER無顯著性相關(P>0.05)(圖4)。緩效碳庫在四個海拔上與PPO呈顯著性相關(P<0.05),與MBC、PER、BX、ln(Ligninase):ln(Cellulase)呈極顯著性相關(P<0.01),與CBH、BG無顯著性相關(P>0.05)(圖4)。惰性碳庫在四個海拔上與PPO、BX、ln(Ligninase):ln(Cellulase)呈顯著性相關(P<0.05),與MBC、PER呈極顯著性相關(P<0.01),與CBH、BG無顯著性相關(P>0.05)(圖4)。本研究在Mantel分析中還發現植被類型、土壤特性、土壤環境、土壤底物與活性碳庫Q10、MBC、BG呈顯著性相關(P<0.05),與緩效碳庫和惰性碳庫均無顯著性相關(P>0.05),其中植被類型、土壤特性與BX、ln(Ligninase):ln(Cellulase)呈顯著性相關(P<0.05)(圖4)。 圖4 各碳庫Q10與胞外酶的相關性分析及環境因子Mantel分析Fig.4 Correlation analysis of each carbon bank Q10 and extracellular enzyme and environmental factor mantel analysis P1:活性碳庫;P2:緩效碳庫;P3:惰性碳庫;BX:β-木糖苷酶 β-1,4-xylosidase;BG:β-葡萄糖苷酶 β-1,4-glucosidase;CBH:纖維二糖水解酶 cellobiohydrolase;PER:過氧化物酶 Peroxidase;PPO:多酚氧化酶 Polyphenol oxidase;Lig.Cell:ln(木質素酶):ln(纖維素酶)ln(Ligninase):ln(Cellulase);植被類型:植被多樣性;土壤特性:BD、pH;土壤環境:ST、SM;土壤底物:及Mantel相關性R2;P:Mantel相關性P值;*、**、***分別代表Spearman相關性P<0.05、P<0.01、P<0.001 本研究的結果表明,惰性碳庫相較活性碳庫和緩效碳庫具有較高的Q10。這符合C quality-temperature(CQT)假設[4,9],即具有較高分解能的頑固性SOC具有較高的Q10[25],大部分已經發表的培養實驗均支持這種猜想,例如Knorr和Conant等的研究[26—27]。然而也有研究得出相反的結論,例如Cusack和Liski等認為活性碳庫的Q10更高或者不同碳庫的Q10相等的結論[28—29],Wang等的meta分析認為造成這種差異的原因是Q10可能還會受到土壤團聚和胞外酶的影響[4],但本研究的實驗結果表明Q10值在不同粒徑的團聚體之間無顯著性差異。以上證據說明惰性碳庫可能是變暖導致改變全球CO2升高的主要因素[30—31],其Q10值對SOC循環與全球氣候變化之間的反饋具有重要意義[4]。相反,活性碳庫主要由不完全分解的植物殘渣和微生物生物量組成[28],其Q10較小、具有較短的駐留時間,不會顯著地促進上述積極反饋,這與Lin和Wang等人的研究結果一致[25,32]。然而,也有Giardina和Liski等人研究認為是由活性碳庫引起變暖造成SOC礦化加速從而誘導的CO2排放升高[29,33],這表明碳庫的溫度敏感性還可能會受到多種環境因素的影響[34],例如礦物質的吸附和微生物的生理特性等[35]。此外,本研究還發現團聚體的Q10和SOC累計礦化量隨海拔的升高而增加,可能的原因是惰性碳庫隨海拔升高而增加[36]。 本研究發現團聚體Q10值隨著培養溫度的升高而降低,即T1Q10>T2Q10[1],該結果與Wang和Qi等人的實驗結果相一致[4,37],這是因為溫度升高有利于SOC與腐殖酸鹽復合物的解吸并降低物理保護以加速SOC礦化[11,22],從而增加了不穩定SOC庫的大小[38]。然而Mikan等人的研究認為Q10值隨著溫度的升高而升高[39],可能的原因是這些研究地區大部分位于高緯度地區[4],另外Bekku等研究表明Q10值與溫度的變化無明顯相關[40],造成差異的原因可能是研究區域土壤類型、凋落物的輸入或者微生物群落之間存在差異[1]。有趣的是,本研究發現小粒級團聚體的SOC礦化率最低[10],與王菁的結論相同[41],可能的原因是小粒級團聚體中有機碳多為微生物來源的腐殖質[11],如胡敏酸和腐殖酸[4],有機質腐解程度較高,更難被微生物分解利用[4]。 相關性研究的結果表明,團聚體的Q10受到MBC和胞外酶的影響[42—43],但不同碳庫Q10對MBC和胞外酶的變化表現出不同的響應[9,44],本研究的實驗結果驗證了Wang等人的猜想[4]。具體地說,活性碳庫的Q10與MBC、CBH、BG之間存在相關關系,惰性碳庫和緩效碳庫的Q10與PER、PPO、ln(Ligninase):ln(Cellulase)之間存在相關關系[18,45]。可能的原因是一方面活性碳庫的礦化強烈依賴于MBC[46—47],而升溫會導致MBC的減少從而降低活性碳庫的礦化速率[26,48];另一方面基于米氏方程,酶的活性主要取決于底物可利用性[26,49],在培養初期升溫會導致微生物群落提升降解不穩定C的酶(CBH、BG)產量[50],這會加速不穩定C的礦化[51],隨著底物的可利用性降低CBH的產量也會降低,這會進一步降低活性碳庫的礦化速率[26,45],最終兩個方向的作用相互疊加會導致活性碳庫對溫度的不敏感[31,52],這樣的響應都表現在本研究的實驗結果中。值得注意的是,升溫導致土壤活性碳庫的消耗殆盡[53—54],微生物群落會增加BX、PER、PPO的產量[6],這些酶主要參與難分解C的礦化[45],適應土壤活性碳庫和惰性碳庫比例的變化并利用緩效碳庫和惰性碳庫中的難分解C[31],這會導致惰性碳庫對溫度的敏感性升高;另一方面Meng、Chen等研究結果認為升溫引起的可利用性碳的增加會導致微生物對氮的需求增加[31,48],在這種情況下微生物群落會傾向于礦化含氮的來自惰性碳庫的木質素[55],這些酚蛋白復合物的分解主要通過木質素酶的解聚[56],這導致了PPO、PER的產量增加[56],并且,Sinsabaugh等研究發現由于低溫和低氧含量通常會抑制木質素酶的的活性[49],因此升溫導致的土壤溫度升高和土壤水分減少可能會刺激酶的活性并提高氧氣利用率[57],本研究的結果支持了這種假設,因為在40天后代表底物分解偏好的ln(Ligninase):ln(Cellulase)持續升高[26,45],這樣的響應會加劇惰性碳庫對溫度的敏感性。重要的是,這證明了升溫可能會通過直接影響胞外酶和MBC從而間接加速惰性碳庫的礦化造成全球變暖[4]。 (1)對于Q10而言,各團聚體Q10表現出隨海拔升高而增加,隨溫度升高而降低(T1Q10>T2Q10)的現象,并且符合惰性碳庫Q10>緩效碳庫Q10>活性碳庫Q10的規律。 (2)中團聚體中含有較高的活性碳庫和緩效碳庫,而小團聚體中含有高的惰性碳庫,大團聚體的三庫比例均處于小團聚體和中團聚體之間。這表明小團聚體含較多穩定的碳組分,而中團聚體含有較多活躍的碳組分,大團聚體是中團聚體與小團聚體的混合物。 (3)微生物會通過改變胞外酶的活性影響各碳庫的溫度敏感性。具體而言,CBH、BG與活性碳庫的溫度敏感性相關,BX、PER、PPO與緩效碳庫和惰性碳庫的溫度敏感性相關。植被類型、土壤特性、土壤環境、土壤底物會通過影響微生物特性控制活性碳庫的Q10。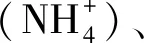
2 結果分析
2.1 團聚體分布及有機碳含量
2.2 三庫模型下團聚體有機碳礦化
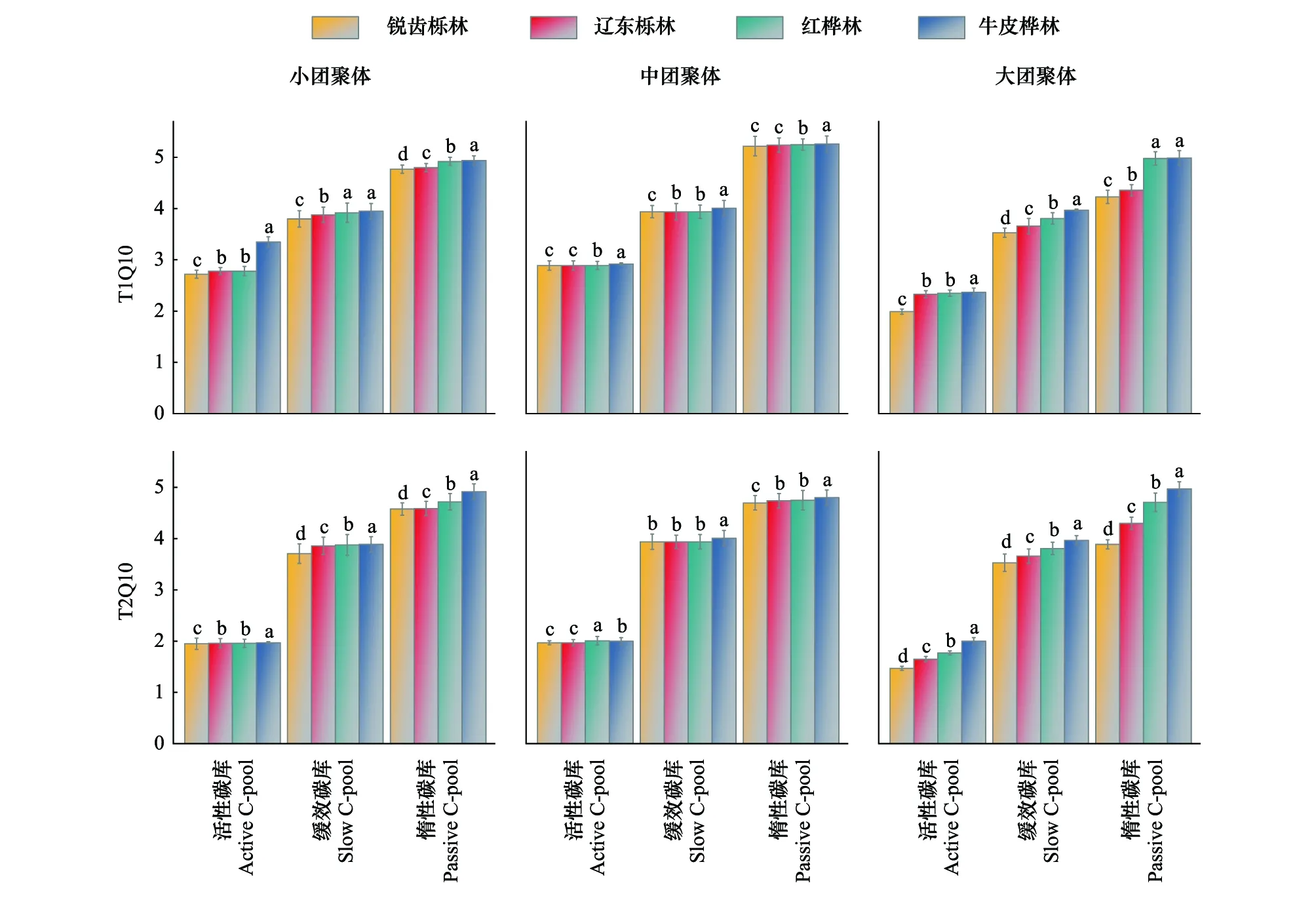
2.3 團聚體有機碳礦化溫度敏感性
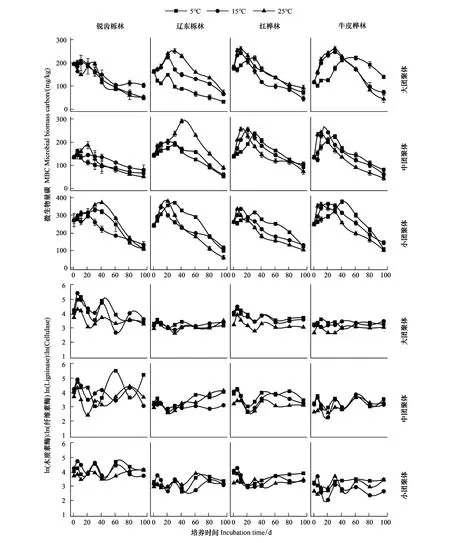
2.4 團聚體微生物量碳和胞外酶活性的變化
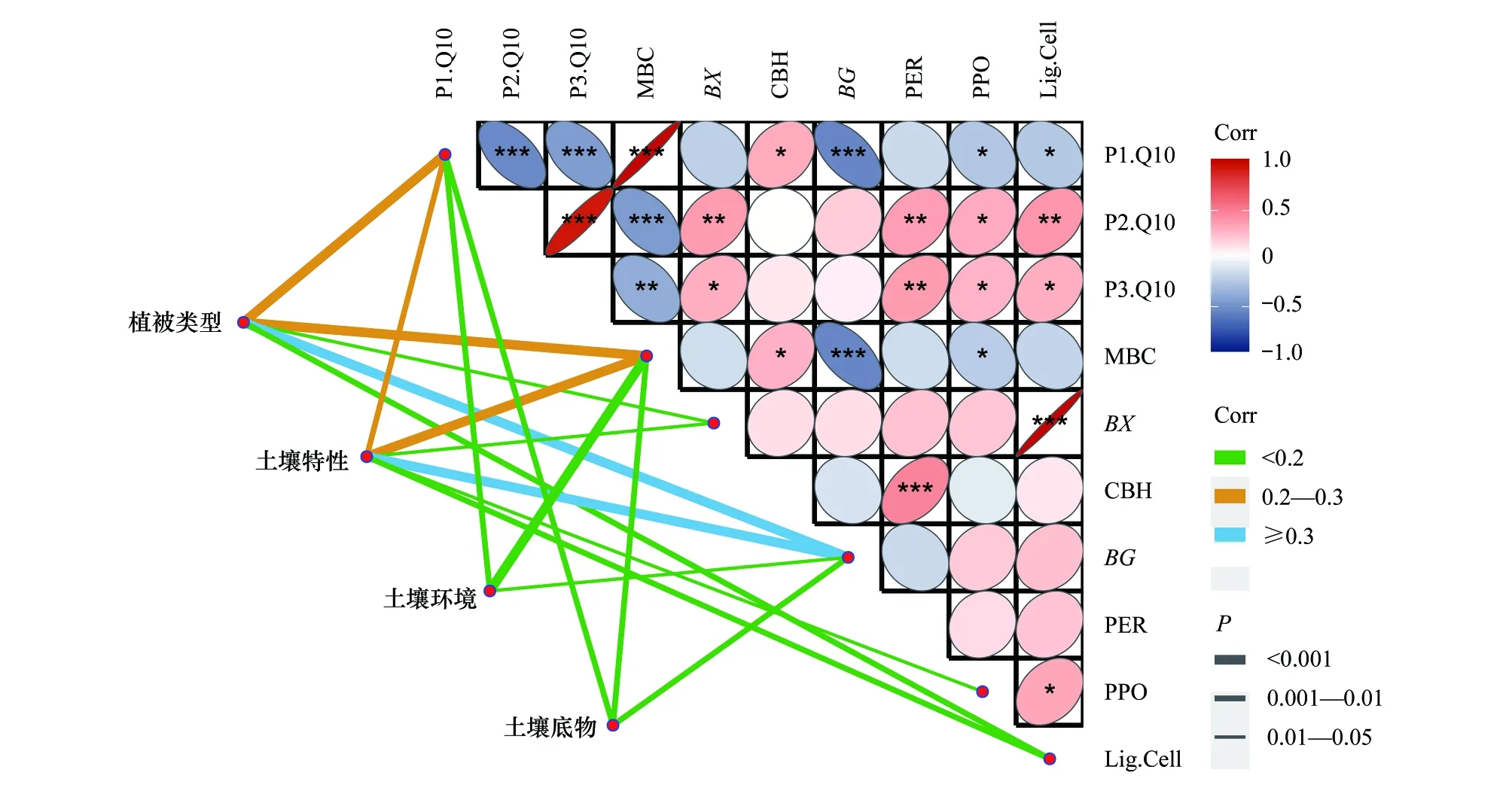
2.5 微生物量和胞外酶對Q10的影響
3 討論
3.1 海拔梯度上各團聚體不同碳庫的礦化及Q10差異
3.2 海拔梯度上微生物活性及環境因子對Q10的影響
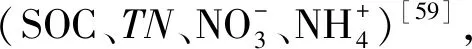
4 結論

