光照強度對絲狀藻去除再生水中氮磷的影響
楊宇航,邊雪強,孫翠竹,姜曉華,單 欣,李鋒民,3*
1. 中國海洋大學環境科學與工程學院近海環境污染控制研究所,山東 青島 2661002. 中國海洋大學,海洋環境與生態教育部重點實驗室,山東 青島 2661003. 青島海洋科學與技術試點國家實驗室,海洋生態與環境科學功能實驗室,山東 青島 266071
由于人口增長、經濟發展和消費模式的轉變,全球用水量仍在以每年約1%的速度穩步增長,到2030年世界可能面臨40%的水資源短缺[1]. 我國水資源總量雖占世界水資源總量的6%左右,但由于我國人口多且分布不均,人均水資源量嚴重不足[2],我國缺水城市超過1/2,嚴重缺水城市超過1/3[3]. 污水的再生利用是解決我國水資源短缺和水污染問題的重要途徑,然而與常規水資源相比,再生水中高濃度的N和P可導致藻華暴發[4],對水質、景觀和生態功能產生顯著的負面影響[5]. 王怡等[6]研究發現,完全達標的再生水在夏季靜置4 d后會爆發藻華,藻密度可達8.08×105cells/mL,因此在再生水回用前,有必要對再生水進行深度脫氮除磷處理[7-8].
常規的再生水深度處理方法,如微濾、超濾等物理方法,雖然可以有效凈化再生水,但成本較高,且無法實現氮、磷元素的回收利用,造成資源浪費[9]. 相比之下,藻類可以通過光合作用吸收氮、磷等營養鹽,并轉化為藻類生物質,可作為生物柴油、飼料、沼氣等產品的原料,兼顧環境效益和經濟效益. 目前,小球藻、柵藻等藻體較小的微藻已被用于處理包括再生水在內的各種污水[10-11]. 但微藻細胞體積小,收集困難[12],增加了污水處理成本[13],研究表明微藻的收集占設備成本的90%以上,占總成本的20%~30%[14].
與微藻相比,絲狀藻具有易捕撈和抵抗高營養級生物捕食的優勢. 利用絲狀藻進行廢水處理的主要方法分為藻類草皮洗滌器(ATS)和藻類單一培養.ATS系統已被用于處理農業、水產養殖、乳制品和初級生活污水[15-16]. 與ATS相比,藻類單一培養的主要優勢在于可以收獲單一的絲狀藻類,控制生物質的質量,以便于回收利用[17]. 然而目前一些關鍵參數如光照強度,對絲狀藻單一培養及脫氮除磷的影響仍不清楚[18]. 因此,該研究探究了不同光照強度對4種絲狀藻去除再生水中氮、磷的影響以及與絲狀藻生物質產量、蛋白質含量、脂質含量的關系,以期為應用絲狀藻深度處理再生水及藻類的資源化提供數據支持.
1 材料與方法
1.1 藻種培養
試驗所用的4種絲狀藻,即水綿(Spirogyrasp.,FACHB-737)、結 節 鞘 藻(Oedogoniumnodulosum,FACHB-996)、絲藻(Ulothrixsp.,FACHB-494)和轉板藻(Mougeotiasp.,FACHB-718),均購自中國科學院淡水藻種庫. 其中,水綿和結節鞘藻在BG11培養基中培養;絲藻和轉板藻在SE培養基中培養. 培養條件為溫度25 ℃、光照強度2000 lx、光暗比12 h∶12 h.
1.2 研究方法
試驗在裝有5 L再生水的高為31 cm、直徑為19 cm的玻璃容器中進行,使用額定功率為18 W的T5 LED節能燈進行光照,試驗設置5組光照強度(0、2000、6000、8000、10000 lx),每組設置3個平行.試驗前將藻種于試驗水體中馴化培養7 d,每個試驗組初始接種0.25 g (鮮質量)馴化后的絲狀藻. 為避免實際再生水水質不穩定產生的誤差,試驗所用再生水為實驗室配置再生水,主要成分為0.058 g/L NaNO3、0.017 g/L NH4Cl、0.046 g/L C6H12O6·H2O、0.002 g/L KH2PO4、0.007 g/L CaCl2、0.0001 g/L FeCl3、0.007 g/L MgSO4、微量元素〔0.572 mg/L H3BO3、0.372 mg/L MnCl2·4H2O、0.044 mg/L ZnSO4·7H2O、0.078 mg/L Na2MoO4·2H2O、0.016 mg/L CuSO4·5H2O、0.01 mg/L Co(NO3)2·6H2O〕. 所有試驗組在25 ℃、光暗比12 h∶12 h的條件下培養. 試驗周期為16 d,每4 d取水樣100 mL測定水樣TN、、TP濃度及藻類生物質產量. 第16天將全部藻體濾出,使用超純水沖洗,冷凍干燥后測定藻細胞內脂質和蛋白質含量.
1.3 分析測試方法
1.3.1 水質測定方法
水樣使用0.45 μm的玻璃纖維濾膜過濾,測定水中TN、、TP濃度,其中TN濃度采用《水質 總氮的測定 堿性過硫酸鉀消解紫外分光光度法》(HJ 636—2012),濃度采用《水質 氨氮的測定 納式試劑分光光度法》(HJ 535—2009)測定,濃度采用《水質 硝酸鹽氮的測定 紫外分光光度法》(HJ/T 346—2007)測定,TP濃度采用《水質 總磷的測定 鉬酸銨分光光度法》(GB/T 11893—1989)測定.
1.3.2 生物質產量測定方法
使用預先烘干至恒質量的玻璃纖維濾膜過濾水樣,過濾后的濾膜在60 ℃烘干24 h至恒質量,計算生物質產量(M),其計算公式:

式中:M為生物質產量,g/L;m0為過濾烘干后的濾膜質量,g;m1為預先烘干的濾膜質量,g;V為再生水體積,L.
1.3.3 脂質、蛋白質含量的測定方法
冷凍干燥后的絲狀藻在液氮中研磨成粉,使用Solarbio公司的蛋白質提取試劑盒對藻細胞中的蛋白質進行提取,離心取上清液,用Bradford法測定上清液中蛋白質的含量. 脂質的提取和測定參考HY/T 231—2018《藻類總脂的提取和測定》,研磨后的藻粉用體積比為2∶1的甲醇與氯仿混合溶液提取脂質,離心取上清液,在上清液中加入1%的NaCl溶液和氯仿,萃取出底部有機相,使用氮氣吹干后稱量測定[19].
1.3.4 藻類N、P濃度的測定方法
稱取一定量冷凍干燥后的絲狀藻,加入超純水后分別使用過硫酸鉀、堿性過硫酸鉀溶液消解,參考水中TP、TN濃度的測定方法進行測定.
1.4 數據分析
用Excel 2018軟件進行數據處理,用Origin 2018軟件進行繪圖,使用SPSS軟件進行均值檢驗分析,P<0.05表示差異顯著,P>0.05表示無顯著差異.
2 結果與分析
2.1 光照強度對絲狀藻去除氮磷的影響
2.1.1 光照強度對絲狀藻去除TN的影響
再生水中TN濃度的變化趨勢如圖1所示. 以水綿為例,第16天,隨光照強度增加,其對TN的去除率先升后降. 光照強度為8000 lx時,水綿對TN的去除效果最好,再生水中TN濃度從初始的18.32 mg/L降至9.47 mg/L,去除率為48.34%;當光照強度為10000 lx時,水綿對TN的去除效果降低,再生水中TN濃度降至9.54 mg/L,去除率為47.95%;當光照強度為2000和6000 lx時,水綿對TN的去除效果最差,再生水中TN濃度分別為12.11、12.05 mg/L,去除率分別為33.93%、34.22%. 光照強度對結節鞘藻、絲藻和轉板藻去除TN的影響規律與水綿一致,當光照強度為8000 lx時,其對TN的去除效果最好,第16天,再生水中TN濃度分別降至6.44、9.21、3.79 mg/L,去除率分別為64.87%、49.74、79.32%. 當光照強度為2000和6000 lx時,水綿、結節鞘藻、絲藻和轉板藻對TN的去除效果均最差.

圖1 光照強度對絲狀藻去除再生水中TN濃度的影響Fig.1 Effect of light intensity on TN removal from reclaimed water by filamentous algae
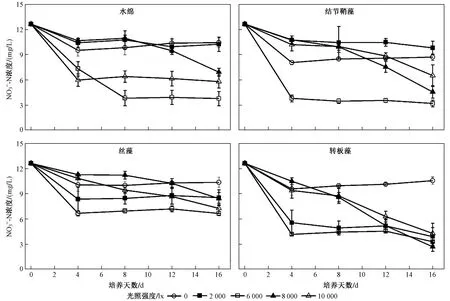
圖2 光照強度對絲狀藻去除再生水中NO3?-N濃度的影響Fig.2 Effect of light intensity on NO3—-N removal from reclaimed water by filamentous algae

圖3 光照強度對絲狀藻去除再生水中NH4+-N濃度的影響Fig.3 Effect of light intensity on NH4+-N removal from reclaimed water by filamentous algae
2.1.4 光照強度對絲狀藻去除TP的影響
再生水中TP濃度的變化趨勢如圖4所示. 光照強度為2000和6000 lx時,水綿對TP的去除效果較差,第16天,再生水中TP濃度分別為0.29、0.28 mg/L,去除率分別為42.63%、43.72%,無顯著差異(P>0.05);當光照強度為8000和10000 lx時,水綿能有效地去除TP,當去除率大于90%時,去除速率分別為0.03、0.04 mg/(L·d). 結節鞘藻和轉板藻在光照強度為2000、6000、8000和10000 lx時均能有效地去除TP,當去除率大于90%時,去除速率分別為0.03、0.03、0.06、0.04和0.04、0.04、0.11、0.06 mg/(L·d). 光照強度為2000 lx時,絲藻對TP的去除效果也較低,去除率為55.78%;當光照強度為6000、8000和10000 lx時,絲藻能有效去除TP,當去除率大于90%時,去除速率分別為0.04、0.06、0.04 mg/(L·d).

圖4 光照強度對絲狀藻去除水中TP濃度的影響Fig.4 Effect of light intensity on TP removal from reclaimed water by filamentous algae
2.2 光照強度對絲狀藻生長的影響
2.2.1 光照強度對絲狀藻生物量的影響
4種絲狀藻生物質產量如圖5所示. 由圖5可見,黑暗條件下4種絲狀藻生物質產量變化趨勢一致,均為0~4 d升高,然后緩慢降低. 對于水綿,隨光照強度的增加,其生物質產量先升后降. 當光照強度為8000 lx時,水綿生物質產量最高,為0.71 g/L;當光照強度為2000、6000 lx時,水綿生物質產量均較低,均為0.016 g/L;當光照強度進一步提至10000 lx時,水綿生物質產量降至0.52 mg/L. 同樣,對于結節鞘藻和絲藻,當光照強度為8000 lx時,其生物質產量均最高,第16天,其生物質產量分別為1.02 和1.03 g/L;當光照強度為10000、6000、2000 lx時,第16天,其生物質產量分別為0.06、0.43、0.32 g/L和0.86、0.64、0.17 g/L. 此外,當光照強度為8000 lx時,絲藻生物質產量在第12天達到最大,然后降低. 對于轉板藻,其生物質產量隨光照強度的增加而增加,分別為0.48、0.54、0.84、0.88 g/L.

圖5 光照強度對絲狀藻生物質產量(以干質量計)的影響Fig.5 Effects of light intensity on biomass production (DW) of filamentous algae
2.2.2 光照強度對絲狀藻細胞內蛋白質和脂質含量的影響
不同光照強度下絲狀藻細胞內蛋白質和脂質的含量如圖6所示. 當光照強度為8000 lx時,4種絲狀藻細胞內蛋白質含量最高,分別為23.52%、44.36%、43.76%、39.65%;當光照強度為6000 lx時,4種絲狀藻細胞內蛋白質含量最低,分別為14.21%、14.72%、20.56%、16.00%. 當光照強度為8000 lx時,水綿、結節鞘藻和絲藻細胞內的脂質含量最高,分別為22.62%、23.66%、15.07%、17.49%,其他光照強度下這3種絲狀藻細胞內脂質含量隨著光照強度的增加而降低.

圖6 光照強度對絲狀藻蛋白質和脂質含量的影響Fig.6 Effects of light intensity on protein and lipid contents of filamentous algae
2.2.3 光照強度對絲狀藻吸收N、P的量的影響
不同光照強度條件下,絲狀藻吸收的N、P量及其占比如表1所示. 隨光照強度的上升,4種絲狀藻吸收N的量及其占比先升高后降低,在光照強度為8000 lx時最高,此時水綿、結節鞘藻、絲藻和轉板藻吸收N量的占比最高,分別為51.48%、44.72%、55.75%、46.67%. 藻類吸收的P量及其占比與水中P的減少量呈正相關,當光照強度為2000和6000 lx時,水綿、結節鞘藻對P吸收量的占比均較低,其他試驗組中絲狀藻吸收P量的占比均大于50%.

表1 絲狀藻吸收的N、P量及其占比Table 1 N and P absorption of filamentous algae and its proportion
3 討論
光照強度是影響藻類光合作用及生長的重要因素,與藻類對N、P等的去除直接相關,并且當光照強度過高時會對藻類生長產生光抑制[20]. 該研究表明,隨光照強度升高,水綿、結節鞘藻和絲藻的生物質產量及NH4+-N去除率逐漸升高,并在8000 lx時達到最大值,但隨光照強度進一步升至10000 lx時,其生物質產量和NH4+-N去除率均降低,這說明3種絲狀藻的光飽和度為8000 lx,而在10000 lx時產生了光抑制,但轉板藻在10000 lx時未發現光抑制現象,說明轉板藻的光飽和強度大于8000 lx.
4種絲狀藻對TN的去除效果從高到低依次為轉板藻、結節鞘藻、絲藻、水綿. 除轉板藻外,其他3種絲狀藻處理后的再生水中仍殘留較高濃度的TN,并以為主,這是因為藻類光合作用可直接同化而在同化前需要在細胞質中還原為然后在葉綠體中進一步還原為因此是藻類光合作用吸收的優先氮源[21]. 這也導致的去除與藻類生物質產量相關,低光照強度時,水綿(2000、6000 lx)和絲藻(2000 lx)較低的生物質產量導致的去除率較低. 此外,甚至會抑制藻類對的吸收,Yin等[22]研究發現,弱光條件下對硅藻吸收的抑制效應更強. 然而在該研究中,當光照強度為6000 lx時,4種絲狀藻對的去除效果均最好,說明在高光照強度時對絲狀藻吸收的抑制作用更強. 當光照強度為2000和6000 lx時,水中濃度的變化趨勢與黑暗組相似,說明0~4 d水中濃度的變化并不完全是藻類光合作用導致的,還包括細菌的硝化/反硝化作用[18],在此過程中微藻光合作用產生的氧氣可被細菌用于有機物的氧化,而細菌產生二氧化碳可被微藻利用而產生氧氣[23].從表1可以看出,藻類吸收N的量僅占整個體系的7.17%~66.47%. 水綿和鞘藻是兩種已被用于深度處理再生水的絲狀藻,Neveux等[24]研究發現,鞘藻對TN的去除率為61%,與該研究結果基本一致. 但Ge等[25]通過水綿深度處理污水處理廠二級出水,發現其對TN的去除率達82.2%,高于該研究結果,這是由于該試驗所配再生水中磷含量較低,N/P為66.43,磷含量過低限制了藻類在再生水中的生長及其對N的吸收. 與水綿和結節鞘藻相比,絲藻與轉板藻是兩種尚未在其他研究中被用于污水處理的藻屬,且轉板藻對TN的去除效果優于其他3種絲狀藻,而絲藻的去除效果優于水綿,低于結節鞘藻,因此轉板藻更適合用于深度去除再生水中的N.
絲狀藻能有效去除再生水中的P. 藻類對P的吸收與藻類生物質產量有關[26],與NH4+-N濃度的變化規律相似,低光照強度下水綿(2000、6000 lx)和絲藻(2000 lx)對TP的去除率均較低,且在試驗后期藻類死亡導致再生水中的TP濃度增加. 飽和光照強度時,雖然絲狀藻對TP的去除率未顯著高于其他光照組,但提高了絲狀藻對TP的去除速率. 0~4 d,再生水中TP的去除速率最高,這是因為藻類對P的吸收存在奢侈吸收現象[20],即藻類會在前期過量吸收P并以多聚磷酸鹽的形式儲存于細胞體內,用于保證當外界P不足時藻類的正常生長發育,因此當水中TP濃度降至不變后,藻類仍能進行生物質生產. 對于低光照強度時,水綿和絲藻試驗組在4~8 d觀察到再生水中TP濃度升高,這可能是部分P的不穩定吸附作用所導致的[12]. 當光照強度較低時,水綿、絲藻前期生長緩慢,出現P釋放現象;而結節鞘藻、轉板藻及高光照強度下的水綿、絲藻生物質產量在試驗前期迅速升高,所以未出現P釋放. 從表1也可以看出,在光照強度為2000和6000 lx時,水綿、結節鞘藻對P的吸收占比較低,其他試驗組中絲狀藻吸收P的占比均大于50%,因此藻類吸收是再生水中P的主要去除途徑. 與微藻相比[9],絲狀藻體積的增大并不影響其對P的去除,除水綿和絲藻在低光照強度下對TP的去除率較低外,其他條件下4種絲狀藻均能有效去除再生水中的P,去除率均在90%以上,水中P濃度可降至0.1 mg/L,達到我國GB 3838—2002《地表水環境質量標準》Ⅱ類水質標準.
再生水中培養的絲狀藻細胞內蛋白質含量高于脂質含量. 藻類會將同化后70%~90%的N進一步轉化為蛋白質[27]. 當光照強度為8000 lx時,4種絲狀藻內蛋白質含量最高,此時藻類吸收更多的N,導致蛋白質含量也隨之升高. 盡管水綿已被用于處理各種污水[28-29],但該研究發現,水綿對再生水中的TN去除率、TP去除率、生物質產量、蛋白質含量均低于其他3種絲狀藻. 當光照強度為8000 lx時,結節鞘藻、絲藻和轉板藻細胞體內蛋白質含量均大于40%,遠高于已有研究中的絲狀藻,如Cole等[30]在ATS污水處理系統中所培養的絲狀藻蛋白質含量僅為18%;張婷[31]研究了4種不同橘色藻科絲狀藻中的蛋白質含量,結果表示,蛋白質含量為7.48%~10.40%. 當藻類處于最佳光照強度時,葉綠體中光和系統PSⅡ中的捕光色素蛋白復合物對光能的吸收最大[32],促進細胞體內有機物的合成,因此當光照強度為8000 lx時,水綿、結節鞘藻、絲藻內脂質含量最高,而其他條件下,隨光照強度的增加,藻細胞體內脂質含量降低. 這與已有研究結果相似,如薛瑞萍等[33]研究發現,當光照強度為60 μmol/(m2·s)時,硅藻細胞內脂質含量最高,而其他光照條件下,脂質含量隨光照強度的升高而降低,這可能是因為低光照強度下更有利于不飽和脂肪酸(PUFA)的積累[34-35]. 與其他用于產油的絲狀藻相比[19],4種于再生水中培養的絲狀藻脂質含量(9.43%~23.66%)較低,這是再生水中低C/N所導致的. Sun等[36]認為,當COD/TN低于8時,對于藻類而言為低C/N水體,而C骨架不足導致了藻細胞體內的脂質含量較低. 因此使用絲狀藻去除再生水中的N、P并將其轉化為蛋白質的資源化利用潛力更高.
4 結論
a) 除水綿、絲藻在低光照強度時TP的去除率較低外,其他試驗組均能有效地去除再生水中的TP,因此絲狀藻對再生水的脫氮除磷能力更多取決于其對TN的去除能力,從高到低依次為轉板藻、結節鞘藻、絲藻、水綿.
b) 水綿、結節鞘藻和絲藻的生物質產量、蛋白質含量和脂質含量均在光照強度為8000 lx時達到最高,表明其光飽和強度均為8000 lx;轉板藻在光照強度為10000 lx時生物質產量最高,但此時其蛋白質和脂質含量卻低于光照強度為8000 lx時,表明轉板藻的光飽和強度在8000~10000 lx之間.
c) 再生水中培養的絲狀藻,其體內蛋白質含量高于脂質含量,因此利用絲狀藻去除再生水中的N、P并將其轉化為蛋白質的資源化利用前景更好.

