基于雜交種群體的玉米產量及其配合力的全基因組關聯分析
李周帥,董遠,李婷,馮志前,段迎新,楊明羨,徐淑兔,張興華,薛吉全
基于雜交種群體的玉米產量及其配合力的全基因組關聯分析
李周帥,董遠,李婷,馮志前,段迎新,楊明羨,徐淑兔,張興華,薛吉全
西北農林科技大學農學院/西北旱區玉米生物與遺傳改良重點實驗室,陜西楊凌 712100
【】通過分析陜A群和陜B群選育自交系組配的雜交種產量,評估自交系的配合力,并開展以產量和配合力為目標性狀的全基因組關聯分析,挖掘產量及其配合力的關聯位點,為陜A群和陜B群選育玉米自交系的改良及育種中的應用提供依據。基于NCⅡ遺傳設計,以陜A群和陜B群選育的85份優良玉米自交系為親本,構建包含246份F1的雜交種群體,在3個環境下進行產量測試,并評估產量的一般配合力和特殊配合力;利用6H90K芯片進行親本基因型檢測,獲得63 879個高質量SNP標記,并進行群體遺傳特征分析,在雜交種群體推測出高質量SNP標記55 951個,采用加性模型和非加性模型對雜交種產量、一般配合力和特殊配合力開展了全基因組關聯分析,并基于B73參考基因組對顯著關聯SNPs內的基因進行挖掘和功能注釋。3個環境下的產量表現符合正態分布且變異廣泛,產量廣義遺傳力為59.04%,環境效應顯著;雜交種產量、一般配合力和特殊配合力三者之間均達到極顯著相關性,雜交種產量與特殊配合力的相關性(=0.95)大于與一般配合力的相關性(=0.62);陜A群與陜B群遺傳特征具有一定差異,陜A群具有較高的一般配合力。全基因組關聯分析分別檢測到7、5和9個SNP與雜交種產量、一般配合力和特殊配合力顯著相關(-log10()>3.86),其中4個SNP為雜交種產量和特殊配合力共定位,最終錨定了17個關聯SNP。對不同性狀關聯位點的優勢等位基因型分析發現,4個GCA關聯SNP受加性效應控制,F1產量BLUE關聯位點可分為4種表現形式,以顯性效應為主,其雜合基因型為最優等位基因型或次優等位基因型。通過功能注釋發現,候選基因在玉米生長發育和籽粒建成中特異表達,例如、均與玉米籽粒發育相關。一般配合力和特殊配合力共同影響雜交種的產量,特殊配合力效應影響更大;一般配合力和特殊配合力具有不同的遺傳基礎,可通過有利等位基因聚集提高一般配合力。在F1雜交種群體采用全基因組關聯分析策略可開展配合力相關遺傳解析,挖掘產量及其配合力相關遺傳位點,可加速關聯位點在分子育種中的應用。
玉米;雜交種;一般配合力;特殊配合力;全基因組關聯分析
0 引言
【研究意義】玉米(L.)作為中國第一大糧食作物,在食品、飼料和工業原料等行業被廣泛應用,在國家糧食安全體系中不可或缺[1]。當前,全球環境愈加多變復雜,為確保玉米持續增產和穩產,加速玉米種質創新,提高品種高產穩產性迫在眉睫[2]。【前人研究進展】玉米成為世界上種植面積最大、總產量最高的糧食作物,關鍵在于雜種優勢的應用和雜交種的種植與推廣。雜種優勢(heterosis)是指遺傳多樣性個體的雜交后代在產量、適應性和抗逆性等多方面上超過雙親的現象[3-5]。以此為基礎開展玉米種質改良,組配在產量、環境適應性、抗病性和品質等方面優良的品種。如堵純信等[6]選育的鄭單958和先鋒公司推出的先玉335都具備高產穩產的優良特性,在中國的玉米生產中推廣時間長,種植面積廣,是玉米雜種優勢利用的典型。長期以來,育種家使用配合力作為評價自交系和雜交種是否優良的一個重要指標[7],Sprague等[8]率先提出了配合力的概念,并將其進一步分解為一般配合力(general combining ability,GCA)和特殊配合力(special combining ability,SCA)。GCA是指某個自交系與其他自交系組配產生的雜交組合在某一農藝性狀上的平均表現;SCA反映的是特定雙親組配的雜交組合在某一性狀表現優于或次于雙親平均表現組合預期的部分。GCA反應自交系的育種潛力,SCA評價雜交種的實際表現和預測雙親的雜種優勢。基于此對大量的種質遺傳背景進行了探究:李明順等[9]采用NCⅡ遺傳設計對18份玉米自交系進行配合力分析,將其分為5個雜種優勢群并鑒定出4份育種潛力高的自交系。楊愛國等[10]對27份來自CIMMYT和國內玉米群體的材料進行配合力和雜種優勢分析,鑒定出9份熱帶、亞熱帶高配合力自交系,其中,Suwan1群體表現最優。除此之外,對配合力遺傳基礎的研究也逐步深入,Griffing[11]最早進行了配合力遺傳基礎的研究,將其解釋為加性和非加性效應的互作并估算了GCA和SCA的遺傳效應。隨著分子生物學技術的發展,研究人員開始通過連鎖定位和關聯分析深入開展配合力遺傳基礎的解析工作。Lü等[12]利用掖478及其近等系群體(含65份自交系)和3個測驗種測交產生的含有198份F1的群體對產量相關性狀進行QTL定位,在產量相關性狀中檢測到69個QTL,而產量GCA僅檢測到9個QTL,表明了二者的相關遺傳位點是不同的。Qi等[13]利用一個含有75份自交系的近等系群體和4個測驗種組配產生的含300份F1雜交組合的群體,對多環境下產量相關性狀的GCA和SCA進行了QTL定位,發現兩者的相關性不顯著,在GCA和SCA中分別檢測到56和21個QTL,其中,只有5個同時控制GCA和SCA,說明二者的遺傳基礎不同,同時檢測到GCA位點數與相應性狀GCA表現呈顯著正相關,說明GCA有利位點的累加可有效提高GCA。Wang等[14]創制了一個由724份雜交種組成的多雜交群體(multiple-hybrid population,MHP),使用TASSEL和PEPIS 2種方法對花期相關性狀分別進行了全基因組關聯分析,同時鑒定到5個與開花性狀相關染色體區域。Zhou等[15]利用328份玉米重組自交系與2個測驗種組配出656份F1雜交組合,對株高相關性狀進行QTL定位,在GCA、F1和SCA分別檢測到21、30和17個QTL,表明三者的遺傳基礎不同。Chen等[16]開發了一套NCⅡ遺傳設計的384份F1構成的水稻雜交種群體對農藝性狀、GCA和SCA進行關聯分析,鑒定到了34個顯著SNP,其中、和的優勢等位基因積累對GCA表現呈正相關。Xiao等[17]利用42 820份F1組成的玉米雜交種群體,利用機器學習和全基因組關聯分析等手段,解析了玉米雜種優勢和配合力的遺傳學基礎,提出了“顯性-互作”的共調控模型。全基因組關聯分析在剖析復雜性狀的遺傳基礎上取得了較大進展,如產量及產量構成因子[18]、抗旱性[19]、品質[20-21]、可變剪切[22]、可塑性[23]等,成為復雜數量性狀遺傳研究的一種主流技術手段。【本研究切入點】目前,對配合力的遺傳基礎以及利用雜交種F1代開展數量遺傳學分析仍比較少,尚未有相關基因被克隆,較多研究集中在QTL定位,但由于群體多樣性限制使其不能完全剖析SCA的遺傳基礎。【擬解決的關鍵問題】本研究基于NCII遺傳設計以陜A群和陜B群選育的85份玉米自交系為親本,組配了246份F1雜交組合,在3個環境下對參試材料進行配合力評價和鑒定,并對產量及其配合力進行全基因組關聯分析,挖掘與產量、產量GCA和SCA顯著相關的SNP,最后結合功能注釋預測相應的基因,以期挖掘產量雜種優勢位點進行功能分析并開發相應的標記應用于玉米分子輔助設計育種。
1 材料與方法
1.1 試驗材料與田間設計
所涉及的85份玉米自交系均來源于西北旱區玉米生物學與遺傳育種重點實驗室自主創建的陜A群和陜B群選育的玉米自交系。采用NCII遺傳設計,于2017年冬季在西北農林科技大學海南三亞南繁基地(109.20°E,18.40°N)進行雜交測配,獲得246份F1雜交組合。具體為:1)以陜A群的KA064、KA105和91227為測驗種與陜B群的61份自交系為被測系進行組配產生183份F1雜交組合;2)以陜B群的KB106、KB207和KB588作為測驗種與陜A群的21份自交系為被測系進行組配產生63份F1雜交組合(電子附表1)。246份F1雜交組合分別于2018年4月在榆林(109.78°E,38.24°N)和旬邑(108.33°E,35.11°N)、6月在楊凌(108.05°E,34.31°N)3個環境下種植,采用α-格子設計,2次重復,密度為90 000株/hm2,每小區4行,行長5 m,行距0.6 m。各環境田間管理措施同當地大田生產管理一致。
1.2 田間產量性狀調查與數據分析
成熟期收獲小區中間兩行玉米果穗,稱量總鮮重記為W,總穗數為N,計算平均單穗鮮重W/N,根據平均單穗鮮重挑選出10個均勻果穗,自然晾曬后脫粒,稱量籽粒干重,用PM-8188谷物水分測定儀測定玉米籽粒的含水量,折合成14%標準收獲含水量后計算小區產量,用kg·hm-2表示。產量(kg hm-2)=單穗籽粒干重(kg)×收獲行有效株數×(1-籽粒含水量)/(1-14%)/兩行小區面積(m2)×10000。利用QTL IciMapping[24]和R語言(https://cran.r-project.org/)對原始數據進行描述性統計、相關性分析、方差分析。廣義遺傳力(broad-sense heritability,2)按照Knapp等[25]提出的公式2=g2/(σ2+σ2/+σ2/)計算,其中,σ2為遺傳方差,σ2為基因型與環境互作方差,σ2為誤差方差,為環境數,為重復。使用最佳線性無偏估計值(best linear unbiased estimator,BLUE)作為F1產量性狀的表型值,以最大降低環境等因素對每個材料產量造成的偏差。同時用R包sommer[26]對246個F1雜交組合的產量SCA以及被測系的產量GCA進行計算,GCA和SCA的計算公式[27]分別為:GCA=-;SCA=-GCA--,其中為自交系組配所有F1的表型均值,為自交系與自交系組配的F1的表型值,GCA為親本的GCA,GCA為親本的GCA,為所有F1的表型均值,并同時對配合力進行了相關性分析。本研究對82份被測系的產量GCA(統稱為被測系GCA)、246份F1雜交組合的產量BLUE值(統稱為F1產量BLUE)和SCA(統稱為SCA)進行后續分析。
1.3 基因型提取檢測與SNP質量控制
每份自交系隨機挑取10株五葉期幼嫩葉片,-80℃保存,用于DNA提取與基因型檢測。采用改良的CTAB法[28]提取DNA,之后通過瓊脂糖凝膠電泳、凝膠成像儀、紫外分光光度計(Nanodrop2000,Thermo Scientific)等檢測儀器和技術進行DNA質量和濃度測定,檢測合格后使用Affymetrix maize 6H90K芯片(北京康普森生物技術有限公司)進行基因分型。被測系使用基因型為以缺失率>0.2,最小等位基因頻率(minor allele frequency,MAF)<0.05的標準質控后獲得的63 879個高質量SNP。雜交種基因型由雙親基因型推算獲得,具體方法為:將親本中雜合基因位點均記為缺失并使用VCFtools工具[29]剔除缺失率>0.2的SNPs后使用Beagle軟件[30]進行填補,基于雙親基因型對F1基因型進行推算,對推算所得SNPs按照MAF<0.05,缺失率>0.2進行過濾,最終獲得55 951個高質量SNP。
1.4 聚類分析和主成分分析
基于MEGA-X[31]中的NJ(neighbor joining)法[32]構建親本發育樹,并在iTOL[33]中進行可視化。親本和F1群體的主成分分析通過GCTA[34]進行計算,在R語言中可視化。
1.5 全基因組關聯分析
使用R包GAPIT[35]中的BLINK方法[36]對被測系GCA、F1產量BLUE和SCA進行全基因組關聯分析。由于F1群體的基因型高度雜合,受加性和非加性效應共同影響,基因型的加性編碼不能反映非加性效應,根據Huang等[37]基因型編碼方式對F1群體的基因型進行重新編碼,具體為(1)顯性編碼方式:將雜合等位基因型改為主等位基因型;(2)隱性編碼方式:將雜合等位基因型改為次等位基因型,并將2種編碼方式統一表示為顯性模型。后分別進行加性、非加性F1相關性狀的全基因組關聯分析。為了控制假陽性,根據Gao等[38]提出的方法對有效標記數(N)進行計算得到720個有效標記,并按照閾值=-log10(0.1/N)的標準將閾值確定為3.86,以此篩選顯著SNP,同時對顯著SNP按照2>0.6的標準篩選連鎖位點,保留其中值較小的SNP。以顯著SNP在玉米B73參考基因組(ZmB73_RefGen_v3; http:// www.maizeGDB.org/)中的物理位置最近的基因為候選基因,進行功能注釋。
2 結果
2.1 產量統計分析及方差分析
通過對同一環境下2個重復間的產量進行相關性分析,結果顯示,3個環境下的兩重復間產量數據均達到極顯著相關水平(榆林=0.74**、旬邑=0.76**、楊凌=0.38**),楊凌點重復區組效應較大,遠大于榆林和旬邑。同時,夏播的楊凌點產量均值(9 407.47 kg·hm-2)顯著低于春播點的榆林(15 663.80kg·hm-2)和旬邑(14 076.95kg·hm-2),且楊凌2個重復的變異幅度(13%和15%)均較大。在3個環境下,群體產量的變異幅度均大于5%(表1),說明試驗群體的產量在不同環境下均具有廣泛的變異;偏度和峰度的絕對值均處于0—1,說明不同環境下不同材料的產量分布均服從正態分布,且為一個典型的數量性狀。方差分析表明基因型、環境、基因型環境互作3種效應均達到了極顯著水平,F1群體的廣義遺傳力為59.04%,說明不同材料間的遺傳背景差異顯著,產量性狀受環境效應影響極大,且3個環境的效應差異顯著;產量性狀受遺傳效應、環境效應和基因環境互作效應共同調控。因此,為了更好地進行后續的全基因組關聯,使用BLUE值作為表型,最大程度上降低環境效應對遺傳效應的影響。
2.2 配合力評價
被測系GCA和雜交種SCA統計分析(表2)可知SCA效應范圍(-1 772.11—1 621.62)遠大于GCA效應變化范圍(-565.87—316.87),其受非加性效應影響。GCA和SCA的偏度和峰度絕對值均小于1(表2),說明GCA和SCA的分布符合正態分布。對GCA、SCA和F1群體的產量BLUE值進行相關性分析(表2),結果表明,GCA、SCA和產量三者之間均呈現極顯著相關,其中,GCA和SCA的相關系數(=0.51)最低,說明二者作用方式存在差異。不同測驗種與其組配的F1雜交組合產量的比較(圖1)表明,不同測驗種表現出的雜種優勢有所差異,如測驗種KA105具有較高產量,其組配F1雜交組合的產量也在群體中處于較高水平,而測驗種KB106及其子代產量均處于較低水平,說明高產自交系更容易組配出高產組合。

表1 雜交種群體產量描述統計分析和方差分析
*:在<0.05水平差異顯著;**:在<0.01水平差異極顯著。BLUE:最佳線性無偏估計。SD:標準偏差。CV:變異系數。下同
*: significance at<0.05; **: significance at<0.01. BLUE: Best linear unbiased estimator; SD: Standard deviation; CV: Coefficient of variation. The same as below
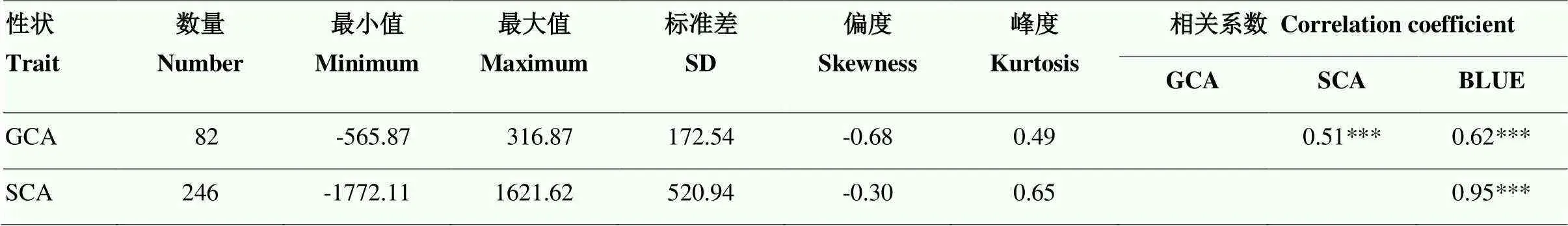
表2 配合力基本統計分析
GCA:一般配合力;SCA:特殊配合力;***:在<0.001水平差異顯著。下同
GCA: general combining ability; SCA: special combining ability; ***: significance at<0.001. The same as below

圖1 測驗種及其組配F1雜交組合產量比較分析
測驗種KA105和KB588的產量和及其組配的F1雜交組合的產量高于同組其他2個測驗種,說明KA105和KB588具有更優的產量遺傳背景。按照自交系類群,對82份被測系的GCA進行評價(圖2)發現,具有正向GCA效應的自交系共46份,占被測系總體的56%,其中,源于陜A群被測系16份,約占陜A群總體的76.19%;源于陜B群被測系30份,約占陜B群總體的49.18%。在整體上,陜A群被測系的GCA也呈現高于陜B群的趨勢(圖2),說明陜A群選育自交系具有GCA高的遺傳背景。

圖2 源于陜A群、陜B群的82個被測系GCA評價
2.3 群體遺傳特征分析
利用高通量SNPs標記對85份親本進行聚類分析(圖3-A),結果顯示,源于陜A群選育的自交系與源于陜B群選育的自交系可以較好地區分開,總體分為3類,即一類源自陜A群的親本;一類為源自陜B群選育的自交系;另一類為源自陜A群和陜B群選育自交系的混合群。主成分分析表明(圖3-B),陜A群和陜B群選育自交系可以大致的分為2組,陜A群選育自交系位于第一象限且分布較為集中,陜B群選育自交系群體更大分布范圍廣,總體上向2個方向散布于二、三、四象限,該結果再次印證了源自陜B群的材料群體大,遺傳背景更為豐富。同時測驗種在親本遺傳背景的分布較為均衡(圖3-A中測驗種被標注為“T”;圖3-B中測驗種用黑色星號標出),說明本研究測驗種選擇合理,通過陜A群和陜B群之間的組配一定程度上降低了群體結構對全基因組關聯分析的影響。
2.4 產量及其配合力的全基因組關聯分析
基于BLINK對被測系GCA、F1產量BLUE值和SCA進行全基因組關聯分析(圖4)。由于該方法遵循加性編碼的基因型編碼方式,而產量以及SCA存在非加性效應,基因型加性編碼無法定位到非加性效應的位點,因此,本研究在F1群體中同時開展了對基因型加性編碼(additive,ADD)和非加性編碼(dominant,DOM)的全基因組關聯分析,并按照閾值-log10()>3.86對顯著SNPs進行篩選。當使用加性編碼基因型進行F1全基因關聯分析時,在F1產量BLUE和SCA中各定位到1個顯著SNP,解釋表型變異率分別為1.55%和1.77%。當使用非加性編碼基因型進行全基因關聯分析時,在F1產量BLUE和產量SCA中的顯著SNP分別為6和8個。非加性模型較加性模型檢測到的顯著SNP多,表明在加性模型下某些非加性效應會被掩蓋而難以體現,以非加性進行基因型編碼可以檢測到非加性效應位點。同時以82個被測系的產量GCA為目標性狀開展全基因組關聯分析,共檢測到5個顯著SNP。除此之外,加性模型下得到的Affx-291424805,非加性模型下的Affx-291385286、Affx-88980445和Affx-291431456,4個顯著SNP在產量BLUE和SCA均被定位(表3)。
從顯著SNPs分布來看,被測系GCA相關的顯著SNPs較少且集中于第4染色體,但表型解釋率較大(7.97%—23.37%);F1產量BLUE和SCA挖掘得到的顯著SNP多數集中于第2和第10染色體,數目多但貢獻率較低(0.43%—6.31%)。被測系GCA和雜交種SCA不存在共定位的結果,說明被測系GCA與F1產量和SCA的遺傳基礎是不同的,加性效應決定了GCA表現,而SCA更多的是由非加性效應的微效多基因共同作用。

A:聚類分析;B:主成分分析 A: Clustering analysis; B: Principal component analysis

A:被測系GCA;B:基于加性模型的F1產量BLUE;C:基于顯性模型的F1產量BLUE;D:基于加性模型的雜交種SCA;E:基于顯性模型的雜交種SCA

表3 產量及其配合力顯著關聯的SNP信息
●、■、▲、★均表示共定位 ●, ■, ▲, ★ all represent the same SNPs
2.5 顯著SNP分析及候選基因預測
對不同性狀關聯位點的優勢等位基因型分析發現(表4和圖5),4個GCA關聯的SNP(SNP_1、SNP_2、SNP_3和SNP_5),其GCA的有利等位基因在F1產量BLUE和SCA中仍然表現為純合基因型,說明這些位點可能完全或主要受加性效應控制;與GCA關聯的SNP_4在被測系GCA中表現為AA>GG,在F1產量BLUE和SCA中雜合位點GCA與純合位點GG無顯著差異,說明該位點主要受加性控制。隨著有利等位基因數量的增加,被測系GCA也呈現上升趨勢,說明可以通過有利等位基因的聚合提高自交系的GCA。
F1產量BLUE關聯位點在性狀的表現形式分為4種;1)純合基因型的表型無差異,雜合基因型為最優基因型,且只與低值純合基因型差異顯著,包括(SNP_6、SNP_8、SNP_9、SNP_14和SNP_16);2)純合基因型的表型無差異,雜合基因型為最優基因型,且只與2個純合基因型均表現為差異顯著,包括(SNP_12和SNP_15);3)純合基因型的表型無差異,雜合基因型為最差基因型,且只與高值純合基因型差異顯著,包括(SNP_7、SNP_10和SNP_11);4)純合基因型的表型有差異,同時雜合基因型與高值純合基因型的表型無差異,與低值基因型的表型存在顯著差異(SNP_17)。由此可知,所關聯的大部分位點的雜合基因型的表型與某1個或者2個純合位點存在表型差異,說明F1產量BLUE關聯的位點以顯性效應為主,而不同基因型的表型分析也說明存在一定的加性效應。GCA檢測的位點與F1產量和SCA無共定位,這說明產量GCA的遺傳基礎不同于F1產量BLUE和SCA,更可能是由加性效應為主效應的一個性狀。通過對GCA顯著關聯位點的等位基因型的累加效應分析發現(圖6),對產量及其GCA和SCA顯著關聯的SNP,結合maizeGDB數據庫(http://www.maizeGDB.org/)以關聯位點最近的基因為候選基因進行篩選,共得到17個相關的候選基因并對其進行了功能注釋(表5)。


表4 顯著位點效應分析
CO_ADD和CO_DOM分別表示基于加性和顯性模型在F1和SCA中獲得的共定位結果;D:顯性效應;A:加性效應
CO_ADD and CO_DOM respectively indicate a co-SNP based on additive and dominant models in F1and SCA; D: dominant effect; A: additive effect
3 討論
3.1 產量及其配合力遺傳基礎解析
配合力在育種實踐中的重要作用使得解析配合力的遺傳基礎必不可少,本研究通過對配合力的分析,發現GCA和SCA的相關性較低,在關聯分析中兩者也未檢測到相同區域SNP,表明控制GCA與SCA的遺傳位點可能是不同的,這與Qi等[13]研究結果是一致的。對于產量性狀和配合力的關系,Zhou等[39]研究顯示GCA和SCA都對F1表型具有一定貢獻。本研究中F1產量與其SCA相關性較高,且2個性狀間存在4個共定位,分別占F1產量和SCA顯著SNP總數的57.14%和44.44%,印證了其研究結論,表明二者遺傳基礎存在一定相似性。當使用加性模型對產量及其配合力進行關聯分析時,GCA得到5個顯著SNP且貢獻率較大(23.37%—7.97%),F1產量和SCA僅各定位到1個SNP;而在顯性模型中F1產量和SCA各有6個、8個顯著SNP被檢測到,說明了加性模型并不適用于雜交種的關聯分析,這與Chen等[16]研究結果類似。同時也說明產量SCA和GCA遺傳效應的不同,SCA以非加性效應為主,而GCA以加性效應為主。

圖6 被測系GCA有利等位基因富集效應分析

表5 候選基因預測
超顯性假說[40]認為雜種優勢是由于雜合等位基因間的相互作用大于純合等位基因間的相互作用而形成的,雜種優勢歸因于雙親的基因異質性,與等位基因的顯隱性無關。梁文科等[41]認為GCA主要遵循加性遺傳,SCA遺傳基礎以非加性效應中的顯性效應為主。本研究對顯著SNP結合其在不同性狀的有利基因進行了區分,將在F1中表現為雜合優勢的標為顯性效應(D);表現和GCA相同的標為加性效應(A)。本研究發現SCA顯著SNP絕大多數(88.89%)表現出雜合優勢,F1產量顯著SNP有57.14%表現為雜合優勢,GCA顯著SNP幾乎不表現雜合優勢,說明SCA和雜種優勢有一定的緊密關系,但又有所區別[42-44]。同時通過GCA顯著SNP進行有利等位基因聚合,證實親本自交系所含的有利基因位點數和其GCA呈顯著正相關,這部分效應可以穩定遺傳給后代,即育種家可通過有利等位基因的累積選育GCA高的玉米自交系。
3.2 全基因組關聯分析在雜交種群體中的應用
隨著數量遺傳學的不斷發展,研究人員創制了不同植物的各種雙親、多親以及自然群體應用于數量性狀的基因挖掘。在玉米中常見的農藝性狀多數為復雜的數量性狀,由不同自交系組成的群體正在使用全基因組關聯分析對該類性狀的遺傳基礎進行解析。但實際上,基于自交系的全基因組關聯分析并不能直接應用于剖析F1群體的遺傳基礎,而玉米生產中應用的卻是雜交種,對雜交種的研究能更直觀地解決實際問題。雜交種進行全基因組關聯分析在水稻研究中應用較多,Huang等[37]使用了1 495份雜交水稻品種及其自交系構建了高密度的基因組圖譜,通過全基因組關聯分析檢測了38個農藝性狀的130個顯著SNP。小麥中,Jiang等[45]在11個環境下對1 604份冬小麥雜交種及其135份親本的產量進行了全基因組關聯分析,表明了上位性效應在小麥產量雜種優勢中的作用高于顯性效應。玉米中,Romero等[46]基于全基因組關聯分析對4 471份玉米自交系和3 552份F1群體的開花性狀以及可塑性進行研究。本研究利用85份自交系通過NCⅡ遺傳設計產生了246份雜交組合組成的F1群體被用于全基因組關聯分析。與傳統的自交系創制群體相比,F1群體的環境適應性更強,提高了多環境測試的可行性。同時在進行基因型測序時,由于只有親本自交系可以進行基因分型,雜種子代的基因型是通過雙親基因型進行推斷,因此,使用F1群體可以降低基因分型的成本。目前,擴大群體規模成為提高檢測精度的重要手段,F1群體的應用可以極大簡化大規模群體創制流程。但是當前全基因組關聯分析主流的軟件算法多數僅考慮加性效應且適用于純合群體的分析,雜交種群體并不適用,本研究中使用加性模型對F1群體定位僅得到較少的位點,而顯性模型更加適合雜交種群體分析,未來開發適用于雜交種群體的全基因組關聯分析并能同時分析加性、顯性、上位性效應的新研究手段是有必要的。
3.3 候選基因分析
本研究對17個候選基因結合其在玉米不同器官表達的特異性以及前人研究進行了分析。其中在GCA的SNP_3區間中檢測到的(),擬南芥中的同源基因在側生器官發育中特異表達,并調控下游影響遠軸發育的轉錄因子[47-48]。SNP_5區間內的在玉米各個器官的表達量均較高[49-50],表明該基因對玉米各個生育階段均十分重要,同時它與玉米雄穗分支數顯著關聯[51]。產量和產量SCA共定位的結果中,位于SNP_6區間,其編碼木葡聚糖醛酸β-1,3-木糖基轉移酶,被認為和玉米株高相關[52];位于SNP_8區間內,根據表達譜顯示它在未授粉的雌穗和正常發育的胚中高表達[49-50],并且其水稻同源基因編碼染色體濃縮調節蛋白。在與產量性狀顯著關聯的SNP_12區間內定位到了候選基因,其與玉米果穗發育和根長有關[53-54]。在SCA關聯的SNP_13區間內檢測到的()參與玉米光周期反應,與花期相關生理過程密切相關[55];SNP_16區間候選基因在授粉后生殖生長階段的胚中特異性表達[49-50];SNP_17區間內的被認為是一個與粒寬相關的基因,與玉米籽粒建成密切相關[56]。
4 結論
陜A群和陜B群選育玉米自交系組配F1群體的GCA和SCA共同影響雜交種的產量,且SCA的效應對雜交種的產量影響要大于GCA,育種中作為母本的陜A群選育玉米自交系具有更高的GCA。雜交種產量受加性和非加性效應共同影響,非加性模型對檢測雜交種位點具有更高的效率;同時GCA和SCA可能具有不同的遺傳基礎,GCA受加性效應主導可穩定遺傳,且隨其有利等位基因的富集而提高,SCA主要受非加性效應影響。產量及其配合力相關的候選基因在玉米生長發育和籽粒建成中特異性表達。
[1] 李少昆, 趙久然, 董樹亭, 趙明, 李潮海, 崔彥宏, 劉永紅, 高聚林, 薛吉全, 王立春, 王璞, 陸衛平, 王俊河, 楊祁峰, 王子明. 中國玉米栽培研究進展與展望. 中國農業科學, 2017, 50(11): 1941-1959.
LI S K, ZHANG J R, DONG S T, ZHAO M, LI C H, CUI Y H, LIU Y H, GAO J L, XUE J Q, WANG L C, WANG P, LU W P, WANG J H, YANG Q F, WANG Z M. Advances and prospects of maize cultivation in China. Scientia Agricultura Sinica, 2017, 50(11): 1941-1959. (in Chinese)
[2] 李鵬, 白永新, 張潤生, 魏振飛, 張建華. 淺議我國玉米育種發展現狀與方向. 種子科技, 2019, 37(2): 18-19.
LI P, BAI Y X, ZHANG R S, WEI Z F, ZHANG J H. Discussion on the development status and direction of maize breeding in China. Seed science and technology, 2019, 37(2): 18-19. (in Chinese)
[3] Birchler J A, Auger D L, Riddle N C. In search of the molecular basis of heterosis. The Plant cell, 2003, 15(10): 2236-2239.
[4] Birchler J A, Yao H, Chudalayandi S. Unraveling the genetic basis of hybrid vigor. Proceedings of the National Academy of Sciences of the USA, 2006, 103(35): 12957.
[5] Birchler J A, Yao H, Chudalayandi S, Vaiman D, Veitia R A. Heterosis. The Plant cell, 2010, 22(7): 2105-2112.
[6] 堵純信, 曹春景, 曹青, 畢蒙蒙, 董戰鯤, 張發林. 玉米雜交種鄭單958的選育與應用. 玉米科學, 2006(6): 43-45+49.
DU C X, CAO C J, CAO Q, BI M M, DONG Z K, ZHANG F L. The breeding and application of maize hybrid Zhengdan 958. Journal of Maize Sciences, 2006(6): 43-45+49. (in Chinese)
[7] 釧興寬. 配合力理論及其在水稻育種中的應用. 種子, 2014, 33(6): 39-41+46.
CHUAN X K. Combining ability theory and its application in rice breeding. Seed, 2014, 33(6): 39-41+46. (in Chinese)
[8] Sprague G, Tatum L. General vs. specific combining ability in single crosses of corn. Agronomy Journal, 1942, 34: 923-932.
[9] 李明順, 張世煌, 李新海, 潘光堂, 白麗, 彭澤斌. 根據產量特殊配合力分析玉米自交系雜種優勢群. 中國農業科學, 2002, 35(6): 600-605.
LI M S, ZHANG S H, LI X H, PAN G T, BAI L, PENG Z B. Study on heterotic groups among maize inbred lines based on SCA. Scientia Agricultura Sinica, 2002, 35(6): 600-605. (in Chinese)
[10] 楊愛國, 張世煌, 李明順, 榮廷昭, 潘光堂. CIMMYT和我國玉米種質群體的配合力及雜種優勢分析. 作物學報, 2006, 32(9): 1329-1337.
YANG A G, ZHANG S H, LI M S, RONG T Z, PAN G T. Combining ability and heterosis of 14 CIMMYT and 13 domestic maize populations in an NCⅡ mating design. Acta Agronomica Sinica, 2006, 32(9): 1329-1337. (in Chinese)
[11] Griffing B. Concept of general and specific combining ability in relation to diallel crossing systems. Australian Journal of Biological Sciences, 1955, 9: 463-493.
[12] Lü A Z, Zhang H, Zhang Z X, Tao Y S, Yue B, Zheng Y L. Conversion of the statistical combining ability into a genetic concept. Journal of Integrative Agriculture, 2012, 11(1): 43-52.
[13] Qi H, Huang J, Zheng Q, Huang Y, Shao R, Zhu L, Zhang Z, Qiu F, Zhou G, Zheng Y, Yue B. Identification of combining ability loci for five yield-related traits in maize using a set of testcrosses with introgression lines. Theoretical and Applied Genetics, 2013, 126(2): 369-377.
[14] Wang H, Xu C, Liu X, Guo Z, Xu X, Wang S, Xie C, Li W X, Zou C, Xu Y. Development of a multiple-hybrid population for genome-wide association studies: Theoretical consideration and genetic mapping of flowering traits in maize. Scientific Reports, 2017, 7(1): 40239.
[15] Zhou Z, Zhang C, Lu X, Wang L, Hao Z, Li M, Zhang D, Yong H, Zhu H, Weng J, Li X. Dissecting the genetic basis underlying combining ability of plant height related traits in maize. Frontiers in plant science, 2018, 9: 1117.
[16] Chen J, Zhou H, Xie W, Xia D, Gao G, Zhang Q, Wang G, Lian X, Xiao J, He Y Q. Genome-wide association analyses reveal the genetic basis of combining ability in rice. Plant Biotechnology Journal, 2019, 17(11): 2211-2222.
[17] Xiao Y, Jiang S, Cheng Q, Wang X, Yan J, Zhang R, Qiao F, Ma C, Luo J, Li W, Liu H, Yang W, Song W, Meng Y, Warburton M, Zhao J, Wang X, Yan J. The genetic mechanism of heterosis utilization in maize improvement. Genome Biology, 2021, 22(1): 148.
[18] Huang X, Yang S, Gong J, Zhao Q, Feng Q, Zhan Q, Zhao Y, Li W, Cheng B, Xia J, Chen N, Huang T, Zhang L, Fan D, Chen J, Zhou C, Lu Y, Weng Q, Han B. Genomic architecture of heterosis for yield traits in rice. Nature, 2016, 537(7622): 629-633.
[19] Wang H, Qin F. Genome-wide association study reveals natural variations contributing to drought resistance in crops. Frontiers in Plant Science, 2017, 8: 1110.
[20] Li H, Peng Z, Yang X, Wang W, Fu J, Wang J, Han Y, Chai Y, Guo T, Yang N, Liu J, Warburton M L, Cheng Y, Hao X, Zhang P, Zhao J, Liu Y, Wang G, Li J, Yan J. Genome-wide association study dissects the genetic architecture of oil biosynthesis in maize kernels. Nature Genetics, 2013, 45(1): 43-50.
[21] Li X, Wang M, Zhang R, Fang H, Fu X, Yang X, Li J. Genetic architecture of embryo size and related traits in maize. The Crop Journal, 2022, 10(1): 204-215.
[22] Chen Q, Han Y, Liu H, Wang X, Sun J, Zhao B, Li W, Tian J, Liang Y, Yan J, Yang X, Tian F. Genome-wide association analyses reveal the importance of alternative splicing in diversifying gene function and regulating phenotypic variation in maize. The Plant Cell, 2018, 30(7): 1404-1423.
[23] Liu N, Du Y, Warburton M, Xiao Y, Yan J. Phenotypic plasticity contributes to maize adaptation and heterosis. Molecular Biology and Evolution, 2020, 38(4): 1262-1275.
[24] Meng L, Li H, Zhang L, Wang J. QTL IciMapping: Integrated software for genetic linkage map construction and quantitative trait locus mapping in biparental populations. The Crop Journal, 2015, 3(3): 269-283.
[25] Knapp S J, Stroup W W, Ross W M. Exact confidence intervals for heritability on a progeny mean basis. Crop Science,1985, 25(1): 192-194.
[26] Covarrubias-Pazaran G. Genome-assisted prediction of quantitative traits using the R package sommer. PloS one, 2016: e0156744.
[27] 黃遠樟, 劉來福. 作物數量遺傳學基礎: 六、配合力: 不完全雙列雜交. 遺傳, 1980(2): 43-46.
HUANG Y Z, LIU L F. Basis of crop quantitative genetics: VI. combining ability: incomplete diallel hybridization. Genetics, 1980(2): 43-46. (in Chinese)
[28] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA. Nucleic acids research, 1980, 8(19): 4321-4325.
[29] Danecek P, Auton A, Abecasis G, Albers C A, Banks E, Depristo M A, Handsaker R E, Lunter G, Marth G T, Sherry S T, Mcvean G, Durbin R. 1000 genomes project analysis group. The variant call format and VCFtools. Bioinformatics (Oxford, England), 2011, 27(15): 2156-2158.
[30] Ayres D L, Darling A, Zwickl D J, Beerli P, Holder M T, Lewis P O, Huelsenbeck J P, Ronquist F, Swofford D L, Cummings M P, Rambaut A, Suchard M A. BEAGLE: an application programming interface and high-performance computing library for statistical phylogenetics. Systematic biology, 2012, 61(1): 170-173.
[31] Kumar S, Stecher G, Li M, Knyaz C, Tamura K. MEGA X: Molecular evolutionary genetics analysis across computing platforms. Molecular biology and evolution, 2018, 35(6): 1547-1549.
[32] Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees. Molecular Biology and Evolution, 1987, 4(4): 406-425.
[33] Letunic I, Bork P. Interactive tree of life (iTOL): an online tool for phylogenetic tree display and annotation. Bioinformatics, 2007, 23(1): 127-128.
[34] Yang J, Lee S H, Goddard M E, Visscher P M. GCTA: a tool for genome-wide complex trait analysis. American journal of human genetics, 2011, 88(1): 76-82.
[35] Lipka A E, Tian F, Wang Q, Peiffer J, Li M, Bradbury P J, Gore M A, Buckler E S, Zhang Z. GAPIT: genome association and prediction integrated tool. Bioinformatics (Oxford, England), 2012, 28(18): 2397-2399.
[36] Huang M, Liu X, Zhou Y, Summers R M, Zhang Z. BLINK: a package for the next level of genome-wide association studies with both individuals and markers in the millions. Giga Science, 2019, 8(2): 154.
[37] Huang X, Yang S, Gong J, Zhao Y, Feng Q, Gong H, Li W, Zhan Q, Cheng B, Xia J, Chen N, Hao Z, Liu K, Zhu C, Huang T, Zhao Q, Zhang L, Fan D, Zhou C, Lu Y, Weng Q, Wang Z X, Li J, Han B. Genomic analysis of hybrid rice varieties reveals numerous superior alleles that contribute to heterosis. Nature Communications, 2015, 6(1): 6258.
[38] Gao X, Starmer J, Martin E R. A multiple testing correction method for genetic association studies using correlated single nucleotide polymorphisms. Genetic Epidemiology, 2008, 32(4): 361-369.
[39] Zhou H, Xia D, Zeng J, Jiang G, He Y. Dissecting combining ability effect in a rice NCII-III population provides insights into heterosis in indica-japonica cross. Rice, 2017, 10(1): 39.
[40] Shull G H. The composition of a field of maize. Journal of Heredity, 1908, 4(1): 296-301.
[41] 梁文科, 張世煌, 戚廷香, 邱法展, 庹洪章, 劉永忠, 鄭用璉, 徐尚忠. 熱帶溫帶玉米群體產量性狀遺傳力及遺傳方差分量的剖析. 中國農業科學, 2006, 39(11): 2178-2185.
LIANG W K, ZHANG S H, QI T X, QIU F Z, TUO H Z, LIU Y Z, ZHENG Y L, XU S Z. Dissection of heritability and genetic variance components for yield traits in tropical and temperate maize populations. Scientia Agricultura Sinica, 2006, 39(11): 2178-2185. (in Chinese)
[42] Makumbi D, Betrán J F, B?nziger M, Ribaut J M. Combining ability, heterosis and genetic diversity in tropical maize (L.) under stress and non-stress conditions. Euphytica, 2011, 180(2): 143-162.
[43] Zhang X, Lv L, Lv C, Guo B, Xu R. Combining ability of different agronomic traits and yield components in hybrid barley. PloS one, 2015: e0126828.
[44] 倪先林, 張濤, 蔣開鋒, 楊莉, 楊乾華, 曹應江, 文春陽, 鄭家奎. 雜交稻特殊配合力與雜種優勢、親本間遺傳距離的相關性. 遺傳, 2009, 31(8): 849-854.
NI X L, ZHANG T, JIANG K F, YANG L, YANG Q H, CAO Y J, WEN C Y, ZHENG J K. Correlations between specific combining ability, heterosis and genetic distance in hybrid rice. Genetics, 2009, 31(8): 849-854. (in Chinese)
[45] Jiang Y, Schmidt R H, Zhao Y, Reif J C. A quantitative genetic framework highlights the role of epistatic effects for grain- yield heterosis in bread wheat. Nature Genetics, 2017, 49(12): 1741-1746.
[46] Romero N J A, Willcox M, Burgue?o J, Romay C, Swarts K, Trachsel S, Preciado E, Terron A, Delgado H V, Vidal V, Ortega A, Banda A E, Montiel N O G, Ortiz-Monasterio I, Vicente F S, Espinoza A G, Atlin G, Wenzl P, Hearne S, Buckler E S. A study of allelic diversity underlying flowering-time adaptation in maize landraces. Nature Genetics, 2017, 49(3): 476-480.
[47] Eshed Y, Baum S F, Perea J V, Bowman J L. Establishment of polarity in lateral organs of plants. Current Biology, 2001, 11(16): 1251-1260.
[48] Eshed Y, Izhaki A, Baum S F, Floyd S K, Bowman J L. Asymmetric leaf development and blade expansion inare mediated by KANADI and YABBY activities. Development, 2004, 131(12): 2997-3006.
[49] Hoopes G M, Hamilton J P, Wood J C, Esteban E, Pasha A, Vaillancourt B, Provart N J, Buell C R. An updated gene atlas for maize reveals organ-specific and stress-induced genes. The Plant Journal, 2019, 97(6): 1154-1167.
[50] Stelpflug S C, Sekhon R S, Vaillancourt B, Hirsch C N, Buell C R, De Leon N, Kaeppler S M. An expanded maize gene expression atlas based on RNA sequencing and its use to explore root development. Plant Genome, 2016, 9(1): 38-54.
[51] Wu X, Li Y, Shi Y, Song Y, Zhang D, Li C, Buckler E S, Li Y, Zhang Z, Wang T. Joint-linkage mapping and GWAS reveal extensive genetic loci that regulate male inflorescence size in maize. Plant Biotechnology Journal, 2016, 14(7): 1551-1562.
[52] Peiffer J A, Romay M C, Gore M A, Flint-Garcia S A, Zhang Z, Millard M J, Gardner C A, Mcmullen M D, Holland J B, Bradbury P J, Buckler E S. The genetic architecture of maize height. Genetics, 2014, 196(4): 1337-1356.
[53] Peiffer J A, Flint-Garcia S A, De Leon N, Mcmullen M D, Kaeppler S M, Buckler E S. The genetic architecture of maize stalk strength. PLoS One, 2013, 8(6): e67066.
[54] Wang Q J, Yuan Y, Liao Z, Jiang Y, Wang Q, Zhang L, Gao S, Wu F, Li M, Xie W, Liu T, Xu J, Liu Y, Feng X, Lu Y. Genome-wide association study of 13 traits in maize seedlings under low phosphorus stress. Plant Genome, 2019, 12(3): 1-13.
[55] Dong M Y, Lei L, Fan X W, Li Y Z. Analyses of open-access multi-omics data sets reveal genetic and expression characteristics of maize ZmCCT family genes. AoB Plants, 2021, 13(5): plab048.
[56] Zhu X M, Shao X Y, Pei Y H, Guo X M, Li J, Song X Y, Zhao M A. Genetic diversity and genome-wide association study of major ear quantitative traits using high-density SNPs in maize. Front Plant Science, 2018, 9: 966.
Genome-Wide Association Analysis of Yield and Combining Ability Based on Maize Hybrid Population
LI ZhouShuai, DONG Yuan, LI Ting, FENG ZhiQian, DUAN YingXin, YANG MingXian, XU ShuTu, ZHANG XingHua, XUE JiQuan
College of Agronomy, Northwest A&F University/Key Laboratory of Biology and Genetic Improvement of Maize in Arid Area of Northwest Region, Yangling 712100, Shaanxi
【】By analyzing the yield of the hybrids from the inbred lines bred from the Shaan A and Shaan B group, the combining ability of the inbred lines were evaluated, genome-wide association analysis, and mining associated loci for yield and its combining ability conducted. It will provide references for improving maize inbred lines selected from Shaan A group and Shaan B group and applying them in varieties breeding. 【】Based on NCⅡ genetic design, 85 excellent inbred lines from Shaan A group and Shaan B group were used to construct a hybrid population containing 246 F1. Then, the yield of the hybrid population was tested in three environments to evaluate their general combining ability (GCA) and special combining ability (SCA). Using the 6H90K maize array to detect the parental genotypes, 63 879 high-quality SNPs were obtained, which were used to analyze the genetic characteristics of parental lines. According to the parental genotypes, 55 951 high-quality SNPs were inferred in the hybrid population for genome-wide association analysis of hybrid yield, GCA, and SCA using additive model and non-additive model. Meanwhile, candidate genes around the significant SNPs were screened and annotated based on the maize B73 reference genome.【】The yield in the three environments accorded to the normal distribution with wide variation, the broad-sense heritability of yield was 59.04%, and the environmental effect was significant. There was significant positive correlation between hybrid yield and combining ability, and the correlation between hybrid yield and SCA (=0.95) was higher than that between hybrid yield and GCA (=0.62). The genetic characteristic of Shaan A group and Shaan B group was different, and inbred lines from Shaan A group have higher general combining ability. Totally, five, seven and nine significant SNPs were detected (-log10()>3.86) for GCA, hybrid yield and SCA, respectively. Among them, four SNPs were co-located in hybrid yield and SCA. Ultimately, 17 associated SNPs were anchored. Dominant allele analysis of different trait-associated loci showed that four GCA-associated SNPs were controlled by additive effects, and the F1BLUE-associated loci could be divided into 4 types mainly by the dominant effect, and the heterozygous genotype is the favorite allele or sub-optimal allele for yield in F1. Through functional annotation, the candidate genes were specifically expressed in maize growth and kernel establishment, for example,andwere related to maize kernel development. 【】Based on this study, we consider that GCA and SCA jointly affect the yield of hybrids, and the effect of SCA is greater. Moreover, GCA and SCA may have different genetic basis, and GCA can be increased with the accumulation of favorable alleles. Using the genome-wide association analysis in the F1hybrid population can carry out genetic analysis related to combining ability, mine the genetic loci related to yield and combining ability, and accelerated the application of the associated loci in molecular breeding.
maize; hybrids; general combining ability; special combining ability; genome-wide association analysis

10.3864/j.issn.0578-1752.2022.09.001
2021-12-10;
2022-02-08
國家現代農業產業技術體系建設專項(CARS-02-77)
李周帥,E-mail:zhoushuai.li@foxmail.com。通信作者薛吉全,E-mail:xjq2934@163.com。通信作者張興華,E-mail:zhxh4569@163.com
(責任編輯 李莉)

