大鼠肝纖維化病理過程中肝組織SHP2表達與在體肝星狀細胞凋亡的關系
郝禮森 楊小師 張朋壘 陳盼盼 展宗媛 何宇 苗笑佳
含SH2結構域的蛋白酪氨酸磷酸酶2 (SH2 domain-containing protein tyrosine phosphatase 2, SHP2)是一個廣泛表達于人體各個組織和細胞,并具有促癌作用的蛋白酪氨酸磷酸酶,其過表達可通過抑制腫瘤細胞的凋亡參與多種惡性腫瘤的形成及發展[1- 4]。過去對SHP2的研究多集中在腫瘤領域,近年來其在非腫瘤領域的作用也逐漸受到關注。研究發現[5],HBV感染相關的肝細胞癌患者的肝組織中,伴有纖維化的癌旁肝組織SHP2表達增高;另有研究發現,體外活化肝星狀細胞(hepatic stellate cells, HSC)的SHP2表達下調,其增殖受到抑制[6]。而HSC是肝臟的主要纖維生成細胞,在肝纖維化病理過程中發揮重要作用[7-8]。這提示肝纖維化病理過程中肝組織的SHP2表達可能異常,并可能通過影響HSC的生物學行為參與肝纖維化的發病機制,但迄今有關肝纖維化病理過程中肝組織SHP2表達與在體HSC凋亡的關系仍不清楚。本研究采用腹腔注射四氯化碳法建立大鼠肝纖維化模型,探討肝纖維化病理過程中纖維化肝組織的SHP2表達與在體肝星狀細胞凋亡的關系。
材料與方法
一、實驗動物及試劑
清潔級健康雄性 SD大鼠50只(350~400 g/只)由北京華阜康生物科技股份有限公司提供,大鼠均在華北理工大學動物實驗中心按清潔級要求飼養,自由進食水; TUNEL試劑盒購于北京中山生物試劑公司;兔抗 SHP2多克隆抗體購于武漢三鷹生物技術有限公司;小鼠抗α-平滑肌肌動蛋白 (alpha-smooth muscle actin,α-SMA)單克隆抗體購于臺灣arigo公司; Masson染色試劑盒購于北京雷根生物有限公司;SP試劑購于北京中山金橋生物有限公司。
二、方法
(一)實驗分組及大鼠肝纖維化模型的建立 上述SD大鼠50只被隨機分成對照組(10只)、模型組(40只),大鼠肝纖維化模型采用腹腔注射四氯化碳法構建[9-10]。模型組大鼠腹腔注射50%四氯化碳橄欖油混合液,劑量為1 mL/kg,每周2 次,共8周;對照組大鼠腹腔注射生理鹽水,劑量同模型組,每周2 次。在造模 2、4、6、8周分別取模型組大鼠10只,麻醉后切開大鼠腹腔,取適量大鼠肝組織,用4%多聚甲醛固定后用于免疫組織化學及HE、Masson三色染色。對照組大鼠肝組織標本與8周模型組大鼠一同留取。本研究所涉及的動物實驗操作經華北理工大學實驗動物倫理委員會審批。
(二)肝組織病理學及SHP2免疫組織化學染色 大鼠肝組織以4%多聚甲醛溶液固定,石蠟常規包埋并做成5 μm的連續切片,進行HE及Masson三色染色,觀察肝組織病理學變化。應用SP法按試劑操作說明進行SHP2免疫組織化學染色。陰性對照用PBS代替一抗染色,染色結果為棕褐色代表陽性表達。SHP2免疫組化染色圖像應用Image Pro Plus 6.0軟件分析,積分光密度值 (IOD) 被用于表示SHP2陽性表達水平。
(三) α-SMA免疫組織化學及TUNEL雙重染色檢測在體HSC凋亡 肝組織石蠟切片脫蠟及水化后滴加蛋白酶K,然后放于37 ℃烤箱中30 min;滴加3%過氧化氫于室溫下孵育20 min;滴加TUNEL檢測液于37 ℃孵育60 min后用PBS洗5 min,再滴加適量的標記反應終止液于室溫下孵育10 min;滴加Streptavidin-HRP工作液于室溫下孵育30 min;滴加DAB顯色液;滴加封閉液10%山羊血清于37 ℃孵育30 min,然后去除封閉液,滴加一抗小鼠抗α-SMA 單克隆抗體(1∶100稀釋)于4 ℃孵育過夜,取出肝組織切片于室溫下30 min后棄去一抗;滴加HRP標記的山羊抗小鼠IgG(1∶200稀釋)二抗于 37 ℃ 30 min。上述每一處理步驟結束后均用PBS沖洗3次,每次5 min。再次于上述處理的肝組織切片上滴加DAB顯色液,并在出現黃色后立即停止,用自來水沖洗2次(5 min/次)后在蘇木素液中染色及放入10%鹽酸酒精液中并水洗反藍,再用酒精梯度脫水,最后用中性樹膠封片,陰性對照不加末端脫氧核苷酸轉移酶,其余操作不變。將各組染色的肝組織切片放在光鏡下觀察,凋亡活化肝星狀細胞表現為胞質呈棕黃色而胞核呈藍褐色或藍黑色(α-SMA免疫組織化學染色將活化HSC胞漿染成棕黃色,TUNEL染色將凋亡的活化HSC胞核染成藍褐色或藍黑色)。隨機選取5個高倍視野,計數凋亡的活化肝星狀細胞及總的活化肝星狀細胞,并計算凋亡指數(凋亡指數=凋亡的活化肝星狀細胞數/總的活化肝星狀細胞數×100%)。
三、統計學分析
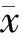
結 果
一、大鼠肝組織病理組織學變化
Masson三色及HE染色顯示,大鼠肝纖維化模型成功構建,隨著造模時間延長,大鼠肝纖維化逐漸加重(圖1)。
二、大鼠肝組織的SHP2表達變化
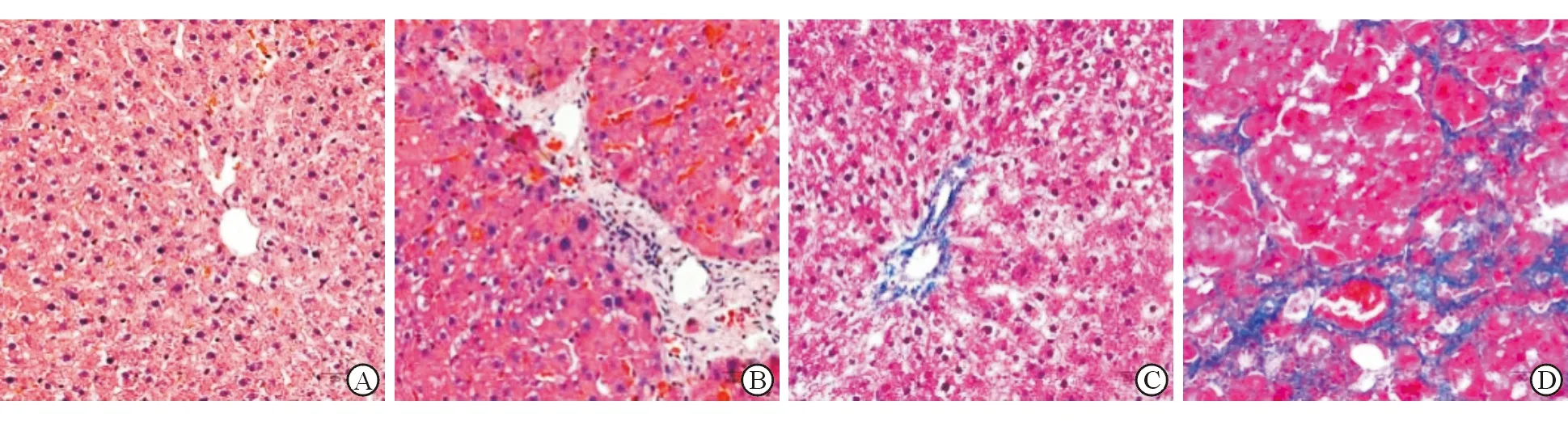
免疫組織化學染色顯示,與對照組大鼠肝組織SHP2陽性表達IOD(0.19±0.01)比較,不同造模時間(2、4、6、8周)的大鼠肝組織SHP2陽性表達IOD(0.23±0.01, 0.27±0.01, 0.30±0.01, 0.33±0.01)明顯增加,并隨著造模時間的延長逐漸升高(P<0.05,圖2)。
三、大鼠肝組織中HSC凋亡變化
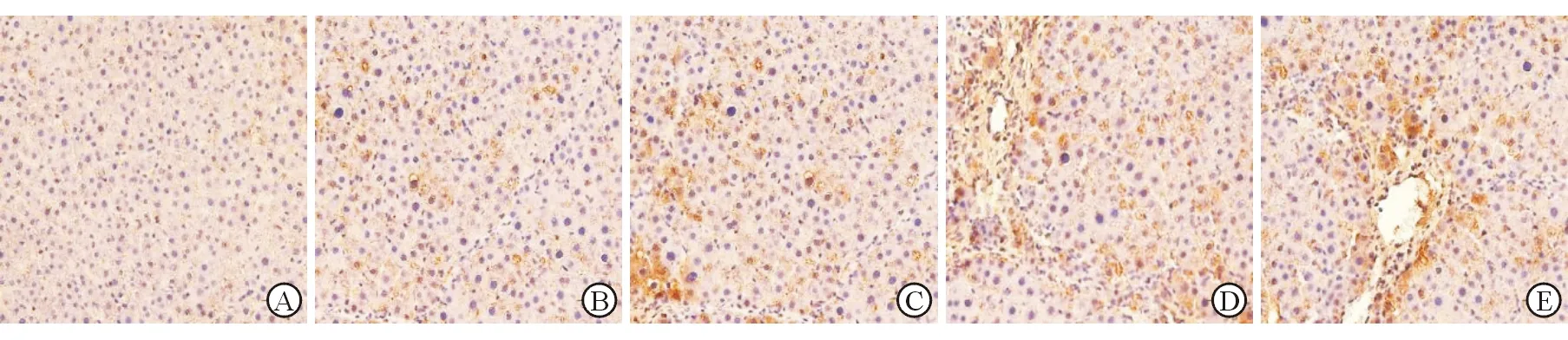
α-SMA免疫組化與TUNEL雙染顯示,模型組大鼠肝組織中活化肝星狀細胞與凋亡肝星狀細胞同時存在,而對照組大鼠肝組織中幾乎見不到凋亡的肝星狀細胞;在大鼠肝纖維化過程中,隨著肝纖維化程度加重,不同造模時間(2、4、6、8周)大鼠肝組織中肝星狀細胞凋亡指數(47%±1%、41%±2%、35%±1%、29%±1%)逐漸下降(P<0.05,圖3)。
四、SHP2表達與在體HSC凋亡的相關性
Pearson’s相關性分析顯示,不同造模時間的大鼠肝組織SHP2免疫組化結果與不同造模時間的大鼠肝組織中活化肝星狀細胞凋亡指數呈顯著負相關(r值為-0.958,P<0.05)。上述分析表明,在四氯化碳誘導的大鼠肝纖維化病理過程中,纖維化大鼠肝組織SHP2表達與在體HSC的凋亡呈顯著負相關。
A:對照組HE染色;B:造模6周HE染色;C: 對照組Masson三色染色;D:造模6周Masson三色染色
A:對照組;B:造模2周;C:造模4周;D:造模6周;E:造模8周
A:對照組;B:造模2周;C:造模4周;D:造模6周; E:造模8周
討 論
肝纖維化是各種慢性肝病演變為肝硬化的病理過程,在參與此過程的眾多細胞中肝星狀細胞是最重要的細胞,其活化及增殖在肝纖維化的形成及發展中扮演重要角色[11-14];但在肝纖維化恢復期活化肝星狀細胞的清除主要通過細胞凋亡機制實現[7, 15]。因此誘導活化HSC凋亡則成為逆轉肝纖維化的重要策略。SHP2是具有促癌作用的蛋白酪氨酸磷酸酶,其在多種腫瘤中過表達,并可通過抑制腫瘤細胞的凋亡而促進腫瘤的發生、發展[1-4]。近年來對SHP2的研究已從腫瘤領域延伸至非腫瘤領域。有研究發現,在HBV感染相關的肝細胞癌患者的肝組織中,伴有纖維化的癌旁肝組織SHP2表達增高[5]。本研究發現,四氯化碳誘導的大鼠肝纖維化肝組織的SHP2表達明顯高于正常大鼠肝組織,這與上述研究結果及SHP2在多種腫瘤組織中過表達相一致,證實在肝纖維化病理過程中肝組織的SHP2表達異常。同時,本研究也發現,在大鼠肝纖維化病理過程中,隨著肝纖維化程度的加重,大鼠肝組織中在體肝星狀細胞的凋亡指數(凋亡活化肝星狀細胞占總的活化肝星狀細胞百分比)逐漸下降,并與逐漸升高的肝組織SHP2表達呈顯著負相關。如上所述,HSC 凋亡對肝纖維化的修復具有重要意義, 在肝纖維化恢復過程中 ,活化 HSC 數量的減少主要是通過細胞凋亡機制實現。盡管肝纖維化病理過程中影響在體HSC凋亡的因素較多,但SHP2在腫瘤方面的研究已證實,其過表達可通過抑制腫瘤細胞凋亡促進腫瘤的形成及發展,并且已有體外研究顯示,體外活化HSC的SHP2表達下調,其增殖受到明顯抑制[6]。故本研究提示,肝纖維化病理過程中肝組織的SHP2表達上調可能通過抑制在體活化HSC的凋亡參與了肝纖維化的病理過程,這一結論尚需進一步研究證實。

