姜黃素抗胃癌研究進展
張琳,王金瑋,尹麗,包子威,英錫相,張純剛
(遼寧中醫藥大學藥學院,遼寧 大連 116620)
姜黃素是從植物中提取的多酚類天然產物,從姜科植物姜黃的根莖中分離得到[1],為二酮類化合物(結構式見圖1)。除了可以作香料,在阿玉吠陀醫學和中醫中,姜黃素作為膳食補充劑用于治療炎癥性疾病已有5 000多年的歷史。姜黃素還具有很強的免疫調節、抗炎、抗氧化、抗感染、抗誘變和抗癌的藥理作用。
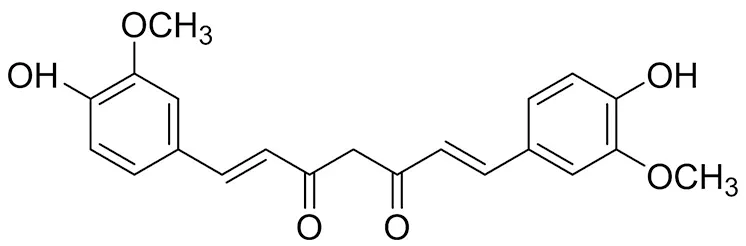
圖1 姜黃素化學結構式
胃癌是一種常見且高度致命的疾病,可發生在胃的任何部位。因此,要提出合理且有效的應對胃癌的治療方法是切中時弊的。目前標準的治療還只是手術切除,在適當的情況下也可以使用化療和放療,但我們都知道放化療對人體的危害以及患者愈后的生活質量都是極其不好的,很多患者的精神狀態也會因此而頹廢。所以我們渴望一種溫和且有效的中藥治療方法,由于姜黃素抗癌特性突出且毒性很低,近年來引起了人們普遍的關注。已有眾多臨床前研究表明姜黃素可能具有抗胃癌的作用,有關姜黃素的臨床試驗處于初步階段。目前對姜黃素已有的研究表明,其通過不同信號通路對胃癌細胞產生的作用如圖2所示。
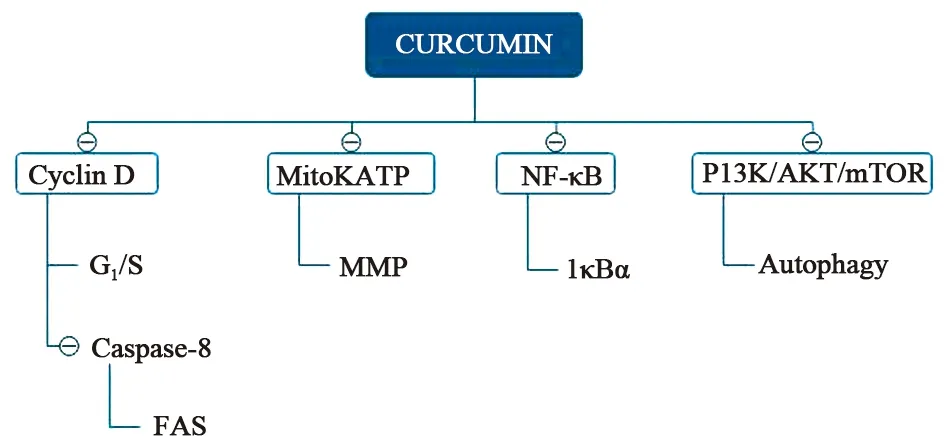
圖2 姜黃素抗胃癌的機制
1 姜黃素抗胃癌作用機制
1.1 抑制增殖和侵襲 細胞增殖是生物體生長發育、生存和繁殖下一代的基礎,任何細胞都有增殖的性質,無論是正常細胞還是腫瘤細胞,姜黃素選擇性地對胃癌細胞通過不同途徑抑制其增殖。癌癥細胞的自噬可以影響胃癌的增殖,自噬是細胞消化自身細胞器后與溶酶體結合將內源性底物消除的過程,具有高度的進化保守性[2]。Li等[3]研究發現姜黃素對胃癌細胞株BGC-823、SGC-7901和MKN-28的抑制作用呈不同程度的時間和劑量依賴性。其中MKN-28細胞對姜黃素最敏感(IC50=16.17 μmol·L-1),SGC-7901對姜黃素最耐受(IC50=50.45 μmol·L-1),而BGC-823對姜黃素敏感度適中(IC50=37.58 μmol·L-1)。雖然這兩個研究中姜黃素對胃癌細胞的增殖都呈現抑制作用,但是作用機制卻不同。另外有一些研究發現姜黃素是一種ATP競爭性抑制劑,Cai等[4]采用不同濃度姜黃素對BGC823細胞模型處理不同時間,發現G1期細胞百分率比對照組高10%,而S期細胞則相應地下降了15%,表明姜黃素能夠抑制cyclin D1 的mRNA和蛋白表達,進一步阻礙細胞從G1期向S期轉移從而抑制細胞的繁殖。Sun等[5]認為姜黃素能抑制SGC-7901細胞的繁殖是由于細胞中miR-34a的表達,從而影響Bd-2、CDK4和cyclin D1的表達。同時他們進一步證明姜黃素通過抑制細胞周期的G0/G1~S期,抑制SGC-7901細胞中Bd-2、CDK4和cyclin D1的表達來抑制SGC-7901細胞的增殖。
1.2 誘導凋亡及調控凋亡相關的基因 細胞凋亡是程序性細胞死亡,是一種對細胞有好處的行為,目的是處理掉對生物體有壞處的細胞。線粒體的主要功能是進行細胞的氧化供能,除此之外還是細胞凋亡的調控中心。Cao等[6]報道姜黃素的使用會使HT-29細胞和AGS細胞系中胞質細胞色素C的升高和線粒體BCL-2蛋白表達顯著減少進而導致細胞凋亡,其機制是姜黃素下調了AGS和HT-29細胞系的線粒體膜電位(MMP)并導致線粒體損傷。Xue等[7]報道了姜黃素促進SGC-7901細胞凋亡的機理與CAO一樣,同樣是MMP的降低,由于Bax/Bcl-2比值顯著上調導致線粒體介導的細胞凋亡的誕生,Liu等[8]的報道與Xue一致。Liang等[9]報道姜黃素誘導BGC-823細胞凋亡與活性氧(ROS)的生成有關。線粒體是ROS的一個主要出處,ROS是正常細胞氧代謝的副產物。因此,我們可以看出線粒體與細胞凋亡有著密切的聯系,通過調控線粒體的氧含量和膜電位的變化可以誘導GC細胞的凋亡。
1.3 逆轉耐藥 獲得性耐藥是長時間使用同一種藥物產生的,即在藥物未使用時人體對該藥物表示敏感,但在藥物應用一段時間后體內就會表現出對該藥適應的變化即耐藥的產生。細胞凋亡的阻滯是腫瘤細胞耐藥的主要原因,姜黃素可以抑制抗凋亡基因的表達[10]以及NF-κB的激活。報道稱[11]NF-κB是一個轉錄因子,如果將其激活可以使腫瘤產生耐藥性,而IκBα-NF-κB的抑制劑,能夠減少藥物抗性,為進一步開發5-氟尿嘧啶和姜黃素聯合治療作為逆轉GC獲得性耐藥和誘導GC細胞死亡的新方法提供了理論依據。Yu等[12]則研究了姜黃素聯合化療藥物抑制胃癌SGC-7901細胞的效果,他們發現使用化療藥物依托泊苷或阿霉素在抑制SGC-7901細胞的同時還會激活NF-κB通路,產生藥物抗性。
2 劑型
姜黃素具有水溶性小,水不穩定的特點,這導致血清和組織中姜黃素濃度不足,所以生物利用度和臨床療效很低。因此科學家們致力于通過修飾劑型改善其溶解度、生物利用度、跨膜通透性;延長其血漿半衰期;實現靶向給藥以增強療效。
2.1 納米微粒 納米微粒在姜黃素的劑型中有很廣泛的應用,科學家們通過將不同的親水性載體包載姜黃素制成復合給藥系統,該系統粒徑小,載藥能力強。將其運送到胃時,由于胃液呈酸性,此時納米微粒會靶向釋放出姜黃素作用于胃部,因此改善其生物利用度低的特點[13-14]。潘洪明等[15]以聚氰基丙烯酸正丁酯為載體,采用乳化聚合法包載姜黃素制成納米微粒,將其作用于人胃癌MGC-803細胞,研究細胞的增殖抑制、細胞周期的下調以及促進凋亡的情況。Bhawana等[16]用聚甲基丙烯酸甲酯-聚乙二醇/氧化鋅這種生物納米復合材料作為藥物載體,可攜帶大量姜黃素。MTT檢測法發現姜黃素納米微粒在較高濃度下能誘導胃癌AGS細胞幾乎全部死亡,機制是cyclin D1的表達下調、G1/S期的比例降低。該納米材料有羧酸基團構成,這些羧酸基團可能在酸性緩沖溶液中發生縮合,導致藥物連接減弱,因此姜黃素從納米材料中迅速釋放出來,提高姜黃素的生物利用度。
2.2 片劑 FDDS是一種漂浮給藥系統,具有緩釋特性。Shishu等[17]用揉捏法制備姜黃素β-環糊精包合物,采用濕法制粒將其制備成胃漂浮片,通過改變羥丙基纖維素和填充劑的含量可以獲得適宜的浮力。該制劑具有較強的漂浮性和膨脹性,能最大限度地釋放姜黃素,提供藥物的持續釋放,以提高藥物的溶解度和生物利用度,有針對性的更好治療胃癌。
2.3 NLCs NLCs是一種新型的脂質納米顆粒,它是固體脂質和液體脂質與空間不相容的混合物,具備高載藥量、連續釋放的優點。依托泊苷是一線的抗腫瘤藥,但由于其溶解度大,生物半衰期短以及耐藥等性質限制了其應用,姜黃素有逆轉耐藥的性質,所以Hong等[18]采用溶劑注入技術制備了依托泊苷-姜黃素脂質納米顆粒,將其作用于人胃癌SGC-7901細胞,結果發現其半數抑制濃度(IC50)相比單獨使用兩種藥物低得多,不同濃度的NLCs均能抑制細胞生長且呈劑量依賴性。
2.4 納米乳 納米乳是納米技術應用在藥物遞送系統的例子,納米乳的比表面積大,粒徑約為1~100 nm,而且穩定性好,生物利用度高;納米乳能改善不溶性藥物的溶解度,具有緩慢釋放和定位給藥的作用。Guerrero等[19]采用溶劑置換法制備了姜黃素納米乳,該制劑的收率為95%,經體外實驗檢測其對人胃癌AGS細胞具有細胞毒性,且不影響正常細胞。將納米乳制成凍干粉,不僅易于保存,同時還具有穩定性好、不易污染的特點。
2.5 微球、微囊 微囊化主要以高分子材料為基礎,通過包覆液體或固體藥物形成核-殼微膠囊。同時,藥物也可以溶解在高分子材料中形成微米級的固體球或膠囊。有報道顯示,黏膜表面可以作為潛在的作用點,藥物通過納米載體釋放在黏膜表面。雖然口腔給藥仍是最有利的給藥途徑,但只有少數胃腸道黏液黏附載體能顯著提高藥物在體內的生物利用度。Suwannateep等[20]設計了這樣一種微囊:以乙基纖維(EC)為單聚載體或以甲基纖維素和乙基纖維素(ECMC)混合而成的二聚載體采用溶劑置換法制成了姜黃素微囊(C-EC或C-ECMC),該微囊對癌細胞有明顯的細胞毒性。這種微囊的外表面有許多的羥基,可以很好地分散在水中。經檢測,C-EC球與胃黏膜結合良好,緩慢釋放姜黃素進入血液循環;相比之下,C-ECMC球的黏附效果不如C-EC球,而且口服之后,觀察到姜黃素濃度最高的是C-EC球。
3 展望
由于姜黃素是一種中藥,本身又具有毒性和副作用低的特點,所以姜黃素是一種極具前景的胃癌替代療法[21]。姜黃素在癌癥發展的不同階段通過激活自噬和阻滯細胞周期抑制增殖,下調NF-κB和mitoKATP通路以及蛋白表達抑制凋亡,但是姜黃素溶解度差、代謝迅速、口服生物利用度低降低了其治癌效果,因此臨床上的治療效果仍沒達到理想狀態。本文將姜黃素與藥物遞送系統如納米顆粒結合以增強效果,但像納米顆粒這種載體的價格昂貴,即便我們能實現靶向給藥,但大多數患者卻無法承擔費用。姜黃素療效的研究策略是合成修飾,研究表明[22],已經制備的姜黃素類似物(如聯苯二氟酮EF24)具有抗胃癌作用,EF24可以通過上調ROS,激活內質網應激來誘導胃癌細胞凋亡,顯示了這種方法的巨大潛力。

