基于宏基因組測序的植物葉表微生物富集及DNA提取方法
張雨函 范熠 李婷婷 龐爽 劉為 白可喻 張西美
(1. 中國農業科學院農業環境與可持續發展研究所,北京100081;2. 中國農業科學院農業資源與農業區劃研究所 國際生物多樣性中心東亞辦事處,北京 100081)
葉表生境廣闊,總表面積估計超過4×108km2,植被模型估計的葉子總表面積大約是陸地表面積的兩倍[1],是陸生微生物的一個巨大且極其多樣化的棲息地,也是地球上最大的微生物棲息地之一。葉表面的環境是復雜而動態的,葉表微生物在這樣極端、緊張和變化的環境中仍有著豐富的多樣性[2],葉表面的微生物相互作用可以影響植物種群在自然生態系統中的適應性。葉表微生物不僅促進植物生長發育,還可以抑制病原菌的入侵和定殖,對植物有著重要的保護作用[3]。由于植物的空中部分是不適宜微生物生存的開放系統,這些微生物極易受到各種環境條件和營養缺乏的影響,不同分類群的微生物在植物葉表面的數量波動變化很大[4],導致對葉表微生物群落的組成和功能等基本問題仍然沒有清晰的認知。研究表明葉表微生物群落較為復雜[5],特別是通過與植物的相互作用進而影響整個生態環境系統,葉表微生物群落及其對植物生長、發育和保護的重要作用已經受到了人們的廣泛關注[6]。因此盡可能多地保留微生物多樣性可以更好地理解生物多樣性的結構、功能和生態多樣性[7]。
由于葉表微生物基因組DNA的提取難度較大,葉表微生物在推動生態系統功能和植物群落動態方面作用的研究較少。一直以來,人們對葉表微生物的認識是建立在純培養的基礎上,對葉表微生物多樣性的認識不夠深入。Yang等[5]采用培養和非培養方法對7種不同植物的葉表微生物群落進行了評價,結果表明與不依賴培養的方法相比,傳統的基于培養的方法無法檢測到大多數優勢的葉表微生物。測序技術和生物信息學的快速發展為微生物生態學領域帶來革命性的影響,以擴增子測序和宏基因組測序為代表的非培養測序技術極大地增強了對葉表微生物群落多樣性和結構的評估。擴增子測序局限于研究物種的群落組成、物種間的進化關系和群落多樣性[8],無法對微生物的功能做出解釋,而宏基因組測序通過環境DNA構建克隆文庫,可以得到生態環境中的全部微生物基因的總和,包括可培養的和不可培養的微生物基因的總和[9],提供葉表微生物分類群和功能更為準確的描述[7,10],幫助我們理解微生物與宿主和環境的聯系和微生物組的整體功能[11],進而可以開發新的葉表微生物資源。宏基因測序同樣為微生物物種鑒定開辟了新的研究途徑,它能夠對復雜環境背景下的基因組異質性和進化進行分析,并提供了遠比在培養皿中觀察到的微生物多樣性更多的途徑[12-13]。目前,宏基因組學作為迄今為止最全面地了解微生物群落特征、最大限度地挖掘微生物資源的一種方法,已經成為了國際上微生物生態學主要的研究手段。到目前為止,宏基因組學研究已經開展了多種常見環境(如土壤、水等)和極端環境(如冰川、間歇泉等)的研究[14],但是對自然生態中的各種植物的葉表微生物在生態系統中的功能和作用尚不清楚。
宏基因組學研究的第一步是直接從生活在特定環境中的所有微生物中提取出高質量、完整的微生物基因組DNA[15-16]。宏基因組數據的質量和準確性依賴于可靠的取樣和DNA提取程序[17]。取樣的關鍵是收集到足夠的微生物進行測序,為了保證獲取足夠的葉表微生物基因組DNA,需要對葉表微生物進行有效的分離。已有的研究在改進DNA提取過程中,一般只涉及DNA的提取過程[18],很少重視對葉表微生物的富集和前處理,對此本研究將目標集中在收集葉表微生物細胞的過程,尤其是對洗脫液的選擇。對于洗脫液的選擇,主要有磷酸緩沖液和無菌水[19]等,不同洗脫液對于不同植物葉表微生物的洗脫效果沒有統一的結論。由于微生物細胞通常附著在表面上,并可能被整合成生物膜[20],使用磷酸緩沖液或無菌水作為洗脫液的方法無法洗脫形成生物膜的細胞,可能會導致樣本微生物DNA的質量不佳,葉表微生物DNA 總量不夠。為了解決葉表微生物多樣性豐富但可獲取的數量少這一難點,本研究通過改良洗脫液成分,通過洗脫并收集更多的葉表微生物,以提高對葉表微生物DNA的提取質量。通過此方法能夠提高葉表微生物DNA的提取效率,進而提高宏基因組文庫構建的成功率,促進葉表微生物宏基因組學研究的發展。
1 材料與方法
1.1 材料
本研究選取內蒙古呼倫貝爾草原常見的6種草本植物,分別為羊草(Leymus chinensis(Trin.)Tzvel.)、叉分蓼(Polygonum divaricatum L.)、冷蒿(Artemisia frigida Willd.)、馬藺(Iris lactea Pall. var.chinensis(Fisch.)Koidz.)、披針葉黃華(Thermopsis lanceolata R. Br.)、野韭(Allium ramosum L.)。分別取其植物葉片,放于滅菌的封口袋,每袋大約180 g,每種10袋。迅速將樣品轉移到實驗室,存放于-20℃冰箱。
1.2 方法
1.2.1 植物葉表微生物的分離和收集 (1)實驗以無菌水作為對照,添加表面活性劑Silwet L-77的PBS緩沖液(PBS+ Silwet L-77)為處理。配置PBS磷酸緩沖鹽溶液(1×PBS:137 mmol/L NaCl,10 mmol/L phosphate,2.7 mmol/L KCl,pH 7.4), 在 每1 000 mL的PBS緩沖液中加入200 μL 表面活性劑Silwet L-77(GE Bayer Silicones),分別稱取大約30 g葉片置于2個500 mL無菌玻璃瓶中,分別加入一定量的可以淹沒葉片的無菌水和PBS+ Silwet L-77,200 r/min振蕩20 min,將微生物細胞從葉上清洗掉,取出葉片,留下含有菌泥的洗脫液,每組處理重復2次。(2)將余下的植物樣品采用的同樣的方法,循環利用洗脫液進行振蕩,以此循環,直至將葉片全部洗完。這樣可以保證葉表微生物更好的富集在一起。(3)將洗脫液通過100 μm大小的細胞過濾器過濾到50 mL離心管中,5 000×g離心10 min,棄去上清液,所得沉淀存于-80℃冰箱,用于DNA的提取。
1.2.2 植物葉表微生物DNA的提取與檢測 使用MoBio PowerLyzer PowerSoil DNA Isolation Kit按照說明進行葉表基因組DNA的提取。為了獲得足夠量的DNA用于宏基因組測序,將洗脫下來的沉淀全部用于DNA的提取(每個重復0.25 g沉淀物)。每個重復最終得到的DNA即為用100 μL純水洗脫下來的DNA。用Thermo NanoDrop2000分光光度計測定各樣本DNA的濃度及A260/A280值。將使用不同洗脫液進行前處理收集得到的菌泥提取到的葉表微生物宏基因組DNA送到上海美吉生物醫藥科技有限公司,經1% 的瓊脂糖凝膠電泳檢測DNA的提取質量,判斷哪一種分離和收集葉表微生物的方法提取得到的基因組DNA可以滿足宏基因組建庫的要求。
1.2.3 宏基因組測序 選取滿足宏基因組建庫的葉表微生物基因組DNA樣品進行鳥槍法宏基因組測序。準備用于測序的DNA庫,根據Illumina配對端準備試劑盒的描述對DNA提取液進行處理。機械剪切DNA,大小選擇至~180 bp,純化凝膠。測序是在上海美吉生物醫藥科技有限公司的Illumina Hiseq 2000平臺上進行的。
1.2.4 數據質控 為了提高后續分析的可靠性和質量,對原始序列數據進行了以下兩步處理。首先, 使 用 fastp(https://github.com/OpenGene/fastp,version 0.20.0) 對 reads 3′端 和 5′端 的 adapter序列進行質量剪切。其次使用fastp(https://github.com/OpenGene/fastp,version 0.20.0)去除剪切后長度小于50 bp、平均堿基質量值低于20以及含N堿基的reads,保留高質量的pair-end reads和singleend reads。
1.2.5 葉表微生物COG功能注釋 使用FLASH對宏基因組的配對序列進行拼接,將拼接序列上傳到STRING數據庫,并使用MBLASTX(E-value cutoff 1e-6)對蛋白質序列進行直系同源聚類(clusters of orthologous groups of proteins,COG)功能注釋,并將注釋結果進行分類統計。
2 結果
2.1 植物葉表微生物總DNA質量評估
宏基因組一次建庫濃度/總量標準:濃度 ≥10 ng/μL,文庫構建需要總量5-10 μg的環境DNA。由表1可知以PBS+ Silwet L-77為洗脫液分離收集得到的植物葉表微生物DNA的濃度都大于20 ng/μL且總量都大于5 μg,能夠滿足宏基因組建庫的要求。以無菌水作為洗脫液得到的葉表微生物最終獲得的DNA濃度較低且總量不滿足宏基因組文庫構建所需的環境DNA總量。通常用A260/A280檢測DNA的純度,通過兩種方法得到的每種植物葉表微生物DNA的OD260/280在1.8-2.0之間,說明DNA純度都滿足建庫要求(表1)。對植物種類和提取方法對葉表微生物DNA濃度的方差分析結果表明,植物種類對微生物DNA濃度無影響,提取方法顯著影響葉表微生物DNA濃度(表2),以PBS+ Silwet L-77為洗脫液分離收集得到的植物葉表微生物DNA的濃度明顯大于以無菌水為洗脫液分離收集得到的DNA的濃度(圖1)。瓊脂糖凝膠電泳圖(圖2)顯示,以PBS+Silwet L-77為洗脫液分離和收集得到的葉表微生物最終得到的DNA質量,DNA主帶 ≥5 kb,DNA溶液無嚴重RNA、蛋白、糖類等雜質污染,而以無菌水作為洗脫液最后提取出來的DNA質量;膠圖條帶彌散,DNA溶液無嚴重RNA、蛋白、糖類等雜質污染,DNA濃度和總量較低,不滿足宏基因組建庫需求。綜上所述,用無菌水洗脫得到微生物較少,提取效率不高,提取得到植物葉表微生物DNA濃度和質量不滿足宏基因組建庫標準,以PBS+ Silwet L-77作為洗脫液所提取微生物相對較多,提取效率高,提取得到植物葉表微生物DNA都相對完整且DNA總量滿足宏基因組標準建庫需求。
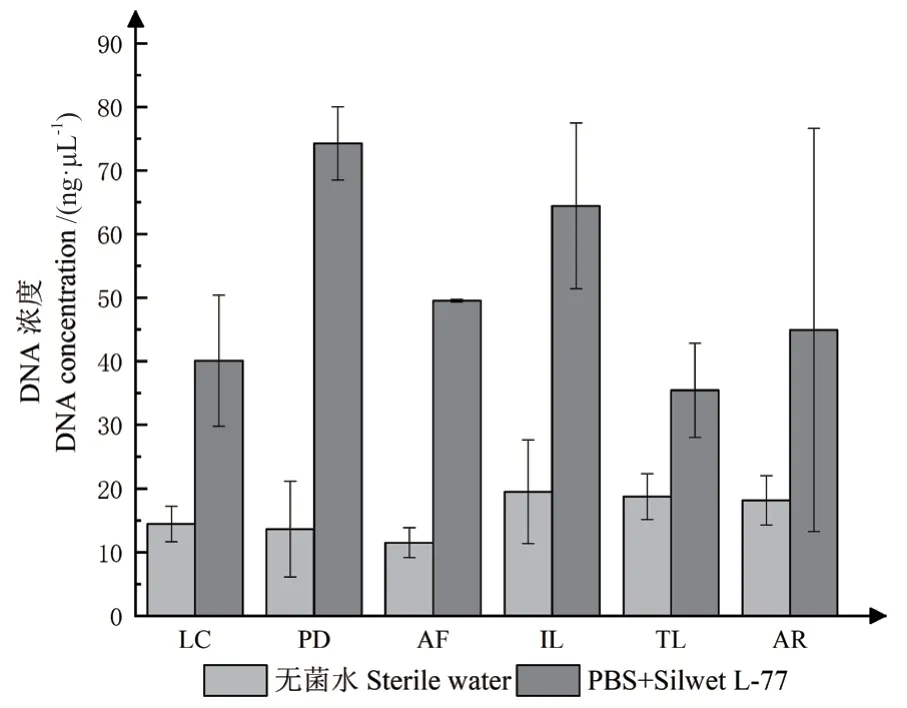
圖1 不同洗脫液提取不同植物種類葉表微生物的DNA濃度Fig. 1 DNA concentration of leaf surface microorganism extracted from different plant species by different eluents
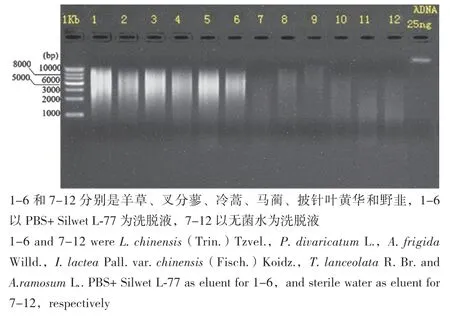
圖2 六種植物葉表微生物DNA電泳圖Fig. 2 Microbial DNA electrophoresis patterns on the leaf surfaces of 6 plants
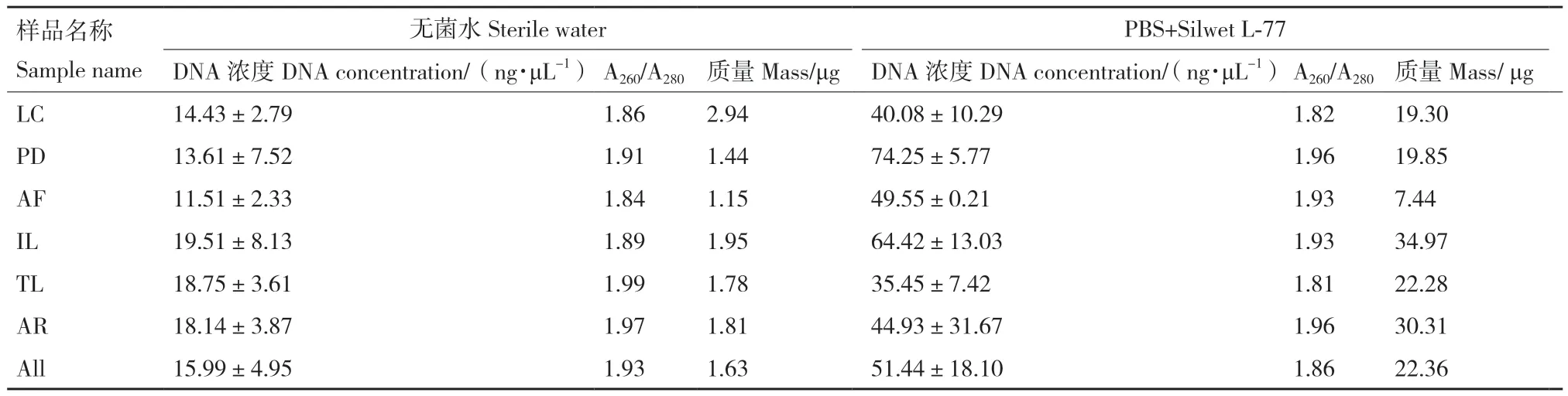
表1 無菌水和PBS緩沖液+Silwet L-77表面活性劑對葉表微生物基因組DNA的提取效果Table 1 Extraction effect of sterile water and PBS buffer solution +Silwet L-77 surfactant on microbial genomic DNA from leaf surface

表2 植物種類與不同富集方法對DNA濃度的影響Table 2 Effects of plant species and different enrichment methods on DNA concentration
2.2 宏基因組測序結果
以PBS+ Silwet L-77為提取葉表微生物的洗脫液獲取的DNA作為最終樣品進行宏基因組測序。通過數據質量控制,過濾掉低質量序列、接頭序列等雜質,得到的Clean reads占比在98%以上(表3),表明原始數據的質量較高。綜合各項指標確定在這6種植物的葉表提取得到用于宏基因組測序的DNA質量合格,滿足建庫標準,可以進行下游的生物信息學分析和統計學分析。經過宏基因組測序,最終得到葉表微生物的各個分類群占葉表微生物群的相對比例(圖3)。結果顯示這6種植物的葉表微生物中的細菌在全基因組測序中占比達到了一半以上,說明葉表微生物群落主體由細菌組成,其次為真菌,古菌最少,幾乎沒有,其他的非微生物的比例說明可能存在植物DNA污染。
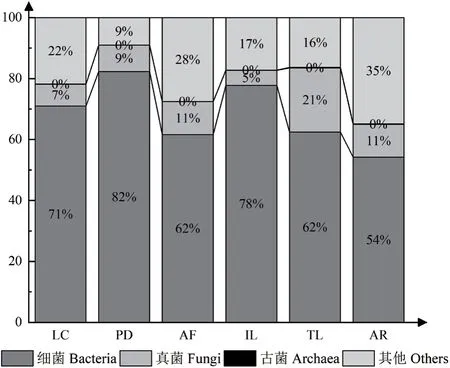
圖3 六種植物葉表微生物不同分類群的百分比Fig. 3 Percentages of different taxa microorganism on the leaf surfaces of 6 plants
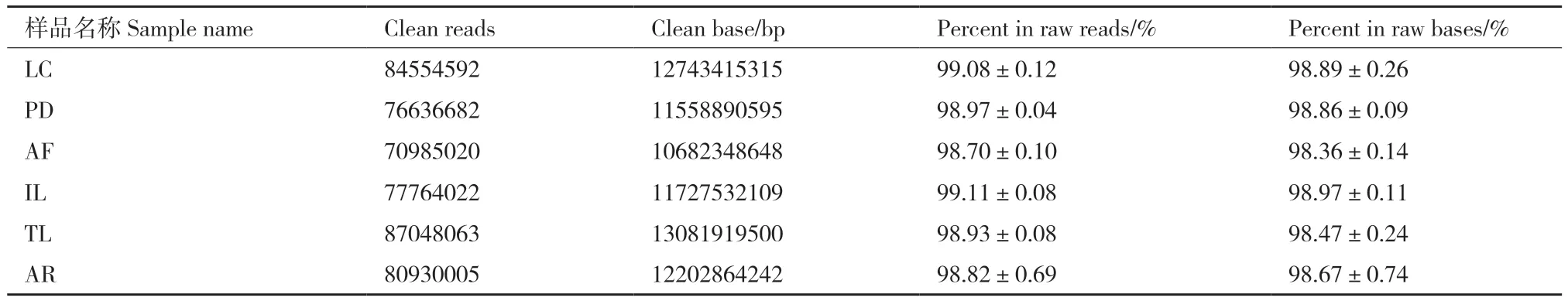
表3 宏基因組測序統計Table 3 Metagenomics sequencing statistics
與擴增子測序分析相比,宏基因組學分析不僅能夠進行物種注釋,還能夠通過比對多個功能數據庫,進行功能注釋,揭示微生物群落的功能多樣性和功能潛力。為了揭示優化方法后提取建庫得到的葉表DNA宏基因測序數據的質量,在物種注釋的基礎上,宏基因組分析通過比對直系同源聚類(COG)進行功能注釋分析。通過BLAST將宏基因組拼接組裝序列與COG數據庫進行比對分析,COG功能分類富集結果如圖4所示,說明宏基因組建庫可以滿足物種注釋和功能注釋的需求,達到揭示微生物群落功能多樣性的研究目的,進而表明以PBS+ Silwet L-77為洗脫液收集得到DNA可以通過宏基因組測序對植物的葉表微生物進行功能研究。
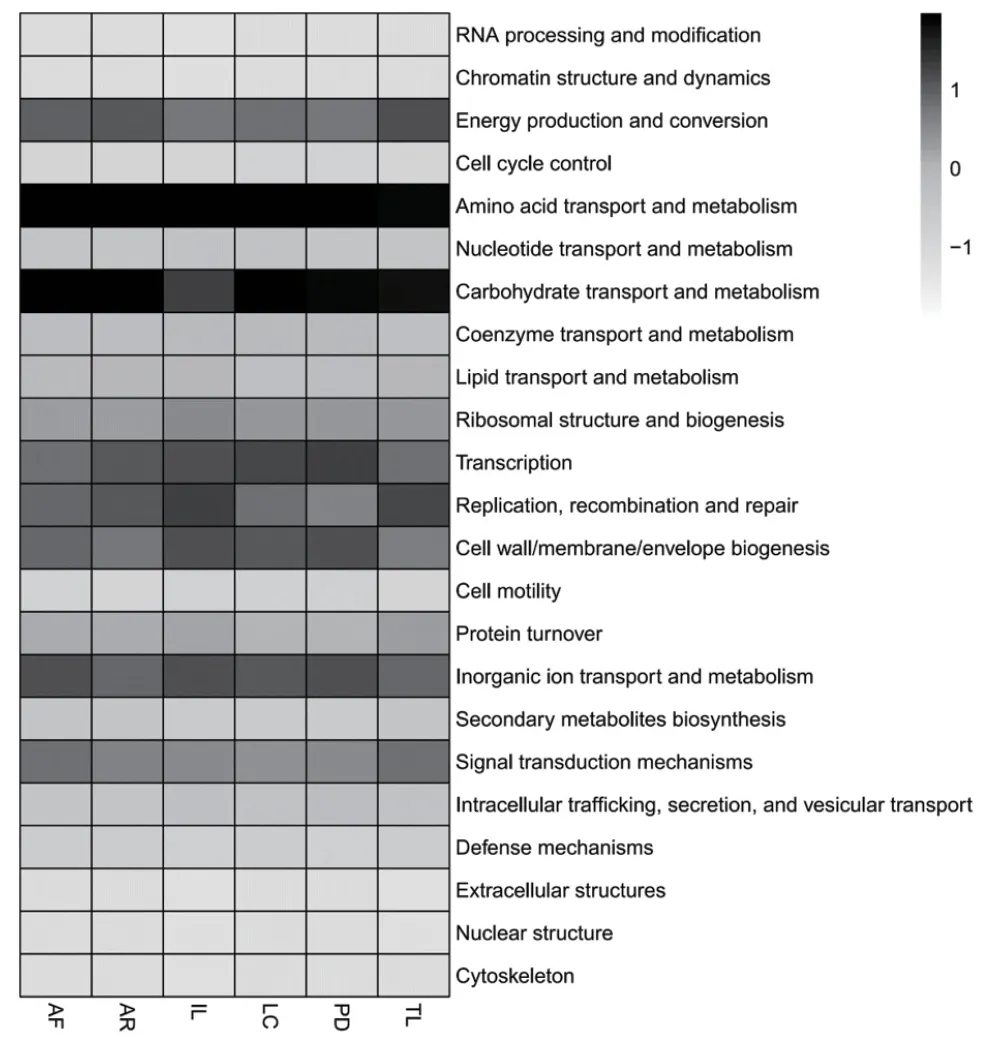
圖4 六種植物葉表微生物COG功能注釋Fig. 4 Functional annotation of microorganism COG on the leaf surfaces of 6 plants
3 討論
本研究以提高葉表微生物的收集和分離為目的,只有獲取足夠多的葉表微生物,才可能進一步提高DNA的獲得量。進行DNA提取工作的第一步是將微生物從葉片中分離出來,超聲和震蕩技術已用于這一目的,但由于操作較為劇烈往往不容易得到大片段的DNA[21]。穩定的大片段基因組文庫能保證基因簇的完整性,更利于目的基因的結構和功能分析[22],因此大片段DNA的提取是建立高質量宏基因組文庫的關鍵。超聲波利用聲波產生高速、強烈的空化效應和攪拌作用會破壞植物細胞[22],為此本研究只采用恒溫搖床震蕩,而沒有選擇超聲波震蕩。
由于葉片形態差異,葉片的結構和表面化學構成了一個特殊的微環境[6],各種葉片表面特征,如表皮細胞連接處形成的凹陷處、沿靜脈和毛狀體基部都被確定為微生物的優先附著位置[2],導致微生物在葉片表面的分布不均勻。之前研究表明無菌水和磷酸緩沖液這兩種洗脫液對葉表微生物基因組DNA提取效果基本沒有差別[19],目前多采用的是使用磷酸緩沖鹽溶液作為洗脫液來獲取葉表微生物[23]。相較于無菌水,PBS磷酸鹽緩沖液具有鹽平衡、可調整的適宜pH緩沖作用,可以使完整的、具有活性的微生物細胞保持其特性,面對復雜的葉表環境,微生物需要形成聚集體以及分泌生物活性化合物來克服這一困難[2]。只使用PBS磷酸鹽緩沖液不足以使我們獲得足夠多的葉表微生物。葉片最外側的蠟質層具有疏水性,普通緩沖液的很難使葉面濕潤,而表面活性劑可以降低溶液與葉表蠟質層之間的界面張力[24],使葉片更易被潤濕,從而能更有效的收集葉表微生物。已有研究采用含有0.01% Tween-80的PBS緩沖液富集黃瓜(Cucumis sativus L.)葉片表面的微生物[25],由于水的表面張力為72.4 mN/m,0.1%的Silwet-L77系列有機硅溶液的表面張力約為21 mN/m[26],0.1%的Tween 80水溶液的表面張力約為 48.21 mN/m[27],相比 Tween-80,Silwet L-77 更能降低水的表面張力。Silwet L-77是一種高效有機硅表面活性劑,具有很強的表面活性,可以在難以濕化的表面迅速擴散,幾乎可輕易濕潤所有種類的葉面,增加葉子濕潤性,產生的水膜可以讓微生物在葉子表面活動起來[26,28],促進微生物在葉平面上的運動,在震蕩的過程中更容易將微生物從葉表面洗脫下來。PBS磷酸緩沖液結合表面活性劑Silwet L-77作為洗脫液被成功應用到根際微生物的提取中[29],但在葉表微生物上的應用幾乎沒有,因此選擇在PBS磷酸緩沖液中加入表面活性劑Silwet L-77提高對葉表微生物的富集。由于根系上會附著很多的土壤顆粒,很容易就可以得到足夠的菌泥來獲得足夠量的根際微生物基因組DNA,而植物葉片表面極小量的微生物以及形態各異的葉表皮環境增加了分離和收集葉表微生物的難度,需要大量的植物葉片才可富集得到足夠的菌泥進行DNA提取[30]。因此植物葉片樣品的采集量也是獲取足夠葉表微生物基因組DNA的關鍵因素,由于采樣量的限制,本研究每組處理做了兩次重復,在以后的方法改進中需要注意。
目前,鳥槍法宏基因測序仍然是適合研究葉表微生物的非培養方法,不僅可以對環境樣本中存在的微生物進行分類[31],而且可以更深入地了解測序數據中識別出的微生物的結構、功能和代謝途徑。對于葉表微生物,宏基因組測序可以實現物種注釋和功能描述,通過增加測序深度和數據量,可以深度揭示植物葉表微生物群落,甚至是低豐度的但可能在生態系統功能中發揮重要作用的微生物也可以被發掘[32]。宏基因組測序可以得到環境微生物的全基因組序列[10],能夠全面顯示樣品中微生物群落的實際豐度和多樣性。植物的葉表存在各種各樣的微生物,包括細菌、古生菌、原生生物和真菌[33],具有高度的多樣性和重要的生態學意義。本研究最終得到的每種植物葉表微生物的分類群在葉表微生物群中占比各不相同,可能是由于植物種類會影響葉片的微生物攜帶能力。一直以來,大多數關于葉表微生物的研究大部分集中在細菌上,對葉表真菌的研究目前也有所增多,但葉表真菌和細菌很少被同時研究[12],葉表很少有古菌,對葉表古菌的研究幾乎沒有。隨著測序技術的進步,宏基因組測序可以對同一環境的所有微生物進行研究,打破迄今為止大多數與植物葉表微生物相關的研究只集中在單個微生物分類群(即細菌)的界限。通過COG功能注釋,可以對基因功能進行預測,發掘微生物群落功能,對進一步揭示葉表微生物群落的結構和功能具有重要意義。
4 結論
本研究得到了一種可以更高效的分離和收集葉表微生物的方法,Silwet L-77表面活性劑緩沖液的使用提高了葉表微生物的收集量,在震蕩清洗的過程中,選擇循環利用洗脫液,一方面可以節省實驗成本,另一方面可以更好的富集葉表微生物。通過商業試劑盒提取得到的高純度和高質量的DNA,經過瓊脂糖凝膠電泳,宏基因組測序、數據質控和功能注釋的驗證,此方法滿足宏基因組建庫的要求,并成功進行了宏基因組測序和建庫。

