核心素養理念下探析分子中大π鍵的形成
河北 李子春 馬俊斌
《普通高中化學課程標準(2017年版2020年修訂)》(以下簡稱《課程標準》)對物質結構選修的考查要求處在比較高的學業要求,在實際教學與復習中,對結構板塊大π鍵的形成很多同學理解不到位。本文從物質結構微觀視角深度探析大π鍵的形成過程。
一、追尋大π鍵概念的本源
大π鍵也稱為共軛π鍵或離域π鍵,是由于電子共軛效應形成的π鍵。共軛效應,又稱離域效應,是指共軛體系中由于原子間的相互影響而使體系內的π電子(或p電子)分布發生變化的一種電子效應。
高中化學蘇教版選修3專題四第一單元“分子構型與物質的性質”中介紹了雜化軌道理論以及價層電子對互斥理論,可以幫助判斷一些簡單分子的空間構型及相關原子的雜化方式,但是對于一些具有特殊結構的分子(比如共軛結構)的構型判斷,或分子中含有氮氧等特殊原子的雜化類型的判斷,教材中提到較少,容易引起偏差。共軛效應是化學中非常重要的內容,它的應用非常廣泛,許多化合物的性質和現象都可通過共軛效應得到解釋,但是,由于共軛體系和共軛效應的理論比較抽象,很多教師不能很好地把控如何向學生傳授與復習相關的知識,筆者特此梳理高中階段出現的常見的具有共軛結構的分子的空間構型問題及特殊原子的雜化問題,幫助教師高效復習。

常見的共軛體系主要包括以下2個類型:
(1)π-π共軛體系
只要是兩個不飽和鍵通過單鍵相連,就可以形成π-π共軛體系。
(2)p-π共軛體系
如果與π鍵相連的某一原子具有一個與π鍵相平行的p軌道,那么這個p軌道就可以和π鍵離域,形成p-π共軛體系。
二、高中化學選修大π鍵考查內容分析
基于上述理論,筆者運用分類思想對高中教學中常見的幾種無機物分子和有機物分子大π鍵的形成做深度剖析。
(一)無機分子(離子)中的大π鍵
1.CO2分子


(a)

(b)

(c)


(a)

(b)
2.NO2分子


(a)

(b)


圖4 NO2分子中的大π鍵


(a)

(b)


(a)

(b)

(c)
3.SO2分子


圖7 SO2分子中的大π鍵
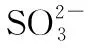

(a)

(b)


(a)

(b)
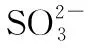


(a)

(b)

(二)有機分子(離子)中的大π鍵
無機物分子的大π鍵的解讀更多的使用p-π共軛體系,而有機物分子中的π-π共軛體系或p-π共軛體系都不少見,筆者下面也給出一些典型分子及其π鍵模型。
1.1,3-丁二烯
最簡單的共軛雙烯,在1,3-丁二烯分子中,四個C原子都是sp2雜化,相鄰C原子之間均以sp2雜化軌道沿軸向重疊形成σ鍵,其余的sp2雜化軌道分別與H原子的1s軌道形成σ鍵,由于每個C原子的三個sp2雜化軌道處在同一平面上,所以,1,3-丁二烯是一個平面型分子。每個C原子還有一個p軌道,這些p軌道均垂直于分子平面且彼此互相平行重疊,形成一個離域的π鍵,如圖11所示。

圖11 1,3-丁二烯分子中的π鍵
當然另有文獻表明,1,3-丁二烯分子中,只有當四個碳原子處在一個平面時,p軌道之間才能有充分的重疊,鍵的離域現象才顯著。如果這四個碳原子不在一個平面上,共軛效應減弱,甚至不顯著。這說明原子共面是形成共軛體系的條件,即1,3-丁二烯分子中的原子,可以共面而形成共軛體系,也可以不共面不形成共軛體系。原子能不能共面,應取決于溫度等外界條件,低溫有利于形成共軛體系,高溫則會破壞共軛體系。
2.苯
分子軌道理論認為,苯分子中的6個C原子均為sp2雜化,相鄰的C原子之間以sp2雜化軌道互相重疊,形成6個均等的σ鍵,每個C原子剩余的sp2雜化軌道分別與H原子的1s軌道重疊形成σ鍵,6個C原子和6個H原子處于同一平面內,每個C原子還有一個未參與雜化的垂直于分子平面的p軌道,這些p軌道彼此互相平行重疊,形成一個離域的π鍵,如圖12所示。

3.雜環化合物
呋喃、噻吩、吡咯中各有一個不同的雜原子,環中的C原子與雜原子(O、S、N)均以sp2雜化方式成鍵,C原子與雜原子在同一平面上,每個C原子與雜原子上均有1個p軌道,垂直于平面且相互平行,6個電子形成封閉的環狀共軛體系,與苯環類似。

(a)

(b)

(c)
筆者在此介紹這三種化合物的目的,主要是為了強調雜原子的雜化問題,不能脫離共軛體系簡單的利用VSEPR模型去進行判斷,很容易做出錯誤判斷。比如圖14中血紅素中N原子的雜化類型判斷,考慮共軛離域作用,則很容易做出判斷,均為sp2雜化,魏銳教授等人就這個問題進行過特別分析報道。

圖14
4.酚類物質
苯酚中,酚羥基的O原子為sp2雜化,O原子上的兩對孤電子對,一對占據sp2雜化軌道,另一對占據未雜化的p軌道,p軌道電子云正好與苯的大π鍵電子云發生側面重疊,形成如圖15所示p-π共軛體系。在共軛體系中,O原子的p電子向苯環轉移,進一步導致了H原子與O原子之間的電子云向O原子偏移,從而使氫離子較易離去,所以苯酚略顯酸性。

圖15 苯酚分子中的π鍵
5.含氮芳香化合物

圖16 苯胺分子中的π鍵
6.羧酸及其衍生物


另外,羧酸衍生物可看成是羧基與取代基直接相連的結構,同理,在該結構中,酮羰基的π鍵與取代基中的孤電子對也可以形成p—π共軛,比如酰胺、酰鹵、酯類、酸酐等。
三、高考題型展示,剖析命題特點
【例1】(2017·全國卷Ⅱ·35節選)經X射線衍射沿得化合物R的晶體結構,其局部結構如圖18所示。

圖18



→→
【命題特點】給定物質片段結構,創設問題情境,依據價層電子對互斥理論解決實際問題。
【例2】(2018·全國卷Ⅱ·35節選)(4)氣態三氧化硫以單分子形式存在,其分子的立體構型為________形,其中共價鍵的類型有________種;固體三氧化硫中存在如圖20所示的三聚分子,該分子中S原子的雜化軌道類型為________。

圖20
【參考答案】平面三角形;2;sp3
【解析】氣態三氧化硫以單分子形式存在,根據(2)中分析可知中心原子含有的價層電子對數是3,且不存在孤對電子,所以其分子的立體構型為平面三角形。分子中存在氧硫雙鍵,因此其共價鍵的類型有2種,即σ鍵、π鍵;固體三氧化硫中存在如圖20所示的三聚分子,該分子中S原子形成4個共價鍵,因此其雜化軌道類型為sp3。
【命題特點】限定典型分子,創設問題鏈情境,利用所學知識通過綜合分析判斷,依據價層電子對互斥理論解決分子構型和軌道問題。
四、結語及復習建議
綜上所述,各位教師要引導學生深入理解大π鍵的概念,利用典型結構向學生透析大π鍵的形成過程。對于大π鍵復習教師可以參考如下建議:
1.引導學生深度理解共價鍵形成的基本原理。
2.構建典型分子大π鍵的形成模型。
3.結合《課程標準》的能力要求,引導學生熟練掌握常見無機物分子及環狀有機物中大π鍵的形成原理。


