層狀鎳鈷錳酸鋰三元正極材料的研究進展
吳彩云,馮傳啟,張朝峰,梁葛萌,郭再萍
(1.湖北大學化學化工學院,湖北 武漢 430062; 2.安徽大學物質科學與信息技術研究院,安徽 合肥 230601;3.阿德萊德大學化工及先進材料系,南澳大利亞 阿德萊德 5005,澳大利亞)
盡管太陽能、風能等可再生能源在一定程度上可以滿足目前的需求,但這些能源的獲取取決于氣候和地理變化,且難以儲存,因此儲能系統日益受到人們的關注。目前應用廣泛的儲能裝置是鋰離子電池。正極材料在鋰離子電池的容量、工作電壓、循環穩定性和熱穩定性等方面起著重要的作用,設計合成高性能正極材料是發展鋰離子電池技術的關鍵。層狀鎳鈷錳酸鋰(LiNi1-x-yCoxMnyO2,NCM)是近年來研究廣泛的正極材料之一[1-3]。
在NCM三元正極材料中,Ni參與氧化還原反應,決定材料容量;Co可增加離子導電性,提升倍率性能,還可在一定程度上降低Li/Ni混排程度;Mn不參與氧化還原反應,但可提高結構穩定性。NCM三元正極材料綜合了LiCoO2的穩定性、LiNiO2的高容量和LiMnO2的低成本等特性,通過控制3種金屬元素的比例,利用協同作用獲得具有良好綜合性能的材料。
NCM三元正極材料存在因陽離子混排、巖鹽相生成與氧損失、表面殘余鋰、電極/電解液界面副反應、顆粒裂紋等造成的循環穩定性與倍率性能較差的問題。本文作者針對上述問題的形成原因及應對策略,進行了討論、總結與展望。
1 層狀三元正極材料NCM及合成
Z.L.Liu等[4]結合 LiCoO2、LiNiO2和 LiMnO2三者的優勢,合成了NCM三元正極材料,晶體結構與LiCoO2基本一致,同時循環穩定性要好于 LiNiO2和 LiCoO2。T.Ohzuku等[5]合成了LiNi1/3Co1/3Mn1/3O2并應用于鋰離子電池正極材料,在 2.5~4.6 V時,放電比容量高達200 mAh/g。 此后,三元材料NCM的研究逐漸增加。NCM與LiCoO2類似,具有α-NaFeO2型層狀結構,屬于 R-3m空間群,結構中O2-占據R-3m 6c位置,形成立方致密堆積的框架,Ni、Co和Mn混合占據3b八面體間隙位置,Li+占據3a八面體間隙位置。在該結構中,Li層與過渡金屬(TM)層在c軸方向上堆垛,形成二維Li+擴散路徑,使Li+可在層間進行可逆嵌脫[6]。
NCM的合成方法主要有高溫固相法、溶劑熱法、溶膠-凝膠法和共沉淀法等,目前較適用的方法是共沉淀法。該方法可解決高溫固相法中材料難以按化學計量比達到分子級、原子級混合的難題,且操作較簡單,制備的產品形貌均勻、振實密度高[7]。共沉淀法的基本操作是將鈷鹽、鎳鹽和錳鹽配成混合過渡金屬鹽溶液,再加入絡合劑、共沉淀劑等,通過控制反應溫度、pH值及攪拌速率等條件,得到前驅體,將前驅體與鋰鹽混合均勻,高溫燒結后得到三元NCM材料[7]。
2 NCM的缺點與改性
與傳統的一元層狀正極材料LiCoO2、LiNiO2和LiMnO2相比,NCM三元正極材料具有容量高、毒性小和價格低等優勢,目前已廣泛應用于商業鋰離子電池中,但仍存在一系列問題,如Li/Ni混排、巖鹽相的形成與氧損失、表面殘余鋰、電極/電解液界面副反應和存在顆粒裂紋等[8-9]。
2.1 鋰/鎳(Li/Ni)混排
2.1.1 概述
NCM層狀材料為R-3m結構,是O-Li-O-TM-O-Li-O-TMO沿立方相[111]方向的重復O3結構,如圖1(a)所示[10]。根據晶體場理論,e軌道的非配對電子自旋導致Ni3+的不穩定性,因此,Ni在面心立方八面體位置傾向于形成與Li+半徑相似的Ni2+,Ni2+在遷移至鋰層與TM層之間的四面體間隙位點后,會進一步遷移至相鄰的八面體鋰位點,并且不可逆地永久占據,此時,空間群由R-3m轉變為Fm-3m結構[見圖1(b)][10]。此外,在深度充電狀態下,由于鋰位點空出,材料結構極不穩定,Ni2+也會從TM層遷移到鋰層,以維持電荷平衡[見圖1(c)、(d)][10]。一方面,占據鋰位點的Ni2+會在充電過程中被氧化成半徑更小的Ni3+/Ni4+,導致晶體結構中鋰層間距減小,Li+遷移能壘增加;另一方面,占據鋰層位置的Ni2+也阻礙了Li+擴散。Li/Ni混排導致正極材料容鋰能力下降,在循環中表現出電極容量不可逆地下降,循環性能與倍率性能變差。
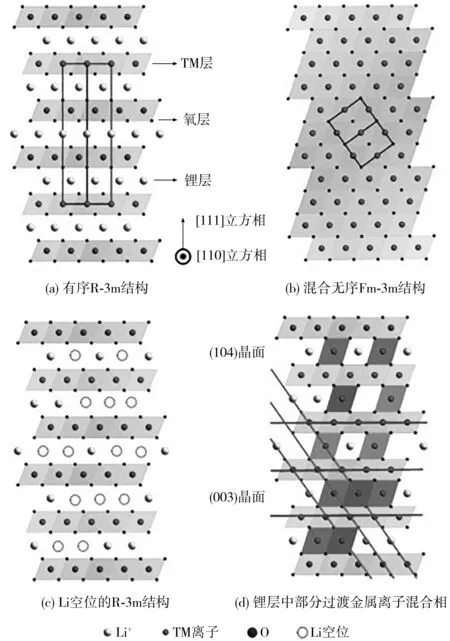
圖1 層狀NCM的有序-無序相及結構轉變[10]Fig.1 Ordered-disordered phase in layered NCM and structural transformation[10]
2.1.2 改性手段
有研究表明,金屬陽離子摻雜是抑制Li/Ni混排的一種手段[8-9]。摻入鋰位點的陽離子,可通過優先占據鋰位點來抑制Ni2+的遷移;摻入TM位點的高價陽離子,可以平衡由Ni2+帶來的反位缺陷,從而通過抑制Ni2+遷移來抑制Li/Ni混排。此外,鋰位點的摻雜元素由于不參與氧化還原反應,可作為“支柱”來穩定鋰層板結構;TM位點的摻雜元素可形成強力金屬-氧鍵,來穩定晶體結構。M.H.Chu等[11]合成了Nb摻雜的LiNi0.8Co0.1Mn0.1O2正極材料,因為 Nb5+與 Li+、TM離子的半徑均較為相近,所以能進行雙位點摻雜。Nb摻雜后的LiNi0.8Co0.1Mn0.1O2在充電過程中,晶胞參數c的變化范圍小于摻雜前,說明Nb5+在鋰位點摻雜可以緩解嚴重的晶格收縮,防止局部坍塌,穩定晶體結構,提高材料穩定性。電化學性能測試結果表明:以2 C的電流在2.7~4.5 V充放電,1%(質量分數)Nb摻雜的材料第200次循環時的容量保持率為81%,高于原始NCM的55%。在TM位點上摻雜,可以抑制Li/Ni混排、提高Li+遷移系數,改善Li+的擴散性能。這種高價態陽離子雙位點摻雜,既能穩定晶體結構,又能抑制Li/Ni混排。
摻雜的陽離子不參與充放電過程的氧化還原反應,會造成部分容量下降,因此要嚴格控制用量,以便在抑制Li/Ni混排與維持電極容量之間達到平衡。梯度摻雜策略是一種應對方法,高濃度表面使材料和電解液界面更穩定,可以減少副反應的發生,內部的低濃度元素摻雜幾乎不會影響材料容量,使材料可以兼顧穩定性和高容量[12]。H.F.Yu等[13]合成了Al梯度摻雜及同步LiAlO2包覆的LiNi0.9Co0.1O2,以1 C的電流在2.7~4.3 V充放電,第100次循環的容量保持率高達97.4%。Al梯度摻雜可將惰性元素摻雜造成的容量損失最小化,表面富集的Al元素和LiAlO2涂層可同時穩定晶體結構,防止電解液穿透邊界,并減少副反應。
2.2 巖鹽相的形成以及氧損失
2.2.1 概述
在NCM重復嵌脫鋰的過程中,脫出的鋰通常通過O2-氧化為O2來補償電荷,導致晶格氧的釋放。一旦空位的氧原子被釋放并與電解質反應,高價態Ni4+會被還原為低價態Ni2+,并從TM層的八面體位置擴散到鋰層的八面體位置,Li缺陷的陽離子空位逐漸被TM離子所取代,從而發生層狀結構到表面類尖晶石相和巖鹽相組合的不可逆相變[14-16]。S.Lee等[14]對充放電前后的LiNi0.89Mn0.055Co0.055O2進行了環形暗場掃描透射電子顯微鏡(ADF-STEM)分析,并給出了相應的(100)晶面的原子模型(見圖2)。
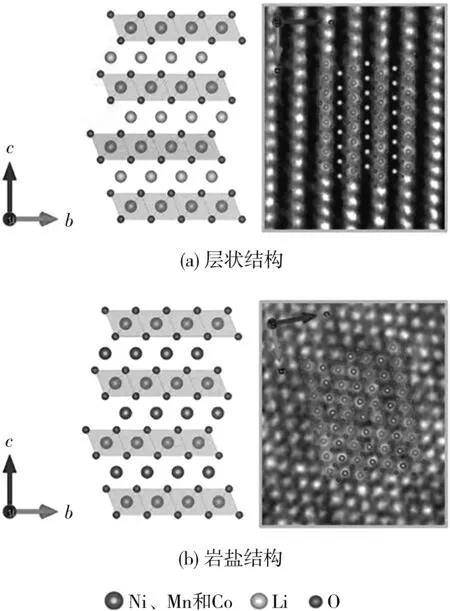
圖2 層狀結構和巖鹽結構在(100)晶面的原子結構及ADFSTEM投影[14]Fig.2 Atomic structure and annular dark-field scanning transmission electron microscopy(ADF-STEM)photographs of layered structure and rock-salt structure in the(100)plane[14]
從圖2可知,LiNi0.89Mn0.055Co0.055O2存在由層狀向巖鹽狀的轉變。隨著充放電時間的延長,這種不可逆相變會進一步由表層粒子深入到內部,消耗活性鋰位點,并產生絕緣表層,阻礙鋰擴散到內部。
2.2.2 改性手段
通過高價陽離子摻雜,形成強力金屬-氧鍵,從而抑制金屬溶解和氧空位形成,是緩解巖鹽相形成以及氧損失的一種策略[14-16]。Q.X.Ma等[17]在 Li1.2Mn0.7Ni0.2Co0.1O2中摻入Se6+,發現摻雜后的正極材料具有更好的倍率性能和循環性能。這是因為Se6+摻雜可形成強力的Se—O鍵,從而減少Ni和O原子的雜化,提高結構穩定性,進而抑制O2的產生。
表面包覆對抑制巖鹽相的形成和氧損失也有著重要的作用。Q.M.Gan等[18]在LiNi0.8Co0.1Mn0.1O2的表面包覆一層Li3PO4,高分辨透射電子顯微鏡(HRTEM)和原位XRD分析結果表明:Li3PO4層可抑制層狀結構向巖鹽樣結構的轉變。原位X射線吸收光譜和原位拉曼光譜分析發現:金屬-氧化物抑制了相變鍵的強度,從而可抑制表面氧的釋放。
2.3 表面殘余鋰
2.3.1 概述
材料在高溫煅燒過程中會有部分鋰揮發損失,因此在合成NCM的過程中,通常會加入稍微過量的鋰源,導致部分殘余鋰沉積在NCM表面。這些殘余鋰與環境中的H2O、CO2和O2反應,會產生LiOH、Li2CO3,聚集在NCM表面。這不僅會阻礙Li+的輸運,還會促進NCM與電解質、黏結劑和導電添加劑的副反應,導致氣體的生成[19]。
2.3.2 改性手段
解決NCM表面殘余鋰的方法是包覆一層能與殘余鋰反應的化合物,如Al2O3、金屬磷酸鹽等。這類化合物可以與殘余鋰反應生成高Li+遷移率的Li+主體化合物涂層,一方面抑制電極與電解液界面的副反應;另一方面促進Li+的傳輸。D.Becker等[20]以鎢酸銨為原料對LiNi0.8Co0.1Mn0.1O2進行包覆。在高溫條件下,鎢酸銨一部分分解為WO3,另一部分與表面殘留的LiOH反應,生成Li2WO4。此方法可消除表面殘余鋰,生成的WO3和Li2WO4作為涂層包覆在NCM811表面,既阻止了NCM與電解液的接觸,又通過Li2WO4增強了材料的Li+電導率。
2.4 電極/電解液界面副反應
2.4.1 概述
在高電壓時,電解質會快速分解產生HF等酸性物質,進一步誘發TM溶解;另外,還會在NCM表面生成不穩定的固體電解質相界面(SEI)膜,降低NCM的循環穩定性[8-9]。
2.4.2 改性手段
一般來講,只需在NCM表面涂覆一層不參與氧化還原反應的非活性物質(如氧化物、氟化物和磷酸鹽等),即可阻止正極材料與電解液直接接觸,從而抑制電解質的腐蝕和活性物質的分解。實際上,這類惰性物質的電子和離子電導率較低,會導致可逆能力和倍率性能降低,因此,使用Li+/電子導體涂層效果更好。Li+導體具有較高的Li+電導率,可為Li+的運輸提供通道;電子導體涂層可提供電子來抵消陽離子插入誘導的電荷不平衡,允許Li+的快速滲入。M.K.Azar等[21]在LiNi0.8Co0.1Mn0.1O2的表面負載一層還原氧化石墨烯(RGO)-ZrO2復合物,進行雙功能包覆。ZrO2涂層可以抑制LiNi0.8Co0.1Mn0.1O2顆粒和電解液的直接接觸,免受有害的副反應和HF攻擊,提升循環性能和熱穩定性;RGO涂層可彌補ZrO2涂層的低導電性,在正極材料的表面提供導電網絡,以提高電極的離子/電子電導率。
2.5 顆粒裂紋
2.5.1 概述
傳統的NCM正極材料是納米級別的一級粒子聚集成微米級別的二次顆粒。這種二級結構在反復充放電時,存在內部應變引起的初級粒子的各向異性收縮和膨脹,最終形成顆粒裂紋,導致電極材料阻抗快速增加和容量快速衰減。
顆粒裂紋是高鎳NCM降解的主要因素,因為裂紋會減少顆粒之間的連接,導致充電狀態不均勻,加劇顆粒的粉化和碎裂;還會暴露顆粒內部更多的活性位點與電解液反應,加速材料的降解。目前普遍認為,高鎳NCM材料顆粒間裂紋產生的內在原因,是高截止電壓(≥4.2 V)下的 H2→H3相變所帶來的c軸方向晶胞驟然收縮。c軸方向晶胞驟然收縮會引起不均勻的機械應力,從而導致顆粒破裂、容量衰減[22-23]。S.Y.Zheng等[22]采用原位XRD、固體原位核磁共振光譜(NMR)對LiNi0.8Co0.1Mn0.1O2高鎳材料在充放電過程中的相變進行分析,通過6Li自旋回波原位NMR中Li峰位置在-0.1%~0.2%的變化,判斷H1→H2→H3的相變。H2相的形成是由Mn位點附近的Li+(LiMn)脫出引起的。固體原位NMR顯示,Li0.91與Li0.80之間有顯著的峰位移,說明Li+從LiMn位點脫出。繼續充電,最終形成一個沒有LiMn的相,即H2相。H3相有兩種類型,即H3-1和H3-2。從Li0.22到Li0.15,峰值逐漸增加,表明Li+從Ni位點(LiNi)脫出,說明H3-1相的形成主要是由于在Ni位點附近的Li+脫出伴隨的晶胞參數c的降低引起的。當充電即將結束時,在化學位移為0附近觀察到一個新形成的峰,表明Li+重新出現在LiNi附近,形成了H3-2相。對于H3-1,Li+有逃逸LiNi的傾向;而對于H3-2,Li+可以重新排序,并形成鋰無序材料。此外,原位XRD分析顯示,隨著充電時Li+脫出數量的增加,(003)衍射峰的位置逐漸變化,對應于H1→H2→H3相變,而且在一次充放電后,峰值不能完全恢復到原來的位置,表明存在不可逆相變。這種不可逆相變的持續積累,會導致裂紋隨著循環的深入而惡化。
2.5.2 改性手段
對于顆粒裂紋問題,目前解決的辦法主要有摻雜、表面包覆及單晶結構設計[24-25]等。摻雜和包覆通過提高化學穩定性來抑制裂紋的產生。Ni位點的高價態陽離子摻雜可通過強力的M—O鍵來穩定晶體結構,減少氧空位的產生,進而延緩H2→H3相變,緩解裂紋產生。Li位點的陽離子摻雜,可以抑制Li/Ni混排,從而減少Ni2+的產生和遷移。較少的氧空位和較輕的Li/Ni混排,能夠使NCM在充放電過程中保持更穩定的帶電狀態,從而避免因Li+嵌脫不均勻所導致的內部應變。包覆可以通過保護性涂層來阻止電解液滲透到粒子中,從而抑制電解液在顆粒內部發生副反應,進而抑制裂紋的產生。H.Yang等[26]同步合成了Ti摻雜La4NiLiO8包覆LiNi0.8Co0.1Mn0.1O2正極材料。這種雙優化策略提升了LiNi0.8Co0.1Mn0.1O2的倍率和循環性能,原因是:①La4NiLiO8包覆層能抑制電解液侵蝕,提高LiNi0.8Co0.1Mn0.1O2表面的導電性;②Ti4+摻雜能抑制陽離子混排和有害的相變;③Ti和La4NiLiO8雙重改性抑制了LiNi0.8Co0.1Mn0.1O2的晶間裂紋。
此外,單晶正極由于沒有電解液滲透的晶界,可抑制因電解液滲透副反應而加劇的裂紋擴散;單晶正極具有高壓實密度,能夠在循環過程中承受更高應力而不會開裂[27-28]。G.N.Qian等[28]合成了單晶與多晶LiNi0.6Co0.2Mn0.2O2,對比發現:單晶LiNi0.6Co0.2Mn0.2O2可通過消除內部晶界和晶間斷裂來提高NCM的循環性能。
3 結論與展望
進一步提高NCM材料的電化學性能,需要解決Li/Ni混排、巖鹽相的形成與氧損失、表面殘余鋰、電極/電解液界面副反應及顆粒裂紋等問題。目前較好的解決手段,包括元素摻雜、表面包覆及單晶結構設計。摻雜可通過調節化學成分來穩定材料的內部結構,從而抑制Li/Ni混排、巖鹽相的形成與氧損失,但也存在一些缺點,如引入雜質相、降低容量等,因此,合理選擇摻雜元素及摻雜量尤為重要。后續的摻雜研究方向,應著眼于NCM中摻雜元素的作用機理,并構建完備的材料結構/功能之間的聯系,為性能改進提供科學高效的指導。表面包覆從界面角度來提高NCM的穩定性,可消除表面殘余鋰和抑制電極/電解液界面副反應,但整體性能受限于涂層本身的Li+遷移率與電導率。單晶NCM材料由于內部無晶界,可抑制裂紋產生,提高材料循環穩定性。單晶材料通常晶粒尺寸較大,Li+傳輸路徑較長,導致倍率性能不理想,因此尺寸調節尤為重要。元素摻雜及表面包覆等策略,也可用于單晶材料中,以彌補劣勢。
實現完美的產業化,高容量、高穩定性、高倍率性能、安全性與低成本缺一不可。本文作者綜述的優化策略,主要是針對穩定性、倍率性能及安全性等,而提高電極容量需要發展高鎳與富鋰NCM材料。高鎳NCM材料由于較高的Ni含量導致顆粒表面穩定性較差,同時循環過程中的表面致密化,也會導致性能快速衰減;富鋰NCM材料由于首次不可逆陰離子氧化還原反應的存在,使得首次庫侖效率較低,同時陰離子氧化還原反應還會使材料結構衰退和工作電壓降低。未來的研究,可將摻雜、包覆、單晶優化策略運用于高鎳與富鋰NCM材料中,針對性地解決材料中出現的問題,以兼具高容量、高穩定性與高倍率性能,并在此基礎上,進一步優化合成方式,提高安全性。

