HIF1α/HIF2α經EGF調控膠質瘤細胞化療抵抗機制研究*
杜 軍,汪 攀,龔 勝,趙 璐,郭海燕,廖 彬△
(1.重慶市人民醫院神經外科 401147;2.重慶市黔江中心醫院神經外科 409000)
膠質瘤作為顱內常見的腫瘤,預后差并且易復發,既往研究認為這與腫瘤組織的缺氧微環境關系密切[1-2]。腫瘤組織缺氧微環境主要由低氧誘導因子1α(hypoxia inducible facto-1α,HIF1α) 和低氧誘導因子2α(hypoxia inducible facto-2α,HIF2α)參與調控[3-5],隨著腫瘤的進展,HIF2α對腫瘤生長的影響減弱,而HIF1α變得越來越重要[6-7]。因此針對HIF1α的藥物開發成為研究熱點之一,旨在抑制患者腫瘤的生長[8]。不幸的是,這種靶向治療并不成功,它并不能顯著抑制腫瘤體積,因此,本研究通過HIF1α和HIF2α單獨敲除以及同時敲除來探究其原因。
表皮生長因子(Epidermal growth factor,EGF)在缺氧條件下高水平表達,并通過EGF受體(EGFR)和磷脂酰肌醇激酶/絲氨酸蘇氨酸激酶(PI3K/AKT)信號通路調控膠質瘤生長[9-10]。有研究認為,缺氧微環境下腫瘤高表達EGF,其與EGFR結合,從而激活PI3K/AKT信號通路,誘導HIF1α穩定表達,促進腫瘤惡性進展[11-12]。然而,很少有研究HIF1α/HIF2α與EGF之間的相互關系,本研究旨在通過體外實驗探討HIF1α和HIF2α經EGF調控膠質瘤細胞化療抵抗的機制。
1 材料與方法
1.1 材料
U87細胞和293T細胞購于中國科學院上海細胞庫。DMEM高糖培養基、0.25%胰酶和胎牛血清購于美國Gibco公司。乳酸脫氫酶細胞毒性檢測試劑盒和細胞凋亡檢測試劑盒購于上海碧云天生物技術有限公司。替莫唑胺(temozolomide,TMZ)購于中國阿拉丁公司。鼠抗人β-actin單克隆抗體購自上海生工生物科技有限公司,鼠抗人HIF1α單克隆抗體和鼠抗人HIF2α單克隆抗體購于美國Abcam公司。人EGF細胞因子購于美國R&D Systems公司。LentiCRISPRv2、pMD2.G及psPAX2質粒購于美國Addgene公司。
1.2 細胞培養及HIF1α和HIF2α基因敲除
U87細胞采用含10%胎牛血清DMEM高糖培養基,于飽和濕度、5% CO2、95% N2、37 ℃條件下培養。缺氧培養條件為飽和濕度、1% O2、5% CO2、94% N2、37 ℃。在https://chopchop.cbu.uib.no/網站查得CRISPR/CAS9敲除靶序列,HIF1α的靶序列為:5′-GAA CTC ACA TTA TGT GGA AGT GG-3′,HIF2α的靶序列為:5′-CTT GGA GGG TTT CAT TGC CGT GG-3′。根據LentiCRISPRv2質粒說明書合成帶BsmBⅠ酶切位點的靶序列DNA片段,進一步克隆至LentiCRISPRv2質粒中,對上述質粒測序并驗證插入片段,測序結果正確后將其與pMD2.G和psPAX2質粒共轉染至293T細胞行慢病毒包裝。濃縮純化的病毒感染細胞后添加嘌呤霉素予以藥物抗性篩選。根據敲除情況分為HIF1α單獨敲除組、HIF2α單獨敲除組、HIF1α/HIF2α同時敲出組,另設未轉染的U87細胞為對照組。
1.3 Western blot檢測HIF1α和HIF2α表達
各組細胞常氧或缺氧培養24 h后,收集細胞提取總蛋白并用BCA法測濃度,十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳1 h,再冰浴電轉2 h至聚偏氟乙烯(PVDF)膜。10%脫脂奶粉室溫封閉2 h。一抗β-actin(1∶2 000)、HIF1α(1∶1 000)和HIF2α(1∶1 000)4 ℃孵育過夜,二抗(1∶5 000)室溫孵育2 h,洗滌后化學發光拍照,分析蛋白條帶灰度值,以β-actin為內參。
1.4 實時熒光定量PCR(RT-qPCR)檢測EGF mRNA表達變化
各組細胞常氧或缺氧培養24 h后,收集細胞使用TRIzol提取總RNA,反轉錄為cDNA后,以cDNA為模板進行RT-PCR,以β-actin作為內參。引物序列為,EGF正向引物5′-GCC CCC CTG CCT CCT CCA AGT G-3′,反向引物5′-GGG GGT GGA GTA GAG TCA GGG CAA -3′;β-actin-正向引物5′-ACC CGC CGC CAG CTC ACC-3′,反向引物5′-GGG GGG CAC GAA GGC TCA TC-3′。反應條件:95 ℃,5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,40個循環:反應體系:2×SYBR Mix(10.0 μL)、正向引物(0.4 μL)、反向引物(0.4 μL)、cDNA(50 ng)、ddH2O補至20 μL。通過Bio-Rad CFX Manager Software軟件分析得到EGF mRNA表達水平。
1.5 ELISA檢測培養上清液中EGF水平變化
各組細胞常氧或缺氧培養72 h,收集上清液500×g離心5 min去掉細胞碎片。標準品及標本100 μL加入孔中,37 ℃孵育1 h;吸取上清液后加入100 μL檢測溶液A,37 ℃孵育1 h;洗板3次后,加入100 μL檢測溶液B,37 ℃孵育30 min;洗板3次后,加入90 μL 3,3′,5,5′-四甲基聯苯胺(TMB)底物溶液,37 ℃避光顯色10~20 min,加入50 μL終止液后用酶標儀檢測450 nm處吸光度(A)值。根據標準品A值,建立濃度-A值標準曲線,計算出各組細胞培養上清液中EGF濃度。
1.6 細胞毒性檢測
各組細胞按1×104/孔細胞接種96孔板,加入不同濃度TMZ(400、800 μmol/L)再常氧或缺氧培養72 h再進行乳酸脫氫酶(LDH)釋放檢測,96孔板400×g離心5 min,取120 μL上清液于另一96孔板,各孔加入60 μL LDH檢測工作液,室溫避光孵育30 min,酶標儀檢測490 nm處A值。計算各組細胞毒性:細胞毒性率(%)=(處理樣品A值-樣品對照孔A值) /(細胞最大酶活性A值-樣品對照孔A值)×100。細胞最大酶活性A值為TMZ藥物處理的細胞孔經裂解后檢測LDH的A值。
1.7 細胞凋亡率檢測
各組細胞缺氧培養24 h后,添加TMZ(200 μmol/L)再缺氧培養72 h,通過流式細胞儀檢測細胞凋亡。細胞經消化為單個細胞后取1×105個細胞重懸于100 μL預冷PBS中, 300×g離心5 min,棄上清液;加入195 μL結合緩沖液和5 μL Annexin V-FITC重懸細胞,室溫避光孵育15 min,300×g離心5 min,棄上清液;加入190 μL結合緩沖液及10 μL碘化丙啶(PI)溶液重懸細胞,室溫避光孵育10 min后冰上放置并進行流式檢測,保存數據并進行統計分析。
1.8 統計學處理
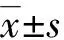
2 結 果
2.1 Western blot驗證U87細胞HIF1α、HIF2α敲除效果
缺氧條件下,HIF1α單獨敲除組HIF1α表達水平降低,HIF2α單獨敲除組HIF2α表達水平降低,HIF1α/HIF2α同時敲除組2個蛋白表達水平均降低,見圖1。
A:對照組;B:HIF1α單獨敲除組;C:HIF2α單獨敲除組;D:HIF1α/HIF1α同時敲除組。
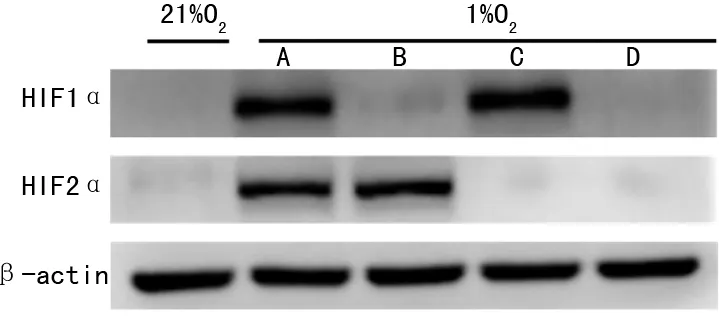
2.2 U87細胞HIF1α和HIF2α敲除后EGF表達檢測
U87細胞EGF mRNA表達水平缺氧條件較常氧條件顯著升高(P<0.05);缺氧培養24 h后,HIF1α、HIF2α單獨敲除組及HIF1α/HIF2α同時敲除組EGF mRNA表達水平低于對照組(P<0.05),且HIF1α/HIF2α同時敲除組也低于HIF1α和HIF2α單獨敲除組(P<0.05);缺氧培養72 h后,HIF1α、HIF2α單獨敲除及HIF1α/HIF2α同時敲除組細胞培養上清液中EGF濃度低于對照組(P<0.05),同時HIF1α/HIF2α同時敲除組EGF濃度也低于HIF1α和HIF2α單獨敲除組(P<0.05)。見圖2。
A:PCR檢測EGF mRNA結果分析;B:ELISA檢測培養上清液中EGF濃度結果分析;a:P<0.05。
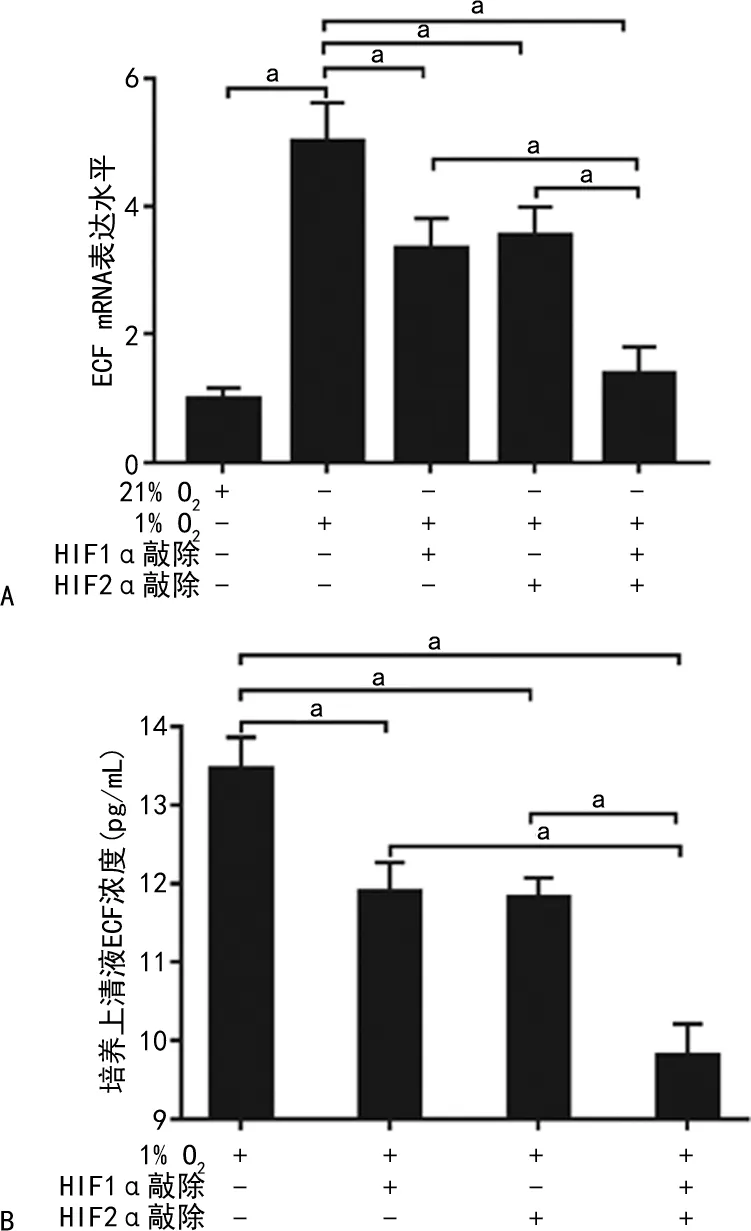
2.3 U87細胞HIF1α和HIF2α敲除后TMZ對其細胞毒性的檢測
TMZ(400、800 μmol/L)處理對U87細胞毒性率缺氧培養比常氧培養明顯降低(P<0.05);缺氧培養72 h,HIF1α、HIF2α單獨敲除組細胞毒性率較對照組差異無統計學意義(P>0.05),HIF1α/HIF2α同時敲除細胞毒性率較對照組及HIF1α、HIF2α單獨敲除組升高(P<0.05)。TMZ(200 μmol/L)處理并缺氧培養72 h,HIF1α、HIF2α單獨敲除組及HIF1α/HIF2α同時敲除細胞凋亡率均高于對照組(P<0.05),且HIF1α/HIF2α同時敲除組細胞凋亡率高于HIF1α、HIF2α單獨敲除組(P<0.05)。見圖3。
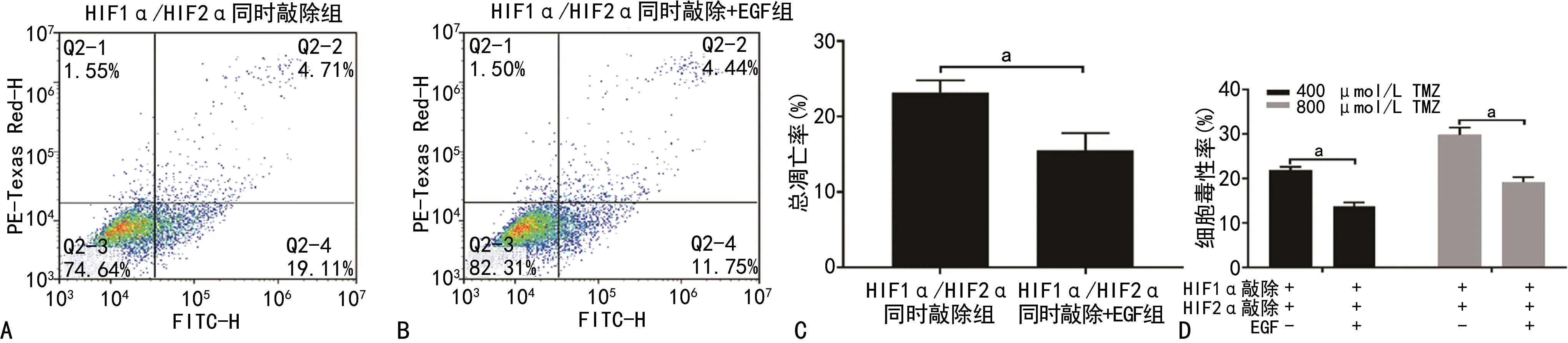
2.4 EGF對HIF1α和HIF2α同時敲除組細胞毒性率和凋亡率的影響
在TMZ(400、800 μmol/L)處理并缺氧培養72 h的HIF1α/HIF2α同時敲除組細胞加入EGF(20 ng/mL),細胞的細胞毒性率和細胞凋亡率(TMZ 200 μmol/L)明顯低于未加入EGF的細胞(P<0.05)。見圖4。
A~D:細胞凋亡檢測圖;E:細胞凋亡檢測統計分析結果;F:細胞毒性檢測統計分析結果;a:P<0.05。
a:P<0.05;A、B:細胞凋亡檢測圖;C:細胞凋亡檢測統計分析結果;D:細胞毒性檢測統計分析結果。
3 討 論
由于腫瘤組織血管無序化和腫瘤細胞高代謝,所以膠質瘤細胞始終處于一個缺氧的微環境中[13]。已有研究證實,缺氧微環境可促進腫瘤細胞增殖及維持膠質瘤干細胞干性從而抑制凋亡及產生化療抵抗[14]。而在缺氧微環境中,HIF1α和HIF2α起主要調控作用[5]。因此,抑制HIF1α或HIF2α可抑制腫瘤的發生發展及復發。例如,抑制HIF1α表達可增加膠質瘤細胞對化療藥物的敏感性[7],而靶向膠質瘤干細胞中的HIF2α可降低腫瘤的復發[15]。因此,這些研究強烈支持開發HIF抑制劑治療膠質瘤,因為在理論上可以抑制腫瘤的進展。一些HIF抑制劑已經被批準進入了臨床試驗階段。然而,截至目前,還沒有HIF靶向治療成功治愈膠質瘤的報道。本研究在對HIF1α和HIF2α單獨敲除之后又進行了同時敲除,均檢測了在缺氧條件下TMZ處理對細胞毒性和凋亡的影響。結果證實單獨敲除HIF1α和HIF2α缺氧條件下TMZ處理后的細胞毒性率與對照組比較差異無統計學意義(P>0.05),而同時敲除組較兩單獨敲除組和對照組細胞毒性率和細胞凋亡率均顯著增高。筆者認為HIF1α和HIF2α均參與調控膠質瘤細胞化療抵抗。結合課題組前期研究,缺氧條件下HIF1α敲除之后HIF2α蛋白表達水平升高,同時HIF2α敲除之后HIF1α蛋白表達水平升高[16],所以單獨敲除其中一個蛋白后另一個蛋白表達升高彌補了敲除蛋白的作用繼續產生化療抵抗。
在膠質瘤中已有報道EGF是HIF1α的上游蛋白[17]。而在本研究中,敲除HIF1α和HIF2α之后,EGF表達水平下降。同時HIF1α和HIF2α同時敲除細胞培養基中添加EGF因子,缺氧條件下TMZ對細胞的毒性和細胞凋亡均降低。HIF1α和HIF2α具有高度的同源性,并具有一些相同的靶基因,這表明它們可能與相同的HRE序列結合。HIF1α和HIF2α都含有一個保守的DNA結合區域,稱為bHLH-PAS結構域,其與靶基因啟動子里面HREs結合后促進該基因表達[18]。因此,筆者前期研究中,已驗證了在缺氧膠質瘤細胞中HIF1α和HIF2α可通過結合EGF啟動子上HRE序列AGGCGTGG和GGGCGTGG影響EGF啟動子活性。因此,HIF1α和HIF2α與EGF之間存在反饋調控。EGF促進HIF1α的表達,相反,HIF1α和HIF2α的上調促進EGF的表達。總之,HIF1α和HIF2α可通過EGF調控膠質瘤的發生發展和復發,這為膠質瘤的治療提供了新的靶點和策略。

