調味香料草果中多酚類化合物抗氧化活性成分的快速篩選
杜麗霞,姜子濤,2*,周烜
(1.天津天獅學院 食品工程學院,天津 301700;2.天津商業大學生物技術與食品科學學院,天津 300134)
草果被人們譽為食品調味香料中的“五香之一”,被廣泛應用于四川火鍋、麻辣香鍋、鹵制菜品中,起到去腥、增香的作用。草果(Amomumtsaoko),別名紅草果、草果仁、草果子,是姜科豆蔻屬多年生草本植物,主要分布于中國云南、廣西、貴州等省區。草果中含有多種活性成分,如揮發油[1-3]、甾醇類[4]和黃酮類[5-6]等,這些豐富的化學成分使其具有抗氧化、抗菌、抗炎鎮痛、抗腫瘤等多種生物活性[7-10],在食品、藥品、保健品及化妝品等行業具有良好的應用前景。目前,國內外對草果的研究主要集中在揮發油的分離鑒定及揮發油的抗氧化、抗菌等活性[11-14],而對其中的多酚類化合物研究較少,多酚類化合物活性的研究更少[15-17]。本文提出了一種未涉及復雜費時的單體分離前提下,對草果提取物中每一個酚類成分抗氧化活性進行評價的方法。作者采用乙醇溶液作為提取劑的微波輔助提取法從草果中提取多酚,通過單因素試驗和正交試驗確定了草果多酚的最佳提取條件;采用高效液相色譜-串聯質譜法(LC-MS/MS)鑒定了草果多酚的化學成分;以1,1-二苯基-2-三硝基苯肼自由基(DPPH)為探針,對每一個多酚類化合物的抗氧化活性進行了評價,為復雜混合物中抗氧化劑活性成分的快速篩選開拓了一條新途徑。
1 材料與方法
1.1 材料與儀器
草果:云南省保山市,粉粹后過40目篩,密封避光保存;DPPH:美國Sigma-Aldrich公司;蘆丁標準品:上海源葉生物科技有限公司;無水乙醇:天津市風船化學試劑科技有限公司;D101大孔樹脂:天津南大樹脂科技有限公司,使用前按照文獻[18]進行預處理;試驗用水均為去離子水,所用試劑均為分析純。
LC-15C高效液相色譜儀 島津管理(中國)有限公司;CW-2000超聲-微波協同萃取/反應儀 上海新拓分析儀器科技有限公司;Agilent G6410A LC-MSD QQQ液相色譜-質譜/質譜聯用儀 美國Agilent公司;UV1000單光束紫外可見分光光度計 上海天美科學儀器有限公司。
1.2 試驗方法
1.2.1 草果多酚的提取方法
精密稱取定量粉碎過篩的草果粉末于超聲-微波協同萃取儀配套的提取瓶中,加入定量濃度的乙醇溶液,置于超聲-微波協同萃取儀中,關閉超聲功能,開啟微波功能,將微波功率調至400 W,調好提取溫度和時間后進行微波輔助提取,提取完的溶液以4000 r/min的轉速離心20 min,上清液即為草果多酚提取液。
1.2.2 草果多酚得率的測定方法
用參考文獻[18]中的方法制作蘆丁標準曲線,得到線性回歸方程為y=0.4307x+0.0063,R2=0.9991。
準確吸取1.2.1中制備的草果多酚上清液5 mL,加蒸餾水10 mL,混勻后,準確吸取稀釋后的上清液1 mL置于25 mL容量瓶中,從加水至6 mL開始,按照參考文獻[18]中的方法進行顯色和測定,最后按此公式計算。草果多酚得率(%)=(C×N×V)/10M。式中:C為樣品吸光度值帶入線性回歸方程中計算出的多酚提取液濃度(mg/mL);N為稀釋倍數;V為提取液體積(mL);M為樣品質量(g)。
1.2.3 草果多酚提取工藝條件的優化
先進行四因素五水平的單因素試驗,找到乙醇濃度、提取溫度、料液比和提取時間這4個單因素下的最優水平,然后設計四因素三水平的正交試驗L9(34),最后得到草果多酚最佳提取工藝條件。
1.2.4 草果多酚的純化方法
以濕法裝柱,制備D101大孔樹脂層析柱,將1.2.1方法中制備的草果上清液稀釋至多酚濃度為1.0 mg/mL,用0.1 mol/L的鹽酸調節pH至4后,以2 BV/h(BV為樹脂床體積)的流速進行上樣,直至流出液吸光度達到泄漏點時停止,然后用蒸餾水洗滌層析柱至流出液無色、無醇味后,用70%乙醇溶液以2 BV/h的流速進行解吸,收集解吸液,將解吸液的多酚濃度稀釋至0.5 mg/mL,備用。
1.2.5 草果多酚的定性分析
液相色譜條件:Zorbax SB-C18色譜柱(250 mm×4.6 mm×5 μm),柱溫30 ℃,流動相A為甲醇,流動相B為0.1%甲酸溶液,梯度洗脫條件為0~30 min:40%~75% A,30~35 min:75% A,流速0.3 mL/min,進樣量5 μL。
質譜條件:離子源為ESI負離子源,噴霧電壓為4000 V;霧化氣體為N2,霧化氣壓力為35 psi,霧化氣流速為10 L/min,離子源溫度為350 ℃;碰撞氣體為N2,碰撞氣壓力為0.15 MPa。
1.2.6 草果多酚清除DPPH自由基有效成分的識別
取純化后并經0.22 μm有機濾膜過濾后的草果多酚提取液兩份:一份直接用HPLC分離測定;另一份與5 mL DPPH溶液混合均勻,反應1 h后,再用HPLC分離測定。兩次測定的色譜條件均為:色譜柱C18柱;流動相為乙腈∶水為75∶25(V/V);流速0.8 mL/min;檢測波長268 nm;色譜柱溫度為室溫(25 ℃),進樣量5 μL。最后根據草果多酚提取液與DPPH溶液反應前后色譜峰面積的變化情況,計算出草果多酚提取物中每一成分清除DPPH自由基的清除率。
2 結果與分析
2.1 提取草果多酚的單因素試驗結果
草果多酚的單因素試驗結果見圖1。


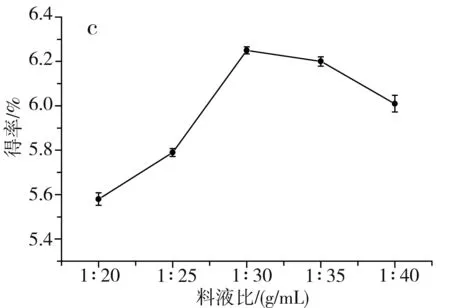

圖1 單因素對草果多酚得率的影響Fig.1 Effect of single factor on the extraction yield of polyphenols from Amomum tsaoko注:a為乙醇濃度的影響;b為溫度的影響;c為料液比的影響;d為時間的影響。
由圖1中a可知,當乙醇濃度由40%升到70%時,醇溶性的多酚逐漸被提取出來,多酚得率隨之升高,當進一步升高乙醇濃度至80%時,會導致部分水溶性的多酚不能被充分提取出來,多酚得率隨之下降,當乙醇濃度為70%時,草果多酚的得率最高,因此選擇70%為最佳乙醇濃度。由圖1中b可知,當提取溫度在40~70 ℃之間時,草果多酚的得率隨著提取溫度的升高而提高,這是因為升高提取溫度,加速了分子的運動,更有利于多酚物質從細胞中溶出,當提取溫度進一步提高到80 ℃時,多酚得率反而降低,這是因為過高的提取溫度會使多酚氧化分解,因此選擇70 ℃為最佳提取溫度。由圖1中c可知,當料液比為1∶30時,多酚得率最高;當料液比低于1∶30時,溶劑量過少,達到飽和后,多酚不再溶出;當料液比高于1∶30時,溶劑量過多,不利于微波的傳導,使得多酚得率稍有下降。由圖1中d可知,當提取時間為10 min時,草果多酚得率最高;當時間低于10 min時,時間過短,多酚未被充分提取出來;當時間高于10 min時,微波會加速多酚的氧化分解,所以隨著微波時間進一步加長,多酚得率反而逐漸下降,因此選擇10 min為最佳提取時間。
與文獻[6]、文獻[16]、文獻[17]比較可知,微波輔助提取能夠顯著縮短草果多酚的提取時間,其提取時間為超聲波輔助提取法的1/4,為傳統溶劑提取法的1/15,同時微波輔助提取法的多酚得率也要高于這兩種方法,這是因為微波能促使植物的細胞組織破壁或變形,使多酚成分更加快速且充分地溶出。
2.2 提取草果多酚的正交試驗結果
正交試驗結果見表1。
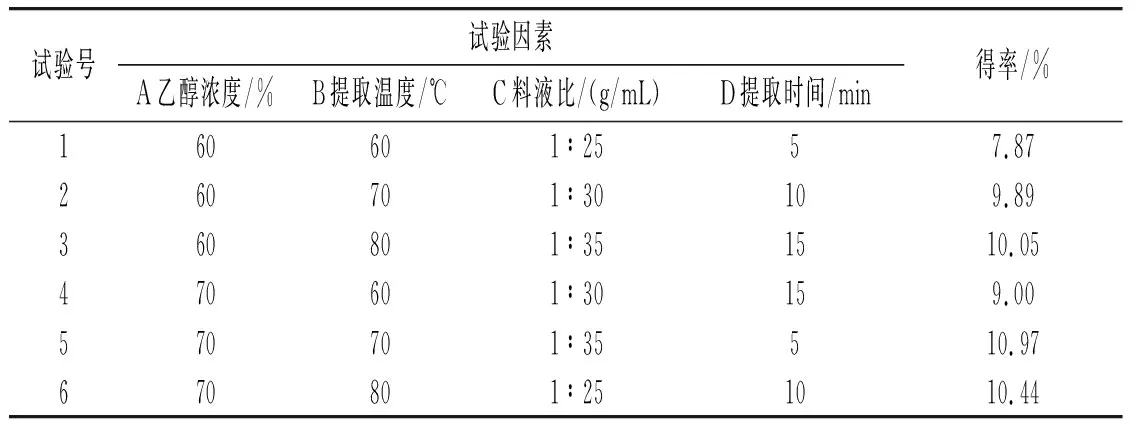
表1 正交試驗結果Table 1 The results of orthogonal test
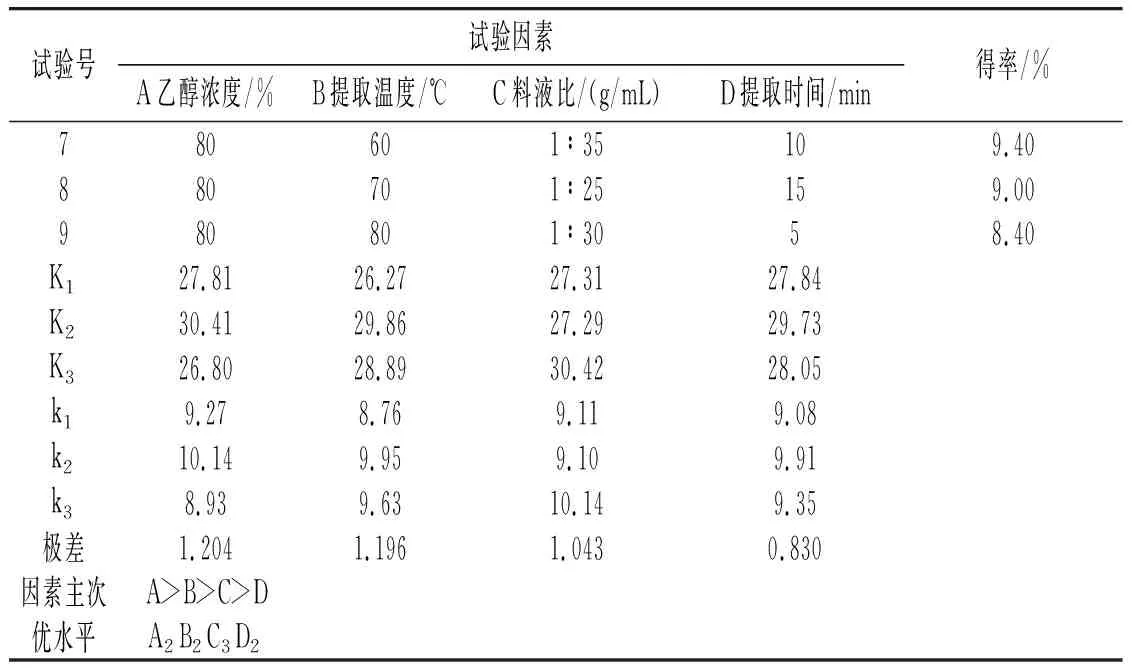
續 表
由表1可知,對草果多酚得率影響最大的因素是乙醇濃度,然后是提取溫度,最后是料液比和提取時間。草果多酚的最佳提取工藝條件為:乙醇濃度70%、提取溫度70 ℃、料液比1∶35(g/mL)、提取時間10 min。在此條件下平行提取3次,得到的草果多酚得率分別為11.08%、11.15%、11.17%,平均值為11.13%。
2.3 草果多酚成分分析
草果多酚的總離子流圖見圖2,在其質譜條件下分析得到草果中3種多酚類化合物的母離子和碎片離子信息,見表2。

圖2 草果多酚的總離子流圖Fig.2 The total ion flow diagram of polyphenols from Amomum tsaoko

表2 草果多酚的LC-MS/MS數據Table 2 LC-MS/MS data of polyphenols from Amomum tsaoko
通過比對樣品與標準品的保留時間、母離子及其碎片離子的數據以及圖譜解析,確定出了草果多酚提取物中3種多酚類化合物,分別是原兒茶醛、漢諾基諾醇和雙氫楊梅樹皮素二聚體,分別占總量的7.2%、65.3%和17.3%。原兒茶醛樣品(1號峰)及標準品的質譜圖是非常吻合的(見圖3中a);通過圖譜解析和文獻比對,確定2號峰為漢諾基諾醇,m/z 315.1是漢諾基諾醇的[M-1]準分子離子峰,其發生α-裂脫掉HO-C6H4-C4H7(OH)-基團,得到m/z 149的碎片離子,其裂解規律及其質譜圖見圖3中b,此結果和Martin等[19]和Zhang等的結果是一致的;3號峰 m/z 639.4為雙氫楊梅樹皮素二聚體的[M-1]準分子離子峰,m/z 331.1為雙氫楊梅樹皮素單體峰(含一分子水)。根據二級質譜圖譜解析和文獻比對,該成分被確定為雙氫楊梅樹皮素二聚體[20],其分子裂解規律及質譜圖見圖3中c。由表2可知,漢諾基諾醇為草果多酚的主要成分。
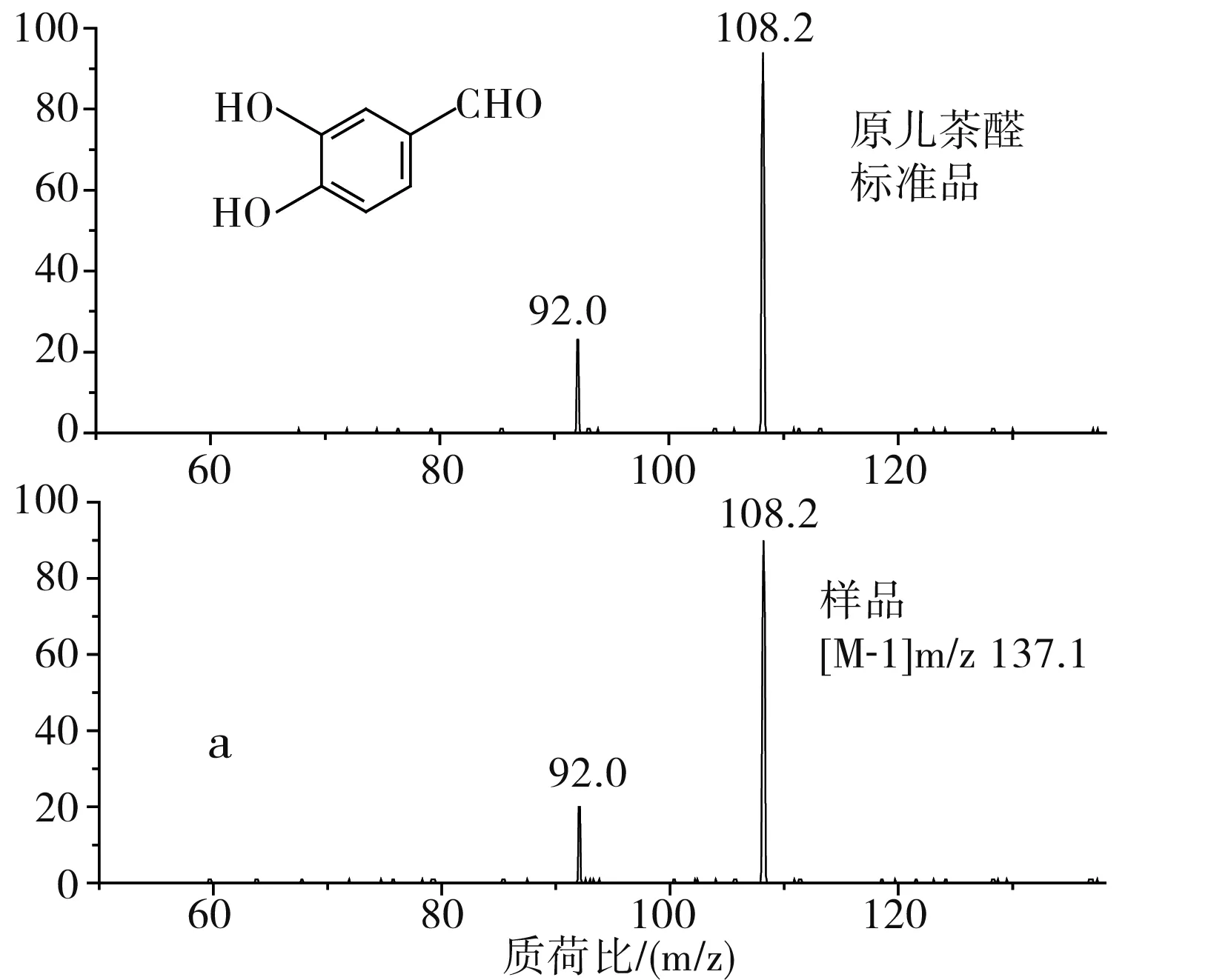


圖3 草果多酚與相應標準品的二級質譜比對圖Fig.3 Comparison of MS2 spectra of polyphenols from Amomum tsaoko and corresponding standard samples
2.4 草果多酚清除DPPH自由基有效成分的識別
草果多酚與DPPH反應前后的HPLC圖見圖4。抗氧化活性越強的多酚類化合物與DPPH自由基反應的能力就越強,而大量被消耗,反映到HPLC圖上就是該多酚化合物與DPPH反應后的峰面積較反應前大大降低,所以峰面積下降越多的多酚化合物其清除DPPH自由基及抗氧化活性越強。

圖4 草果多酚與DPPH自由基反應前后的HPLC圖Fig.4 HPLC chromatogram of polyphenols from Amomum tsaoko before and after reacted with DPPH free radicals注:1為原兒茶醛,2為漢諾基諾醇,3為雙氫楊梅樹皮素二聚體。
試驗結果顯示:原兒茶醛與DPPH反應后,峰面積下降了4.56%,漢諾基諾醇與DPPH反應后,峰面積下降了24.02%,雙氫楊梅樹皮素二聚體與DPPH反應后,峰面積下降了21.84%。可見3種多酚類化合物均具有抗氧化及清除DPPH自由基的能力,但它們之間活性強度存在差異,其活性順序依次為漢諾基諾醇>雙氫楊梅樹皮素二聚體>原兒茶醛,其中漢諾基諾醇的抗氧化及DPPH自由基的清除能力最強。另外,其余的一些微量成分也表現出一定的抗氧化能力。有研究表明,草果總多酚的抗氧化能力高于Vc。因此,草果總多酚所表現出來的較強抗氧化活性是所有多酚協同作用的結果,漢諾基諾醇起主要作用。
3 結論
采用微波輔助提取法從調味香料草果中提取多酚類化合物,確定了最佳提取條件為:乙醇濃度70%、提取溫度70 ℃、料液比1∶35(g/mL)、提取時間10 min,草果多酚的得率為11.13%。用LC-MS/MS對草果多酚成分進行分析,鑒定出3種多酚類化合物:原兒茶醛、漢諾基諾醇和雙氫楊梅樹皮素二聚體。同時,采用DPPH自由基作探針識別出草果中抗氧化活性較強的多酚類化合物,從結果上看,草果多酚中起主要抗氧化作用的是主成分漢諾基諾醇,其余大部分都具有抗氧化活性,但活性強弱有較大差異,這些多酚在草果中由于含量較低,起到輔助的作用。

