1-脫氧野尻霉素的N-取代苯丙烷衍生物的合成
王峰峰,方志杰
(南京理工大學化學與化工學院,江蘇 南京 210014)
1-脫氧野尻霉素(DNJ)的化學名為(2R,3R,4R,5S)-2-羥甲基哌啶-3,4,5-三醇,在一系列治療糖尿病的藥物中,DNJ是國際上公認的副作用較小的生物制劑之一。DNJ及其衍生物可作為治療糖尿病、病毒感染、腫瘤轉移及溶酶體儲存紊亂等疾病的藥物。近年來,研究人員采用多種方法對DNJ結構進行修飾,最主要的手段是在DNJ中引入不同的疏水性基團來增強其親脂性[1],開發了一系列結構各異的DNJ衍生物,其中N-取代衍生物一直是研究熱點之一。目前已設計了一系列具有不同生物活性的DNJ的N-取代衍生物[2-4],一部分DNJ衍生物已經商品化,但是絕大多數仍處于臨床研究前期或產品開發階段。DNJ的N-取代苯丙基衍生物不僅可治療多種病毒(如艾滋病毒、登革熱病毒等)感染,還能顯著抑制癌細胞轉移。目前報道的DNJ的N-取代苯丙基衍生物的合成路線[5-8]都是以DNJ為起始原料,與鹵代物在堿性條件下取代或與含醛基的化學試劑進行還原胺化反應,存在原料價格昂貴、含苯丙基的取代試劑合成方法繁瑣、環境污染較大等缺點。鑒于此,作者以(2R,3R,4R,5S)-3,4,5-三(芐氧基)-2-((芐氧基)甲基)哌啶鹽酸鹽(Ⅰ)為起始原料,與取代苯乙酮(Ⅱa~Ⅱc)及多聚甲醛在無水乙醇中經曼尼希反應縮合得到中間體1-(4-取代苯基)-3-((2R,3R,4R,5S)-3,4,5-三(芐氧基)-2-((芐氧基)甲基)哌啶-1-基)丙烷-1-酮(Ⅲa~Ⅲc),再經Pd(OH)2/C加氫、脫芐、脫氧得到DNJ的N-取代苯丙烷衍生物(Ⅳa~Ⅳc),通過1HNMR、13CNMR、LC-MS對產物結構進行表征。合成路線如圖1所示。
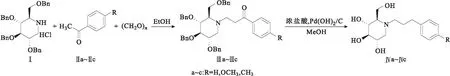
圖1 DNJ的N-取代苯丙烷衍生物的合成路線
1 實驗
1.1 試劑與儀器
苯乙酮、多聚甲醛、無水乙醇、甲醇、濃鹽酸,分析純,國藥集團化學試劑有限公司;4-甲氧基苯乙酮、4-甲基苯乙酮,分析純,上海麥克林生化科技有限公司;20%Pd(OH)2/C,分析純,陜西瑞科新材料股份有限公司。
SHZ-D(Ⅲ)型循環水式多用真空泵、RE-2000型旋轉蒸發器、98-2型磁力攪拌器,上海積坤實驗儀器有限公司;JA2003型電子天平,上海舜宇恒平科學儀器有限公司;DFY-5L/25型低溫恒溫浴、DZF-6050型真空干燥箱,卯氏(上海)實驗儀器有限公司;HWCL-3型集熱式恒溫磁力攪拌浴,鄭州長城科工貿有限公司。
1.2 方法
1.2.1 1-(4-取代苯基)-3-((2R,3R,4R,5S)-3,4,5-三(芐氧基)-2-((芐氧基)甲基)哌啶-1-基)丙烷-1-酮(Ⅲa~Ⅲc)的合成
將30 mL無水乙醇、3.0 g(5.36 mmol)(2R,3R,4R,5S)-3,4,5-三(芐氧基)-2-((芐氧基)甲基)哌啶鹽酸鹽(Ⅰ)、8.32 mmol取代苯乙酮(Ⅱa~Ⅱc)、0.25 g(8.32 mmol)多聚甲醛加入50 mL反應罐中,85 ℃油浴反應8 h后,降至室溫,加入1 mL氨水調節pH值至8~9,減壓旋干,用200~300目硅膠拌樣過柱,洗脫劑為石油醚(PE)-乙酸乙酯(EA) (10∶1,體積比,下同),洗脫液減壓旋干,得到化合物Ⅲa~Ⅲc。
1.2.2 DNJ的N-取代苯丙烷衍生物(Ⅳa~Ⅳc)的合成
將1.0 g化合物Ⅲa~Ⅲc、40 mL甲醇加入反應瓶中,攪拌溶解,加入0.6 mL濃鹽酸、150 mg 20%Pd(OH)2/C,依次用氮氣置換6次、氫氣置換6次,20~30 ℃保溫反應50 h,過濾,濾餅分別用5 mL甲醇、5 mL水淋洗,加入20%碳酸鈉溶液調節pH值至8~9,減壓旋干,加入5 mL甲醇充分攪拌后,過濾除去不溶物,濾液減壓旋干,用200~300目硅膠拌樣過柱,洗脫劑為EA-甲醇(5∶1),洗脫液減壓旋干,得到化合物Ⅳa~Ⅳc。
2 結果與討論
2.1 合成工藝優化
2.1.1 投料量對收率的影響
以化合物Ⅲa的合成為例,在固定化合物Ⅰ投料量為1.0 eq.的情況下,考察苯乙酮與多聚甲醛的投料量對化合物Ⅲa收率的影響,結果如表1所示。
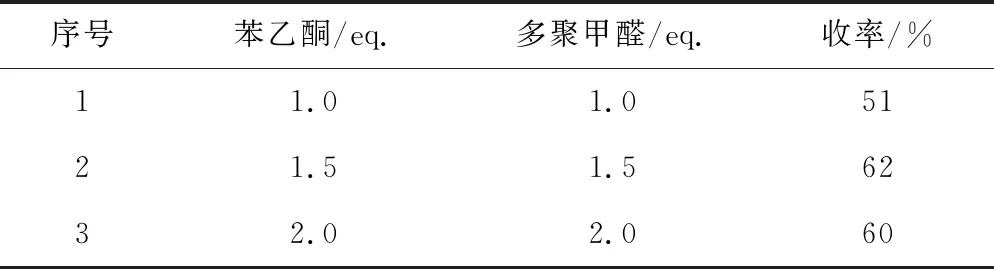
表1 苯乙酮與多聚甲醛的投料量對化合物Ⅲa收率的影響
由表1可知,當苯乙酮與多聚甲醛的投料量均為1.0 eq.時,化合物Ⅲa收率為51%;當二者的投料量均增至1.5 eq.時,收率提高到62%;繼續增加二者的投料量至2.0 eq.時,收率反而有所下降,為60%,可能是由于生成了較多的副產物。因此,選擇苯乙酮與多聚甲醛的投料量均為1.5 eq.。
2.1.2 反應時間對收率的影響
在化合物Ⅰ與苯乙酮、多聚甲醛的物質的量比為1∶1.5∶1.5、反應溫度為80~85 ℃的條件下,考察反應時間對化合物Ⅲa收率的影響,結果如表2所示。

表2 反應時間對化合物Ⅲa收率的影響
由表2可知,當反應時間為2 h時,化合物Ⅲa收率為15%;隨著反應時間的延長,收率逐漸升高,當反應時間為8 h時,收率達到最高,為62%;繼續延長反應時間至16 h,收率變化不明顯。因此,選擇反應時間為8 h。
2.2 結構表征
1-苯基-3-((2R,3R,4R,5S)-3,4,5-三(芐氧基)-2-((芐氧基)甲基)哌啶-1-基)丙烷-1-酮(Ⅲa):白色固體,收率62.7%。1HNMR(DMSO,400 MHz),δ:7.97(d,J=7.2 Hz,2H),7.64(t,J=7.4 Hz,1H),7.52(t,J=7.7 Hz,2H),7.36~7.22(m,18H),7.19~7.15(m,2H),4.90~4.84 (m,1H),4.80~4.65 (m,3H),4.62~4.56(m,1H),4.47~4.33(m,3H),3.68(d,J=9.9 Hz,1H),3.58(dd,J=10.5 Hz、3.8 Hz,1H),3.50~3.36(m,2H),3.31~3.26(m,1H),3.24~3.10(m,4H),3.06~2.93(m,1H),2.45(dd,J=9.3 Hz、1.9 Hz,1H),2.23(t,J=10.5 Hz,1H);LC-MS,m/z:656[M+H]+。
1-(4-甲氧基苯基)-3-((2R,3R,4R,5S)-3,4,5-三(芐氧基)-2-((芐氧基)甲基)哌啶-1-基)丙烷-1-酮(Ⅲb):白色固體,收率56.5%。1HNMR(DMSO,400 MHz),δ:7.95~7.89(m,2H),7.40~7.23(m,18H),7.14(d,J=7.7 Hz,2H),6.96~6.90(m,2H),5.02~4.96(m,1H),4.93~4.81(m,2H),4.74~4.63(m,2H),4.57~4.50(m,1H),4.49~4.39(m,2H),3.90(s,3H),3.74~3.66(m,3H),3.58(t,J=9.2 Hz,1H),3.51(t,J=9.0 Hz,1H),3.30~3.22(m,1H),3.18~3.11(m,2H),3.08~2.99(m,2H),2.44(d,J=9.3 Hz,1H),2.33(t,J=10.8 Hz,1H)。
1-(4-甲基苯基)-3-((2R,3R,4R,5S)-3,4,5-三(芐氧基)-2-((芐氧基)甲基)哌啶-1-基)丙烷-1-酮(Ⅲc):白色固體,收率57.4%。1HNMR(DMSO,400 MHz),δ:7.90~7.83(m,2H),7.37~7.20(m,18H),7.08~6.95(m,2H),6.90~6.84(m,2H),4.82~4.73(m,1H),4.69~4.62(m,2H),4.59~4.51(m,2H),4.45~4.30(m,3H),3.69~3.60(m,3H),3.50(s,1H),3.42(t,J=9.0 Hz,1H),3.26~3.20(m,1H),3.15~3.03(m,2H),2.97~2.83(m,2H),2.42(d,J=9.0 Hz,1H),2.38(s,3H),2.12(t,J=10.5 Hz,1H)。
(2R,3R,4R,5S)-2-(羥甲基)-1-(3-苯基丙基)哌啶-3,4,5-三醇(Ⅳa):黃色固體,收率74.6%。1HNMR(DMSO,400 MHz),δ:7.31~7.14(m,5H),4.70(s,3H),4.15(s,1H),3.71(d,J=11.2 Hz,1H),3.54(d,J=10.6 Hz,1H),3.25~3.17(m,1H),3.05(t,J=8.8 Hz,1H),2.92(t,J=8.8 Hz,1H),2.85~2.74(m,2H),2.60~2.41(m,3H),2.04~1.95(m,2H),1.75~1.62(m,2H);LC-MS,m/z:282 [M+H]+。
(2R,3R,4R,5S)-2-(羥甲基)-1-(3-(4-甲氧基苯基)丙基)哌啶-3,4,5-三醇(Ⅳb):黃色固體,收率65.2%。1HNMR(DMSO,400 MHz),δ:7.15~7.07(m,2H),6.85~6.81(m,2H),4.75~4.62(m,3H),4.13(s,1H),3.72(s,3H),3.68(s,1H),3.58~3.50(m,1H),3.26~3.17(m,1H),3.05(td,J=8.9 Hz、4.7 Hz,1H),2.92(t,J=8.3 Hz,1H),2.84~2.72(m,2H),2.50~2.37(m,3H),2.02~1.91(m,2H),1.71~1.59(m,2H);13CNMR(DMSO,101 MHz),δ:157.77,134.52,129.56,114.11,79.62,71.24,69.88,67.14,59.50,57.39,55.42,52.16,32.63,27.14。
(2R,3R,4R,5S)-2-(羥甲基)-1-(3-(4-甲基苯基)丙基)哌啶-3,4,5-三醇(Ⅳc):黃色固體,收率70.0%。1HNMR(DMSO,400 MHz),δ:7.07(s,4H),4.74~4.59(m,3H),4.11(s,1H),3.70(d,J=11.3 Hz,1H),3.58~3.49(m,1H),3.26~3.17(m,1H),3.10~3.00(m,1H),2.91(td,J=8.7 Hz、3.7 Hz,1H),2.84~2.71(m,2H),2.50~2.36(m,3H),2.26(s,3H),2.01~1.88(m,2H),1.73~1.60(m,2H);13CNMR(DMSO,101 MHz),δ:139.56,134.86,129.26,128.53,79.65,71.28,69.91,67.16,59.57,57.42,52.20,33.12,27.02,21.09。
2.3 反應機理
基于實驗結果和已有的文獻報道,其可能的反應機理(圖2)為:在酸性條件下羰基發生質子化,胺基上的孤對電子對羰基進行親核加成,氮上的質子轉移到羥基上,在脫水的同時氮上的電子發生轉移,得到一個亞胺離子中間體,亞胺離子進攻含活潑氫化合物的烯醇型結構,同時失去質子,最終發生氨甲基化反應,得到中間體Ⅲ;中間體Ⅲ經催化加氫,羰基被還原為羥基,在酸性條件下,芐位羥基質子化脫水形成碳正離子,再進一步奪取氫負離子同時脫去質子,得到目標化合物Ⅳ。
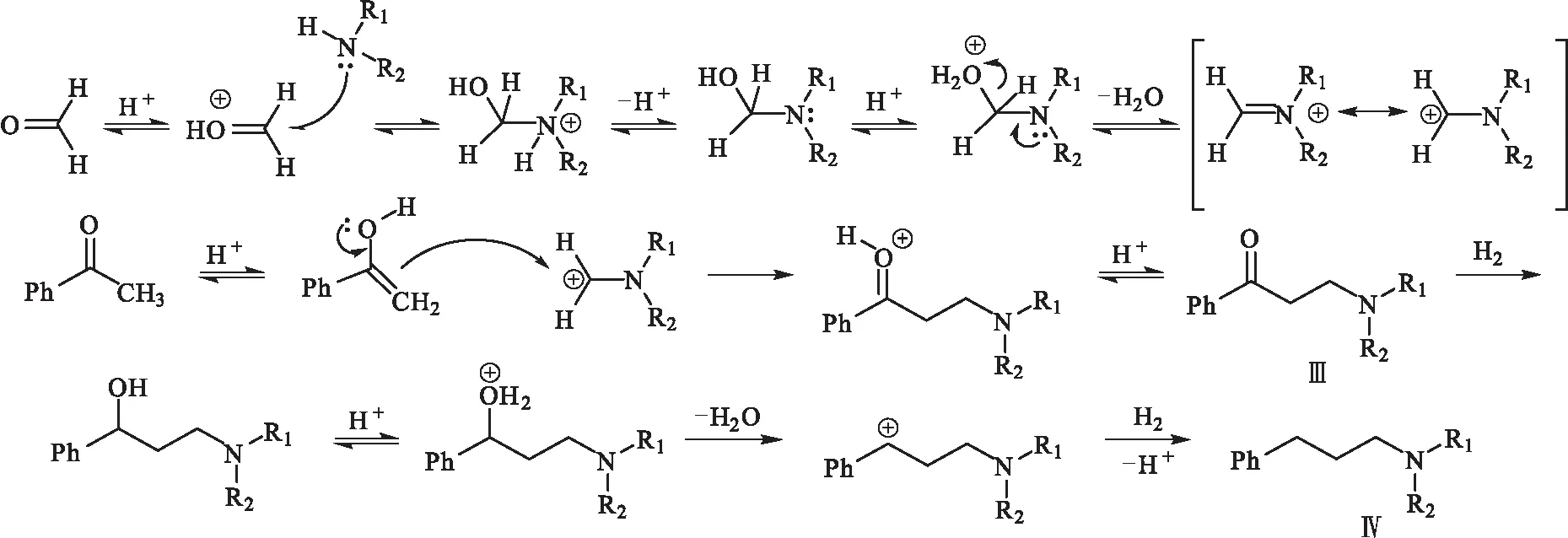
圖2 目標化合物可能的反應機理
3 結論
以(2R,3R,4R,5S)-3,4,5-三(芐氧基)-2-((芐氧基)甲基)哌啶鹽酸鹽為起始原料,經曼尼希縮合、催化氫化、脫芐、脫氧得到DNJ的N-取代苯丙烷衍生物。該方法原料易得、反應步驟簡單、環境污染小,后續可將苯環替換為其它芳香環合成多種類型的DNJ的N-取代衍生物。

