高考化學有關滴定類計算試題的分布特點與解題策略
金敖然
(廣西壯族自治區南寧市第三中學)
滴定實驗是高中化學中重要的定量實驗,也是高考試題中考查學生計算能力、分析解題能力的重要載體.本文著重歸納有關滴定計算的各種類型,探討二輪專題復習中滴定計算試題的解題策略.
1 近幾年高考中有關滴定問題的分布及特點
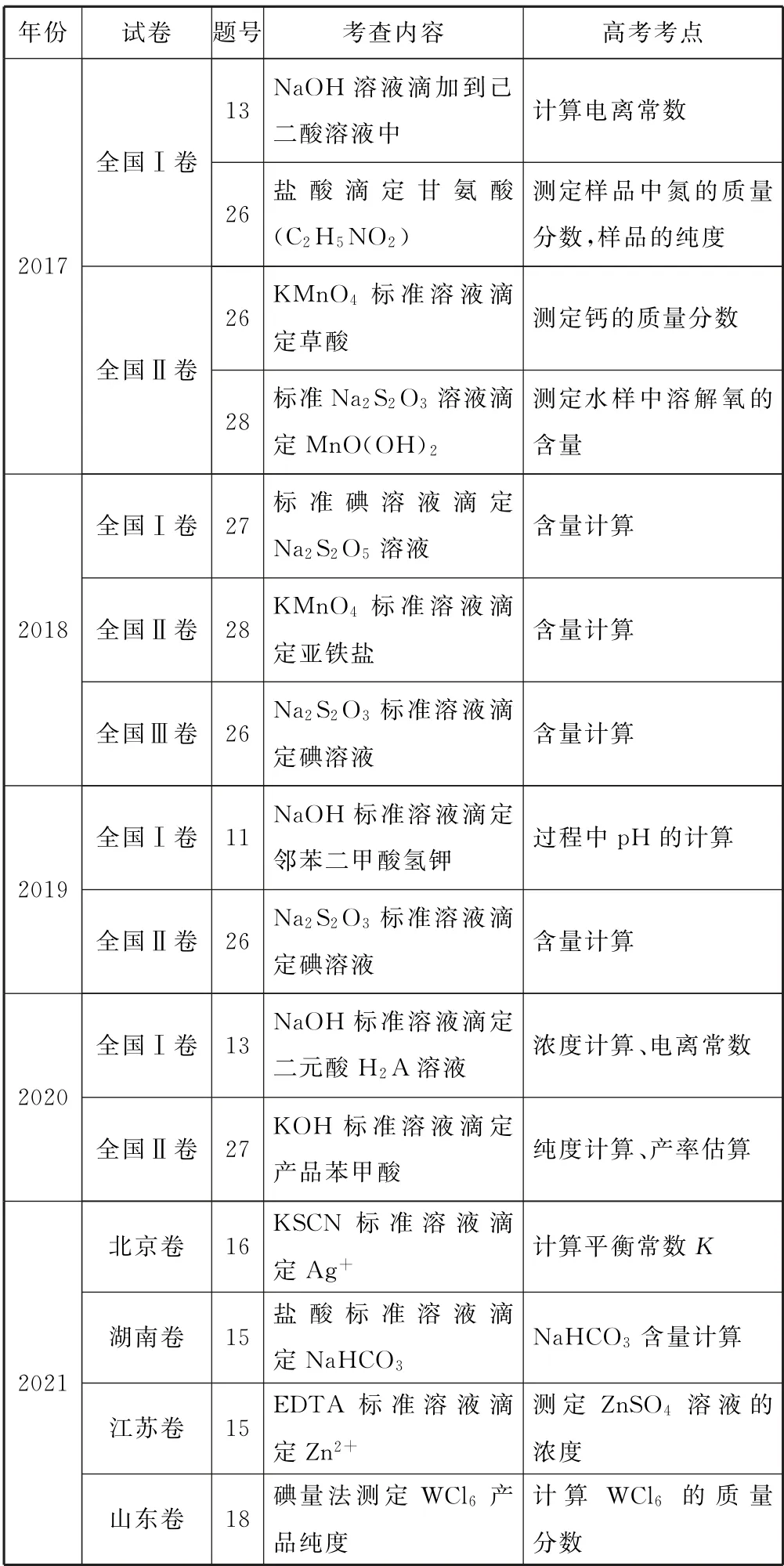
表1
滴定計算是考查學生計算能力的重要形式,近幾年來滴定的計算題型深受命題人的青睞,尤其在全國Ⅰ、Ⅱ卷中頻繁出現,多與真實情境相結合,如葡萄酒中焦亞硫酸鈉的測定、食品防腐劑苯甲酸的測定、廢水中含氧量的測定、工業試劑三草酸合鐵酸鉀、硫代硫酸鈉含量的測定等.新課標中重點強調的滴定實驗也反映了這一命題導向.那么我們如何突破滴定計算這類題型呢? 學生可以嘗試通過歸納滴定類型,構建解決問題的思維模式,突破認知障礙,突出解題思路,最后通過精準的訓練達到思維、方法內化的目的.
2 常見滴定問題中的滴定類型
2.1 直接滴定
如果標準溶液與待測物質可以直接反應,通過測量標準液的用量來計算出待測物質的量,這種滴定叫作直接滴定.直接滴定法是滴定分析中最常用和最基本的方法,是一種方便、快捷的滴定方法.思維模型如圖1所示.

圖1
例1(2018年全國Ⅱ卷,節選)測定三草酸合鐵酸鉀中鐵的含量.
①稱量mg樣品于錐形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至終點.
②向上述溶液中加入過量鋅粉至反應完全后,過濾、洗滌,將濾液及洗滌液全部收集到錐形瓶中.加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至終點,消耗KMnO4溶液VmL.該晶體中鐵的質量分數的表達式為________.
解析
根據題意,該實驗分成兩步進行,第一步將mg樣品溶于水,加入稀硫酸酸化抑制三草酸合鐵酸鉀的水解,再用cmol·L-1KMnO4溶液滴定至終點,目的是氧化草酸根,避免干擾Fe2+的測定.第二步向反應后的溶液中加入過量鋅粉充分反應,目的是將Fe3+全部還原成Fe2+,過濾、洗滌,向洗液中加入稀H2SO4酸化,抑制Fe2+的水解,再用cmol·L-1KMnO4溶液滴定至終點,消耗KMnO4溶液VmL.由于KMnO4與Fe2+直接發生氧化還原反應,屬于“直接滴定”.建立以下思維模型:
1)根據氧化還原規則,建立KMnO4與Fe2+的比例關系KMnO4~5Fe2+.
2)代入已知標準液KMnO4的物質的量,求出未知.
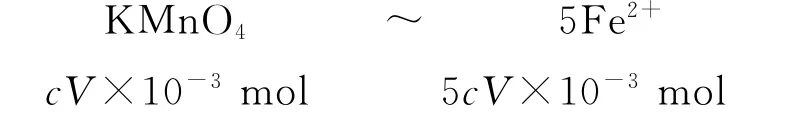
例2(2018年全國Ⅰ卷,節選)Na2S2O5可用作食品的抗氧化劑.在測定某葡萄酒中Na2S2O5殘留量時,取50.00 mL 葡萄酒樣品,用0.01000 mol·L-1的碘標準液滴定至終點,消耗10.00 mL.該樣品中Na2S2O5的殘留量為______g·L-1(以SO2計).
解析
根據題意可知碘標準液的物質的量,標準液I2與待求物質Na2S2O5可以直接反應,這樣的滴定屬于“直接滴定”,建立思維模型:
1)依據電子轉移守恒建立I2和Na2S2O5的關系式,每個參與反應的I2得到2 個電子,而每個Na2S2O5反應中可以失去4個電子,進而得到關系式2I2~Na2S2O5.
2)代入已知標準液I2的物質的量,求出未知.
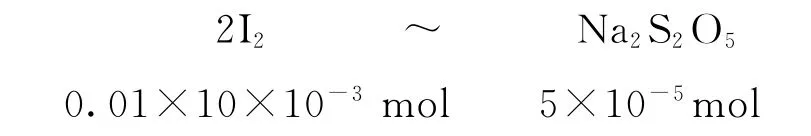
3)計算求值:由于以SO2計樣品中Na2S2O5的殘留量,故需換算成SO2的量.樣品中Na2S2O5的殘留量為=0.128g·L-1.
2.2 間接滴定
間接滴定指的是某些待測物質不能與標準液直接反應,但是可以通過別的化學反應,間接測定待測物質的物質的量.例如利用KMnO4測定Ca2+就屬于間接滴定法,Ca2+不能通過氧化還原反應或者中和反應直接滴定,但可以先讓Ca2+結合C2O2-4形成CaC2O4沉淀,過濾分離后用H2SO4酸化沉淀,再用KMnO4標準溶液滴定H2C2O4,從而間接測定鈣的量.思維模型如圖2所示.
圖2
例3(2020年全國Ⅱ卷,節選)苯甲酸可用作食品防腐劑.實驗室可通過甲苯氧化制苯甲酸,其反應原理簡示如下:
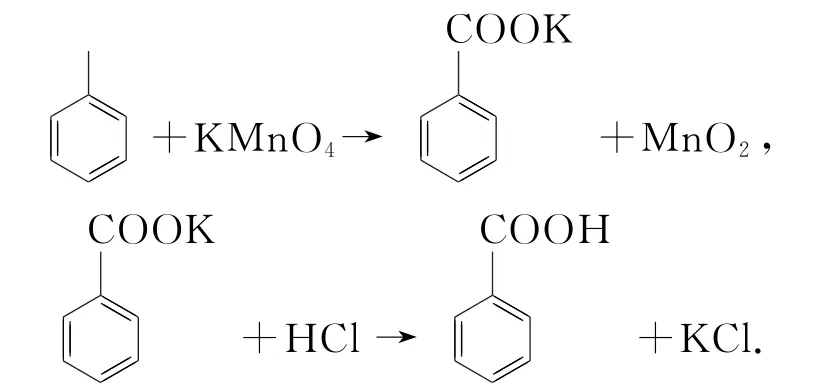
純度測定:稱取0.122g粗產品(苯甲酸粗品),配成乙醇溶液,于100 mL 容量瓶中定容.每次移取25.00mL溶液,用0.01000mol·L-1的KOH 標準溶液滴定,三次滴定平均消耗21.50 mL 的KOH 標準溶液.
本實驗制備的苯甲酸的純度為_________.
解析
建立思維模型:
1)首先找到已知條件,即某種物質的質量或者物質的量.這里就是 KOH 的物質的量.以C6H5COOK 為橋梁建立已知與未知的關系,根據方程式寫出關系式
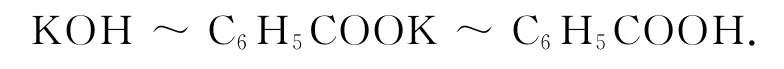
2)代入已知KOH 的物質的量,求出未知.

3)計算求值:利用關系式求出苯甲酸的物質的量,就可以求出苯甲酸的純度.此時注意需要“恢復原態”,因為本實驗配制100 mL 溶液,但每次測量值為25mL,即為總量的,所以計算純度時,C6H5COOH的質量還要擴大4倍“恢復原態”,得出本實驗制備的苯甲酸的純度為
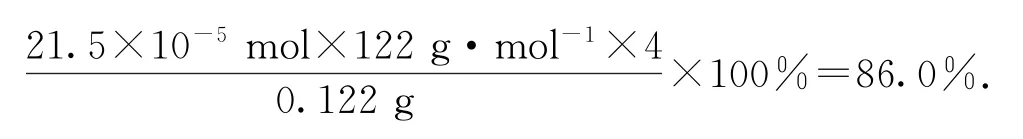
例4(2018年全國Ⅱ卷,節選)硫代硫酸鈉晶體(Na2S2O3·5H2O,M=248g·mol-1)可用作定影劑、還原劑.利用K2Cr2O7標準溶液定量測定硫代硫酸鈉的純度.測定步驟如下:
①溶液配制:稱取1.2000g某硫代硫酸鈉晶體樣品,配成100mL溶液.
②滴定:取0.00950mol·L-1的K2Cr2O7標準溶液20.00mL,硫酸酸化后加入過量KI,發生反應:+6I-+14H+=3I2+2Cr3++7H2O.然后用硫代硫酸鈉樣品溶液滴定至淡黃綠色,發生反應:I2+.平行滴定3次,樣品溶液的平均用量為24.80mL,則樣品純度為________%(保留1位小數).
解析
K2Cr2O7標準溶液的量為已知條件,但是K2Cr2O7并沒有和待測物質Na2S2O3直接發生反應,而是通過過量的KI溶液進行測定,這屬于“間接滴定”.建立思維模型:

2.3 返滴定
返滴定又稱剩余量滴定,俗稱回滴.其原理是如果待測物質與標準液反應比較慢,則需要加入過量標準液以加快反應的速率,此時過量的標準液無法計算待測物質的量,則待反應完全后用另一種標準液滴定過量的標準液,這種滴定方式稱為返滴定法.例如,用EDTA 標準液測定鋁鹽,由于Al3+與EDTA 發生配合反應較慢,需要加入過量較高濃度的EDTA 以加快反應,再用Zn2+標準液返滴定剩余的EDTA,進而測定出鋁的量.思維模型如圖3所示.
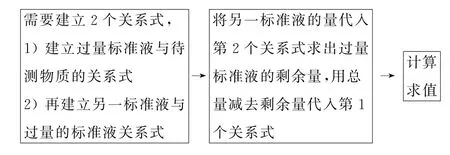
圖3
例5(2019年全國Ⅱ卷,節選)成品中S2-的含量可以用“碘量法”測得.稱取mg樣品,置于碘量瓶中,移取25.00mL0.1000mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密閉,置暗處反應5min,有單質硫析出.以淀粉為指示劑,過量的I2用0.1000 mol·L-1Na2S2O3溶液滴定,反應式為.測定時消耗Na2S2O3溶液體積VmL.樣品中S2-的含量為________(寫出表達式).
解析
利用“碘量法”進行S2-含量的測定,選用了過量的I2-KI 標準液滴定樣品,再用Na2S2O3標準液滴定剩余的I2,進而測定樣品中S2-的含量,這種滴定方法屬于“返滴定”.建立思維模型:

3 有關滴定計算問題的備考及解題建議
“證據推理與模型認知”是中學化學學科核心素養之一,培養學生建立認知模型,并應用模型來解決化學現象、化學問題.思維模型的建立使學生的思維過程具體化、模式化,能突出重點,有化繁為簡的作用.本文歸納了滴定計算的3種類型,總結了解決此類問題的思維模型和解題思路及方法.對于這類高考中的高頻考點的穩定題型,學生如果能建構解題思維模型,有助于找到有效信息,快速精準地入題、破題、解題.同時也提升了學生篩選信息、整合信息的能力以及分析問題、解決問題的能力.
無論是理科綜合考試還是新高考,學生都會面對題量大、信息多、時間緊張這些問題.很多學生遇到計算題就“退避三舍”.因此,對于計算類試題如何果斷破題、快速解題顯得尤為必要.學生可以通過上文歸納的滴定類型入手,學習建立解題模型,構建規范系統的計算過程,這無疑可以消除學生對計算的恐懼,增加信心,提升得分率,在高考中占據上風.
(完)

