阿爾茨海默病腦血流灌注、海馬體積與認知功能相關性分析
劉 海, 陳士新, 許 華, 王 豐
三二〇一醫院 醫學影像科,陜西 漢中 723000
阿爾茨海默病(alzheimer disease,AD)為臨床常見神經退行性疾病,多發于老年人群,患者可表現出記憶功能降低、語言功能障礙、執行功能下降等認知功能損害,甚至發生人格的改變,最終喪失自我照顧能力,增加患者痛苦及社會負擔[1]。早期診斷對AD的干預具有重要意義,但臨床常用神經心理學檢查具有一定局限性,磁共振成像(magnetic resonance imaging,MRI)具有空間分辨率高、軟組織分辨率高、檢測序列多樣等特征,在AD中應用越來越廣泛,3.0 T MRI檢測可通過檢測腦組織體積對神經系統病理改變進行分析。腦組織海馬在AD中具有重要意義。此外,Korte等[2]研究報道,腦血流量降低為AD發生的始動因素。磁共振三維動脈自旋標記(three-dimensional arterial spin labeling,3D-ASL)可通過標記血的氫質子流量,定量分析腦血流灌注。本研究旨在分析3.0 T MRI檢測AD患者腦血流灌注、海馬體積與認知功能的相關性。現報道如下。
1 資料與方法
1.1 一般資料 選取自2019年5月至2021年4月三二〇一醫院收治的72例AD患者設為AD組,另選取同期體檢的75例健康者設為健康組。納入標準:(1)AD診斷符合《精神與行為障礙分類(ICD-10)》[3]中相關診斷標準,符合“癡呆”的診斷標準,并根據AD的臨床發病、客觀認知障礙評定結果特征、生物標志物,排除其他可能導致認知障礙疾病的情況;(2)心肝腎功能正常;(3)無姿勢性震顫。排除標準:(1)影像學資料不完整;(2)合并帕金森癡呆、額顳葉癡呆、路易體癡呆、嚴重腦白質病變;(3)不耐受MRI檢測或存在影響MRI檢測結果的情況(如佩戴金屬假牙、心臟起搏器);(4)妊娠期及哺乳期女性。AD組中,男性42例,女性30例;年齡53~84歲,平均(65.11±5.23)歲;體質量指數(body mass index,BMI)20~26 kg/m2,平均(24.11±1.21)kg/m2。健康組中,男性43例,女性32例;年齡52~82歲,平均(65.68±5.75)歲;BMI 19~21 kg/m2,平均(24.36±1.50)kg/m2。兩組患者的一般資料比較,差異均無統計學意義(P>0.05),具有可比性。本研究經醫院醫學研究倫理委員會審核通過。所有患者均知情同意。
1.2 研究方法 采用Signacio HKxt 3.0 T MRI診斷儀(美國GE公司)行頭顱MRI檢查,采用配套的8通道相控陣頭部線圈,研究對象均取仰臥體位,頭先進,檢測時保持安靜,配備耳墊幫助隔音,雙手放在身體兩側,左右兩側對稱,利用矢狀位定位T2WI,矩陣為256×256,像素大小為0.7×0.7×3.0,TE 97 ms,層厚3.0 mm,TR 7 000 ms,進行2次采集;根據T1WI掃描,像素大小為1.0×1.0×1.0,TE 3.16 ms,層厚1.0 mm,TR 1 900 ms,進行1次采集,然后采用處理軟件勾畫海馬并實施分割,提取并計算其體積。圖像分析則采用雙盲法,測量海馬體積則由影像科具有豐富經驗的兩位醫師達成統一的意見后實施。利用公式(標準化體積=個體的實際體積/個體的顱腔體積×103)進行相關數據的處理,從而減少因頭顱的體積影響到測量海馬的具體數值。3D-ASL參數:TE 10 ms,層厚4 mm,TR 4 500 ms,層距0,像素2 mm×2 mm×4 mm,獲取高分辨率T1WI快速擾相梯度回波圖像,陣列空間敏感性編碼技術加速因子2:00 ph,矩陣240×240,掃描的范圍自顱頂位置到顱底位置。為保證數據具有統一的準確度,用同樣規格的圓圈,通過鏡像對稱的手段放置感興趣區(region of interest,ROI)。結束掃描后將獲得的全部數據傳輸到GE的工作站給予相應的處理,手動進行ROI勾畫,使用SPM8處理軟件從T1WI圖像分割獲取灰質、白質和腦脊液圖譜,將灰質圖譜轉換為3D-ASL圖像空間進行部分容積校正,最后通過單室模型將部分容積校正的3D-ASL圖像量化為腦血流量圖譜,得到腦灌注圖,獲得腦血流半定量測量值以及信號強度。評估灌注圖的質量,將顱底具有較重偽影和具有運動偽影的圖像剔除,評估腦血流圖內有無灌注減低位置存在。各個患者的測量位置有雙側顳葉、額葉、枕葉及頂葉皮質,雙側放射冠旁的腦白質及雙側扣帶回,隨后利用分析軟件將上述部位全部進行測量,每個部位檢測3次ROI,確保其大小能夠一致,記錄具體的平均值;測量過程中最好將腦溝、靜脈竇和腦室避開,以便于降低測量的誤差。
1.3 檢測指標 (1)海馬體積:包括雙側的海馬體積、經顱腔容積校正海馬體積。(2)腦血流信號強度:檢測并記錄研究對象雙側的放射冠、扣帶回、枕葉、頂葉、顳葉、額葉的血流信號強度。(3)認知功能:根據蒙特利爾認知評估(Montreal cognitive assessment,MoCA)量表[4]評價兩組研究對象的認知功能,包括命名、執行功能、注意力、語言功能、抽象概括能力、記憶能力、定向力,總評分范圍0~30分,評分≥26分為正常,得分越高提示患者認知功能越好。
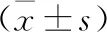
2 結果
2.1 兩組海馬體積比較 AD組雙側的海馬體積、經顱腔容積校正海馬體積均明顯低于健康組,差異均有統計學意義(P<0.05)。見表1。

表1 兩組海馬體積比較體積/cm3)
2.2 兩組腦血流信號強度比較 AD組雙側的放射冠、扣帶回、枕葉、頂葉、顳葉、額葉的腦血流信號強度明顯低于健康組,差異有統計學意義(P<0.05)。見表2。
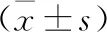
表2 兩組腦血流信號強度比較
2.3 兩組認知功能比較 AD組執行功能、命名、注意力、語言功能、抽象概括能力、記憶能力、定向力、MoCA總分均低于健康組,差異均有統計學意義(P<0.05)。見表3。

表3 兩組認知功能比較評分/分)
2.4 AD患者腦血流灌注、海馬體積與認知功能的相關性分析 Pearson相關分析結果顯示,AD患者的左右海馬體積、經顱腔容積校正左右海馬體積,以及左右放射冠、左右扣帶回、左右枕葉、左右頂葉、左右顳葉、左右額葉的腦血流信號均與認知功能呈正相關(r=0.405、0.450、0.512、0.643、0.820、0.458、0.472、0.492、0.710、0.628、0.549、0.428、0.351、0.573、0.510、0.489,P<0.05)。
3 討論
近年來,我國AD發病率呈上升趨勢[5-6]。隨著影像學技術的進步,3.0 T MRI檢測被廣泛應用到AD的臨床檢測中,該技術可以用于定量分析腦血流灌注、海馬體積,并評估其與認知功能的相關性。
本研究結果顯示,AD組患者雙側的海馬體積、經顱腔容積校正海馬體積明顯低于健康組(P<0.05),提示3.0 T MRI檢測出AD患者海馬體積萎縮。其原因可能是3.0 T MRI圖像分辨率、時間分辨率均較高,可直接作出矢狀面、橫斷面、冠狀面以及各種斜面的圖像,在腦功能成像中應用效果更好,能有效顯示腦部結構、功能和代謝,MRI反映的腦結構改變發生在記憶力下降之前[7]。Josephs等[8]研究發現,AD患者海馬和新皮層(顳下和額中)腦容量降低,腦萎縮率較正常人更高。Xie等[9]研究顯示,AD重要病理特征為腦組織萎縮,海馬為位于腦顳葉內的某個部位名稱,具有長時記憶的存儲轉換和定向等功能,AD患者海馬組織是首先受到損傷的區域,其結構及功能的變化在AD病情發展中具有重要意義。侯丹瑋等[10]研究顯示,MRI檢測出AD患者顳角深度、各腦葉體積均降低,腦組織萎縮明顯。上述研究與本研究結果相互印證。
3.0 T MRI檢測中,3D-ASL灌注成像以標記血中氫質子為內源性示蹤劑,實現全腦灌注情況的觀察,無需注射造影劑、無創傷性,可重復性高,不受血腦屏障的影響,能定量檢測腦血流信號變化,在腦血流灌注的觀察中具有良好的應用[11-12]。本研究結果顯示,AD組雙側的放射冠、扣帶回、枕葉、頂葉、顳葉、額葉的腦血流信號強度明顯低于健康組(P<0.05),提示AD患者腦部血流灌注相較健康人群降低。這可能是AD患者普遍存在腦部血管病變,腦血管淀粉樣沉積、腔隙性腦梗死、膠質增生、小動脈硬化等情況均可導致毛細血管收縮引,減少腦部血流灌注,上調產生淀粉樣蛋白的淀粉蛋白前β-分解酶1和促進tau蛋白的過度磷酸化,可誘導淀粉樣蛋白聚集和tau蛋白過度磷酸化,啟動淀粉樣蛋白級聯,最終誘導神經元損傷來增強神經退行性變,促進AD發生與發展,并在患者認知能力下降中發揮關鍵作用[13]。
認知功能損傷為AD的重要特征。本研究結果顯示,AD組執行功能、命名、注意力、語言功能、抽象概括能力、記憶能力、定向力、MoCA總分均低于健康組(P<0.05),且Pearson相關分析結果顯示,雙側的海馬體積、經顱腔容積校正海馬體積,以及放射冠、扣帶回、枕葉、頂葉、顳葉、額葉的腦血流信號均與認知功能呈正相關,提示AD患者認知功能全面降低,且認知功能降低程度與腦血流降低、海馬體積萎縮程度呈正相關。分析其原因可能為,海馬為記憶、學習的核心,隨著海馬體積萎縮,海馬的神經細胞對信息的固定效果降低,可影響患者記憶的形成及穩固,導致其認知功能降低;同時,腦血流灌注降低可增加神經元代謝紊亂,組織缺血缺氧也會增加神經細胞凋亡,抑制乙酰膽堿通路,最終降低認知功能,促進AD進程[14-15]。然而,本研究存在樣本量限制和納入醫院單一等缺點,后期可進一步擴大樣本量,進行多中心研究,并深入分析AD患者中海馬腦血流灌注與海馬體積的關系。
綜上所述,3.0 T MRI檢測出AD患者的腦血流灌注、海馬體積均降低,且其水平與患者認知功能呈正相關。

