空化射流條件下大豆分離蛋白糖基化產物乳液特性研究
王中江 郭亞男 任雙鶴 李柏良,2 孟凡迪 郭增旺
(1.東北農業大學食品學院, 哈爾濱 150030; 2.山東省禹王生態食業有限公司, 德州 253000)
0 引言
大豆蛋白質含量豐富,質量分數通常在40%~50%之間[1]。而且大豆蛋白更符合人體必需氨基酸組成、含量充足,且相比較于其他植物蛋白,消化吸收率較高,是一種優質植物蛋白資源[2-3],并因其良好的功能特性在食品領域中得到了廣泛的應用。但常規生產的大豆蛋白功能特性不穩定,受環境因素影響較大,因此引入適當的改性手段對大豆蛋白結構和功能進行改善是生產專用型蛋白的常用手段。糖基化屬于化學改性法,是將蛋白質分子中的氨基與還原糖中的羰基以共價鍵的形式相結合發生一系列復雜反應[4],得到蛋白質-多糖復合物。研究發現,蛋白質與糖共價復合后其穩定性大大增強,不易受pH值、溫度等外界因素變化的影響[5],且該方法成本低、條件溫和、操作簡單,得到的改性產物具有較好的溶解性、乳化性、穩定性等特性[6]。但在糖基化改性處理過程中,干熱法反應時間較長、反應條件難以控制、工業生產困難,而濕熱法接枝效果不佳,從而限制了糖基化在蛋白改性中的應用[7]。因此,需要利用外場輔助技術復合糖基化改性蛋白質。目前用于改善糖基化的輔助技術主要有超聲波、高壓均質、動態高壓微射流等,但超聲處理的改性效果不顯著,高壓均質和動態高壓微射流難以實現產業化生產[8],均不能很好地應用于輔助糖基化生產改性大豆蛋白。
空化射流是含有空化現象的水射流,屬于外場輔助手段的一種,可以產生空化效應。通過人為手段使液流系統中的局部壓力低于相應溫度下該液體的飽和蒸氣壓,誘導液體迅速汽化形成許多空泡,這些空泡隨液體流入高壓區后,發生收縮、漬滅,產生空化效應[9-10],這種空化效應能夠誘導和強化生物大分子物理、化學以及結構性質的變化[10]。已有研究表明,空化射流能夠輔助糖基化改善大豆蛋白的結構和溶解性、乳化性等功能性質[7],但空化射流技術能否對糖基化產物乳液特性起到改善作用尚不明確。
因此,為了探究空化射流對大豆蛋白糖基化產物乳液特性的影響,本文以大豆分離蛋白、葡萄糖、葡聚糖為原料,采用空化射流輔助濕熱法糖基化反應分別制備大豆分離蛋白-葡萄糖、大豆分離蛋白-葡聚糖共價復合物乳液,并對其進行空化射流處理,通過測定乳液粒徑、ζ-電位、微觀結構、乳析指數、蛋白質吸附率及抗氧化性(還原力、DPPH自由基清除能力),進一步探討空化射流時間(20、40、60、80、100、120 min)對大豆分離蛋白糖基化產物乳液特性的影響,以期為研究空化射流輔助濕法糖基化對蛋白乳液特性的影響及空化射流處理在食品方面的應用提供前期理論參考。
1 材料與方法
1.1 材料與試劑
大豆分離蛋白(SPI,純度94.2%),山東禹王生態食業有限公司;葡萄糖(分析純),中國醫藥集團上海化學試劑有限公司;葡聚糖(分子質量10 000 ku,分析純),中國醫藥集團上海化學試劑有限公司;大豆油,九三糧油工業集團有限公司;磷酸鹽緩沖溶液粉劑,索萊寶生物科技有限公司;0.000 1 g/mL尼羅紅和0.001 g/mL尼羅藍,美國Sigma公司;其他試劑均為國產分析純。
1.2 儀器與設備
電子分析天平(0.000 1 g),北京賽多利斯儀器系統有限公司;THZ-80型水浴恒溫振蕩器,江蘇金壇億通電子有限公司;空化射流機,北京中森匯嘉科技發展有限責任公司;FD5-3型冷凍干燥機,美國SIM公司;JJ-1型增力電動攪拌器,江蘇省金壇市金城國勝實驗儀器廠;ZetaPALS型ζ-電位儀,美國布魯克海文儀器公司;Malvern Mastersizer 2000型激光粒度儀,英國馬爾文儀器有限公司;F-4500型熒光分光光度計,日本HITACHI公司。
1.3 大豆分離蛋白糖基化產物乳液制備
將SPI與葡萄糖、葡聚糖分別以質量比4∶1溶于磷酸鹽緩沖溶液(pH值7.5、0.2 mol/L),室溫(20℃)下攪拌2 h至完全溶解,配制成蛋白質量濃度為5 g/(100 mL)的樣品溶液。將樣品置于80℃恒溫水浴鍋預熱后,用空化射流機分別輔助處理0、20、40、60、80、100、120 min,過程中始終保持處理溫度為80℃。各處理后樣品在80℃水浴條件下繼續加熱,控制樣品糖基化反應總時長均為6 h。反應結束后,將樣品迅速冷卻至室溫,離心后的上清液于蒸餾水中透析24 h(4℃),冷凍干燥后將樣品粉末溶于磷酸鹽緩沖溶液中(0.01 mol/L,pH值7.0),為抑制微生物生長,可向溶液中添加0.000 1 g/mL的NaN3并在室溫下攪拌2 h后于4℃靜置12 h使蛋白水合充分。次日10 000g離心20 min后取上清液,測定上清液蛋白濃度并稀釋一定倍數,添加一定量大豆油,使得乳狀液中蛋白質量濃度為5 mg/mL,油質量分數為10%。再用高速乳化機(20 000 r/min)乳化1 min。空白樣品為未經射流空化處理SPI-葡萄糖、SPI-葡聚糖共價復合物乳液。
1.4 乳液ζ-電位和平均粒徑測定
采用 Malvern Zetasizer Nano ZS型電位及粒度分布儀測定乳液的ζ-電位。利用Malvern Mastersizer 2000 型激光粒度儀測定乳液液滴的直徑[11]。乳液液滴的平均粒徑采用體積平均直徑d43來表示。
1.5 乳液微觀結構觀察
采用激光共聚焦顯微鏡(CLSM)對新制乳液的微觀結構進行觀察。避光條件下取1 mL乳液,加入40 μL 熒光染料(0.000 1 g/mL尼羅紅和0.001 g/mL尼羅藍),混合均勻后,吸取20 μL待測乳液樣品滴于載玻片上,確保樣品中沒有氣泡,蓋上蓋玻片。觀察時倒置于顯微鏡上,光的激發波長分別為488 nm和633 nm,采用 LAS AF Lite軟件對乳液液滴圖像進行處理。
1.6 蛋白吸附率測定
蛋白吸附率的測定參照文獻[12]的方法稍作改動。將新制備的乳液在10 000g下離心30 min使得乳液分為油、水兩相:乳析的油相在頂部,而水相和沉淀置于底部。用注射器小心除去乳析層,水相中未吸附的蛋白濃度采用Lowry法測定。界面蛋白吸附率計算公式為
(1)
式中Ci——初始液相蛋白質量濃度,kg/m3
Ceq——未吸附蛋白質量濃度,kg/m3
1.7 乳析指數測定
乳析指數的測定參照文獻[13]的方法稍作改動。將新鮮制備的乳液注入10 mL樣品瓶中(高100 mm,內徑15 mm),用玻璃蓋密封并置于25℃下進行儲藏,測定乳液在14 d內的乳狀液總高度及分層后的下層清液高度。乳析指數計算公式為
(2)
式中Hs——分層后的下層清液高度
Ht——乳狀液總高度
1.8 乳液抗氧化性測定
1.8.1還原力測定
還原力的測定參照文獻[14]的方法稍作改動。取5 mg/mL樣品溶液0.5 mL,加入2.5 mL磷酸鹽緩沖液(濃度0.2 mol/L,pH值6.6)和2.5 mL質量濃度0.01 g/mL的鐵氰化鉀溶液,混合均勻后置于50℃恒溫水浴反應20 min,經迅速冷卻后加入2.5 mL質量濃度0.1 g/mL的三氯乙酸溶液,將混合物在25℃、3 000 r/min條件下離心10 min。取2.5 mL上層清液,加入2.5 mL蒸餾水和0.5 mL質量濃度0.001 g/mL的氯化鐵溶液,混合均勻后靜置10 min,然后測定其在700 nm處吸光度。
1.8.2DPPH自由基清除能力測定
DPPH自由基清除能力測定參照文獻[15-16]的方法稍作改動。新鮮配制4 mL 0.12 mmol/L DPPH-乙醇溶液并保持避光保存,取2 mL的上述溶液加入1 mL一定濃度的樣品溶液,充分混合均勻,在室溫下置于黑暗中反應30 min,如果有沉淀物,將混合物在750g下離心5 min。然后測定上清液在517 nm處的吸光度。對照用去離子水代替樣品溶液,空白則用無水乙醇代替DPPH-乙醇溶液。DPPH自由基清除率計算公式為
(3)
式中Ac——未加樣品的DPPH溶液吸光度
As——加樣品的DPPH溶液吸光度
A0——樣品溶液吸光度
1.9 數據統計及分析
所有的實驗重復3次,結果用平均值±標準差表示,采用SPSS 19.0軟件對實驗數據進行ANOVA顯著性分析,P<0.05為顯著性差異,采用Origin 9.1軟件制圖對實驗數據進行分析。
2 結果與分析
2.1 粒徑分布
SPI-葡萄糖共價復合物乳液的粒徑分布與平均粒徑如圖1、2(圖中不同字母表示差異顯著,下同)所示。
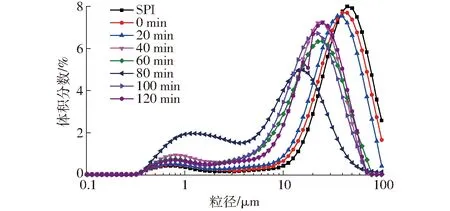
圖1 不同空化射流時間下SPI-葡萄糖共價復合物乳液的粒徑分布Fig.1 Emulsion particle size distribution of SPI-glucose conjugates under different cavitation jet treatment times
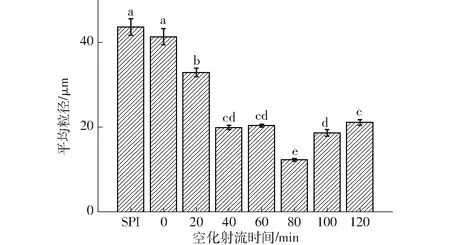
圖2 不同空化射流時間下SPI-葡萄糖共價復合物乳液的平均粒徑Fig.2 Emulsion average particle size of SPI-glucose conjugates under different cavitation jet treatment times
食品乳液屬于多分散體系,乳液的理化特性與其液滴特性緊密相關,液滴的大小、界面特性、液滴間的相互作用都影響了乳液的性質,其液滴粒徑對乳液穩定性有重要作用。一般來說,液滴粒徑越小,其分布越均一,乳液的穩定性越好。由圖1、2可知,與未處理SPI和普通糖基化產物相比,空化射流輔助可以使接枝物乳液的平均粒徑降低,空化射流處理80 min時,乳液平均粒徑最小,接枝物乳液粒徑呈雙峰分布特征,空化射流處理后的SPI-葡萄糖共價復合物的乳液粒徑都在小粒徑范圍內分布更多。空化射流產生的高速湍流剪切作用、瞬間流道高壓力差和分子對沖撞擊效應能夠使大分子蛋白解離[17],同時由于空化射流輔助糖基化可以使蛋白乳化性提高,使蛋白能夠更好地在液滴表面吸附,分散在油-水界面上形成界面膜,從而減少了蛋白聚沉的可能性,所以乳液的粒徑明顯降低。空化射流處理時間超過100 min后,乳液粒徑增大,可能是空化射流過度造成了乳液中蛋白聚沉。文獻[7]表明蛋白聚沉作用并不是由共價鍵如分子間的二硫鍵導致,而是由疏水作用等非共價鍵導致。所以接枝物的聚沉可能是蛋白分子間形成了疏水作用導致的。
SPI-葡聚糖共價復合物乳液的粒徑分布與平均粒徑如圖3、4所示。
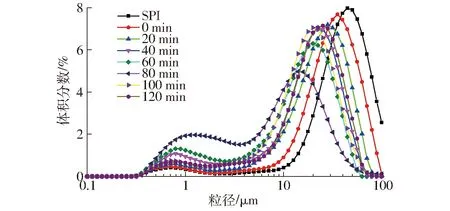
圖3 不同空化射流時間下SPI-葡聚糖共價復合物乳液的粒徑分布Fig.3 Emulsion particle size distribution of SPI-dextran conjugates under different cavitation jet treatment times
由圖3、4可知,接枝物乳液粒徑呈雙峰分布特征,且與SPI-葡萄糖共價復合物乳液相比,SPI-葡聚糖共價復合物的乳液粒徑在小粒徑范圍內分布更多。SPI-葡聚糖共價復合物的乳液平均粒徑在空化射流處理60 min后開始明顯降低,且比SPI-葡萄糖共價復合物的平均粒徑更小,這是由于SPI-葡聚糖共價復合物的空間位阻效應能夠有助于對乳液中液滴的聚集沉降起到更好的抑制作用,從而促進了乳液中小液滴的形成,所以相較于SPI-葡萄糖共價復合物可以更好地提高O/W(水包油)乳液的穩定性,從而更好地維持較小的乳液液滴[18-21]。文獻[22-23]證實了共價結合親水性多糖使親水區域變得更大,油滴的曲率增大,從而減小顆粒尺寸。文獻[24]發現單獨加熱大豆分離蛋白24 h,由于SPI的聚集,顆粒尺寸會急劇增大。與葡聚糖接枝后,加熱體系乳化性降低不明顯,證明葡聚糖與SPI共價結合可以有效抑制蛋白聚集。空化射流處理時間超過100 min后,接枝物乳液粒徑會明顯增大,可能是空化射流過度使乳液中蛋白聚集造成的。
2.2 ζ-電位
SPI-葡萄糖共價復合物乳液的ζ-電位如圖5所示。
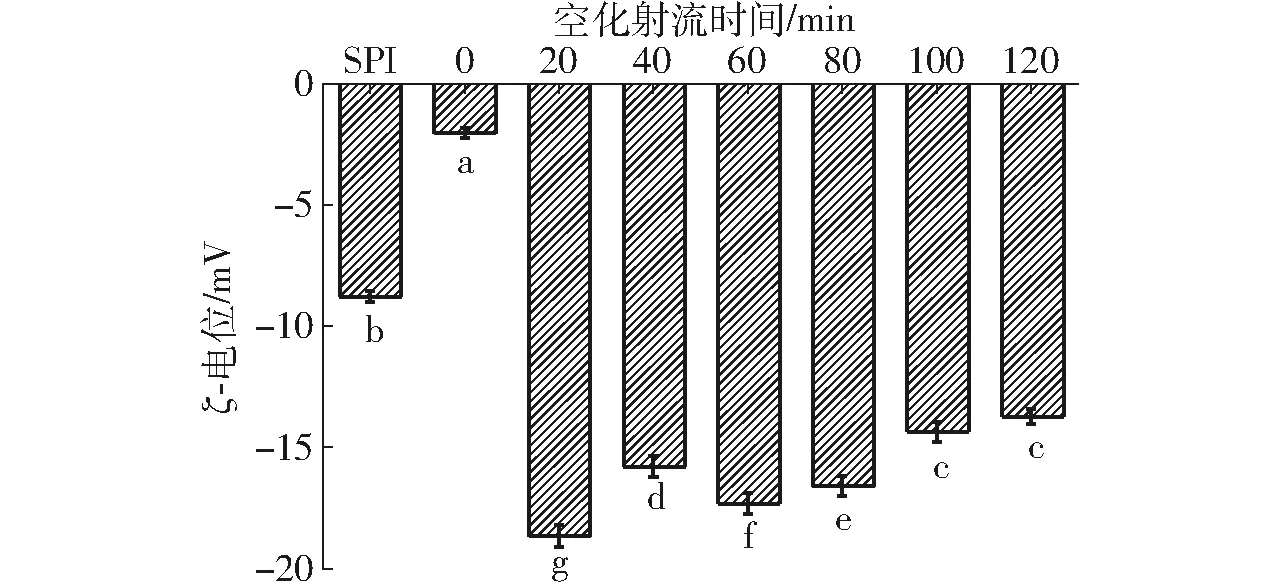
圖5 不同空化射流時間下SPI-葡萄糖共價復合物乳液的ξ-電位Fig.5 Emulsion ζ-potential value of SPI-glucose conjugates under different cavitation jet treatment times
ζ-電位是表征膠體分散體系穩定性的重要指標。分子或分散粒子越小,ζ-電位(正或負)絕對值越高,顆粒間排斥力越大,體系越穩定;反之,ζ-電位的絕對值越低,體系中顆粒由于排斥力較小越傾向于凝結或聚集,使得粒徑增大[25]。由圖5可知,一般糖基化反應得到的SPI-葡萄糖共價復合物的ζ-電位與未處理SPI相比顯著降低,但粒徑分析表明糖基化反應后的乳液體系比未處理SPI更加穩定,所以電荷不是接枝物乳液體系穩定性的決定性因素。接枝物ζ-電位的降低可能是由于SPI與葡萄糖發生了共價結合,導致糖鏈吸附在油滴表面從而屏蔽了蛋白質表面的電荷。短時間空化射流輔助處理使SPI-葡萄糖共價復合物乳液的ζ-電位明顯升高,空化射流處理20 min時,ζ-電位為-18.53 mV。這是由于空化射流會使蛋白高級結構被破壞,蛋白電荷暴露。隨著空化射流輔助時間的增長,SPI-葡萄糖共價復合物乳液的ζ-電位呈減小趨勢,這可能是因為空化射流促進了SPI與葡萄糖共價結合,使蛋白表面電荷又被新共價結合的糖鏈所屏蔽,同時過度空化會導致蛋白發生聚集,部分電荷又被包埋在蛋白分子內部,從而使ζ-電位有所下降。
SPI-葡聚糖共價復合物的ζ-電位如圖6所示。
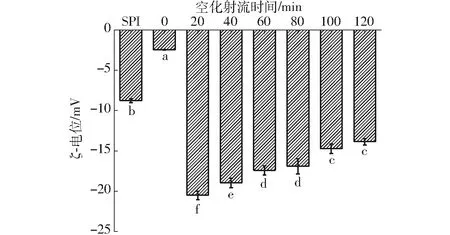
圖6 不同空化射流時間下SPI-葡聚糖共價復合物乳液的ζ-電位Fig.6 Emulsion ζ-potential value of SPI-dextran conjugates under different cavitation jet treatment times
由圖6可知,一般的糖基化反應會使接枝物粒徑顯著降低,這可能是由少量中性葡聚糖吸附到油滴界面屏蔽蛋白電荷造成的。空化射流處理后,SPI-葡聚糖共價復合物乳液的ζ-電位明顯升高,并且大于SPI-葡萄糖共價復合物的ζ-電位,最大值為-20.53 mV。這可能是因為空化射流使蛋白電荷暴露后,共價結合葡聚糖的空間位阻效應可以防止乳液液滴的聚集和聚結,從而導致ζ-電位增大,與文獻[22]研究燕麥蛋白與葡聚糖接枝反應的結果一致。綜上所述,SPI-葡聚糖共價復合物制備的乳液具有更好的儲藏穩定性。
2.3 乳液微觀結構觀察
SPI-葡萄糖共價復合物、SPI-葡聚糖共價復合物乳液的液滴微觀結構如圖7、8所示。
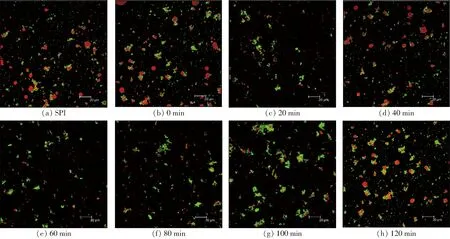
圖7 不同空化射流時間下SPI-葡萄糖共價復合物乳液的CLSM圖像Fig.7 CLSM images of emulsions of SPI-glucose conjugates under different cavitation jet treatment times
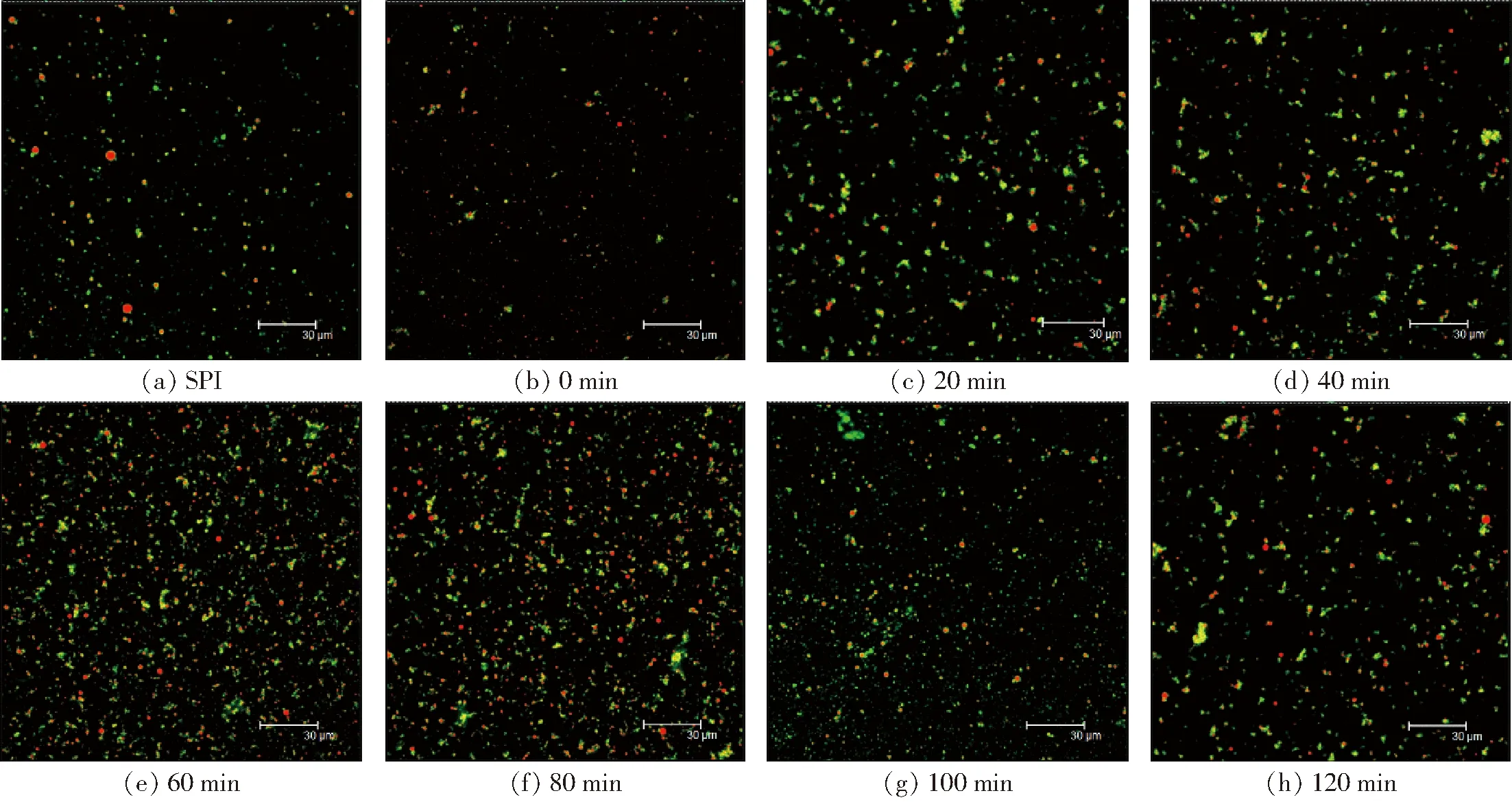
圖8 不同空化射流時間下SPI-葡聚糖共價復合物乳液的CLSM圖像Fig.8 CLSM images of emulsions of SPI-dextran conjugates under different cavitation jet treatment times
由圖7、8可知,未處理SPI制備的乳液微觀結構有一些比較大的液滴存在,這可能是SPI乳化性較低造成的。空化射流處理后乳液的微觀結構液滴比較均勻,液滴也比較小,這可能是由于空化射流產生的高速湍流剪切以及高壓力差使大分子蛋白去折疊,水合作用增強,內部疏水基團暴露,提高了其親水性和親油性,且兩者保持較好的平衡,蛋白乳化性增加,從而使得乳液的液滴逐漸均勻。隨著空化射流時間增加,液滴粒徑呈先逐漸減小后增大的趨勢。空化射流處理超過10 min形成的乳液微觀結構出現聚集情況,液滴開始變得不均勻,出現小液滴簇。
SPI-葡萄糖共價復合物葡萄糖形成的乳液液滴粒徑較大,而SPI-葡聚糖共價復合物的乳液液滴分散更加均勻,乳液粒徑也更小。這可能是由于葡聚糖比葡萄糖的糖鏈更長,在與蛋白質結合后更容易調控糖基化產物的界面特性,降低乳液界面張力,使得乳液粒徑更小,分散更加均勻,表明SPI-葡聚糖共價復合物制備的乳液具有更好的穩定性。綜上所述,空化射流可以一定程度改善糖基化產物的乳化性,得到粒徑更小、穩定性較好的乳狀液,且SPI與葡聚糖糖基化處理對乳液微觀結構的改善效果更佳。
2.4 蛋白吸附率
SPI-葡萄糖共價復合物的蛋白吸附率如圖9所示。
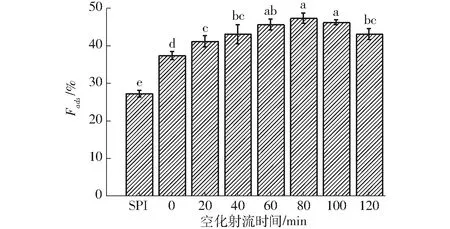
圖9 不同空化射流時間下SPI-葡萄糖共價復合物乳液的蛋白吸附率Fig.9 Protein adsorption fraction of emulsion of SPI-glucose conjugates under different cavitation jet treatment times
由圖9可知,隨著空化射流處理時間增加,SPI-葡萄糖共價復合物乳液的蛋白吸附率整體呈升高趨勢,在處理80 min達到最大值,之后繼續增加空化射流時間,蛋白吸附率小幅下降。蛋白質的界面蛋白吸附量通常與其乳化性和乳液粒徑有關,蛋白質的界面吸附量通常與其乳化性呈正相關趨勢,并且通常蛋白吸附量越高會使乳液的平均粒徑越小[26]。空化射流能夠使蛋白質分子去折疊,從而暴露出部分疏水基團和具有表面活性的多肽,其中多肽會向非水相的界面移動,吸附到油滴的表面,從而使得蛋白吸附量增加[27-29]。
SPI-葡聚糖共價復合物乳液的蛋白吸附率如圖10所示。
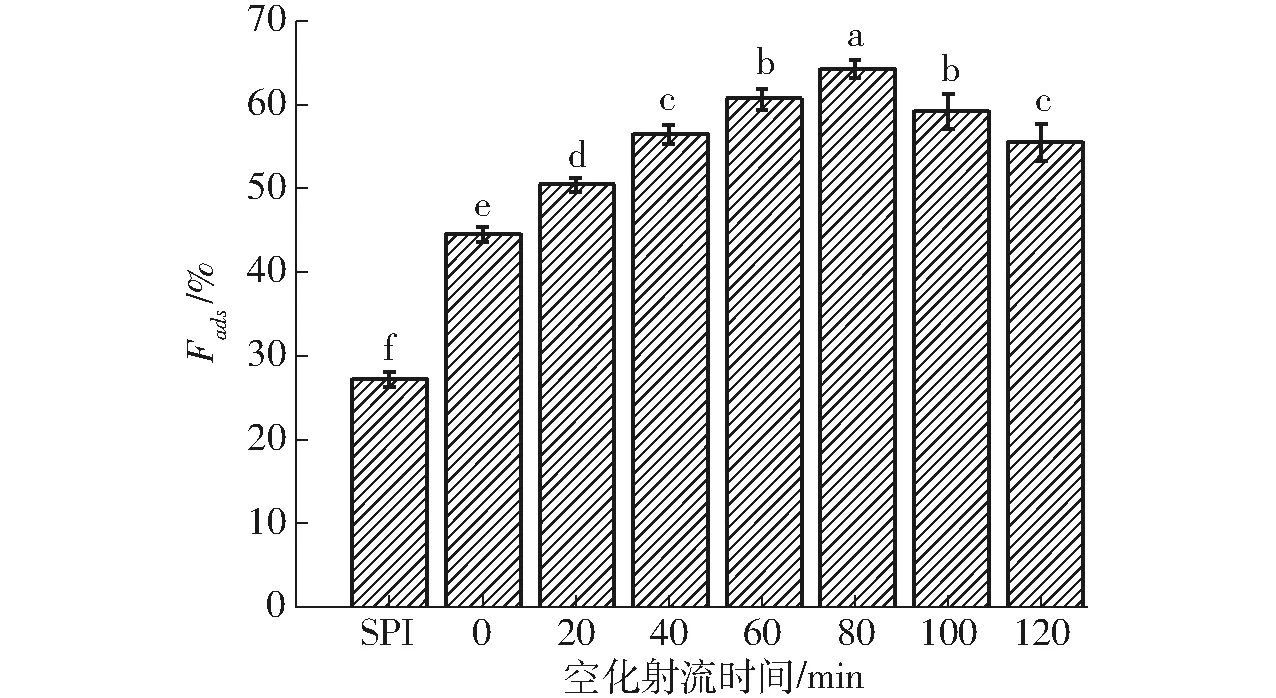
圖10 不同空化射流時間下SPI-葡聚糖共價復合物乳液的蛋白吸附率Fig.10 Protein adsorption fraction of emulsion of SPI-dextran conjugates under different cavitation jet treatment times
由圖10可知,隨著空化射流處理時間增加,SPI-葡聚糖共價復合物的蛋白吸附率呈先升高后降低趨勢,在處理80 min時達到最高。且與SPI-葡萄糖共價復合物相比,提高更為明顯,這可能是由于葡聚糖比葡萄糖的分子量更大,能通過影響溶液的黏度形成更加穩定的空間網狀結構,并且適當提高糖分子鏈的長度能夠減少界面張力,有助于蛋白分子在油水界面形成界面膜結構,提高乳液的蛋白吸附率。以上結果表明空化射流輔助對SPI-葡聚糖共價復合物在液滴界面上的吸附和堆積有更明顯的促進作用。
2.5 乳析指數
SPI-葡萄糖共價復合物乳液在儲藏過程中乳析指數的變化曲線如圖11所示。
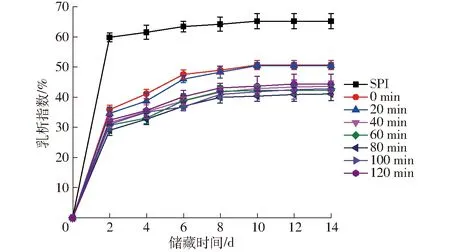
圖11 不同空化射流時間下SPI-葡萄糖共價復合物乳液的乳析指數Fig.11 CI of emulsion of SPI-glucose conjugates under different cavitation jet treatment times
乳狀液屬于熱不穩定體系,會依據動力學穩定性原理以一定速度分離成互不相容的油、水兩相,使乳狀液出現絮凝、聚集、粒徑偏移等現象[30]。乳狀液的粒度分布是影響乳狀液穩定性的關鍵因素,通常情況下,乳狀液粒子越小,乳析速度越慢,乳析率越低,乳狀液也就越穩定。由圖11可知,新制備的乳狀液未見明顯的分層現象,放置一段時間后樣品的底部逐漸出現水析層,脂肪逐漸上浮,在儲藏的前8 d乳狀液的乳析指數隨儲藏時間增長而顯著增加,隨后增加緩慢直至保持穩定。SPI-葡萄糖共價復合物乳液的層析指數明顯低于未處理SPI制備的乳液,隨著空化射流輔助處理時間的增加,乳清層高度有不同程度降低,乳析指數呈先降低后升高的趨勢。處理80 min形成的乳液在儲藏過程中分層最緩慢,表現出最好的乳化穩定性,與乳液平均粒徑的結果一致。這可能是由于空化射流使蛋白質去折疊,溶解性增加,從而使更多親水、疏水基團吸附在油-水界面,起到穩定乳液的作用,抑制了乳液的分層[31-32]。
SPI-葡聚糖共價復合物乳液乳析指數如圖12所示。
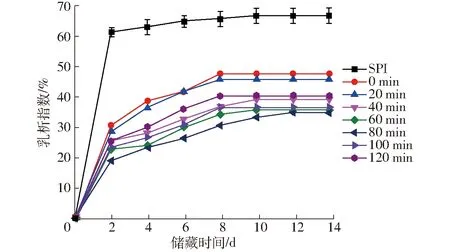
圖12 不同空化射流時間下SPI-葡聚糖共價復合物乳液的乳析指數Fig.12 CI of emulsion of SPI-dextran conjugates under different cavitation jet treatment times
由圖12可知,SPI-葡聚糖共價復合物乳液與SPI-葡萄糖共價復合物相比,乳清層更低,表現出更低的乳析指數,這與乳液粒徑分布和乳化性結果一致。除了空化射流使蛋白質去折疊,使更多親水、疏水基團吸附在油-水界面,SPI-葡聚糖共價復合物制備的乳狀液表面吸附了大量通過共價結合的葡聚糖,葡聚糖的空間位阻效應促進抑制乳液液滴間發生聚集,從而有利于形成較小液滴粒徑的乳液[33],所以SPI-葡聚糖共價復合物的乳液表現出更好的貯存穩定性。
2.6 抗氧化性
2.6.1還原力
SPI-葡萄糖共價復合物、SPI-葡聚糖共價復合物乳液的還原力的變化曲線如圖13所示。
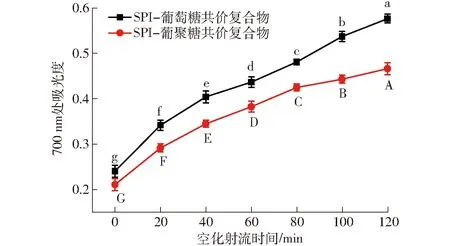
圖13 不同空化射流時間對SPI-葡萄糖共價復合物、SPI-葡聚糖共價復合物乳液還原能力的影響Fig.13 Effect of different cavitation jet treatment times on reducing power of emulsion of SPI-glucose and SPI-dextran conjugates
在還原能力測試過程中,樣品中的還原劑能夠將Fe3+還原成Fe2+,可以通過測定700 nm處吸光度來測定Fe2+,吸光度越大,表明樣品的還原能力越強[15]。SPI在700 nm處的吸光度為0.126。由圖13可知,隨著空化射流時間的延長,兩組接枝物的還原力都逐漸升高。研究表明,美拉德反應初級階段的Amadori熱解產物、中間產物還原酮、高級階段產物類黑精都具有一定的還原能力。其中,中間產物還原酮是起到還原能力的主要物質。其可以通過破壞自身自由基鏈和提供氫原子的方式達到抗氧化性的目的[34],此外它還可以與一些過氧化物的前體物反應阻止過氧化物的生成來達到抗氧化的目的,由此可見,抗氧化特性是美拉德反應接枝物的一大特性。空化射流時間促進大豆蛋白的結構伸展,促進了SPI與糖的反應。形成中間產物的量增多,因此產物的還原力不斷增加[35-36]。SPI-葡萄糖共價復合物乳液的還原力大于SPI-葡聚糖共價復合物乳液,這是因為SPI與葡聚糖接枝度更小,相同條件下生成的美拉德反應產物較少。
2.6.2DPPH自由基清除能力測定
SPI-葡萄糖共價復合物、SPI-葡聚糖共價復合物乳液DPPH自由基清除能力如圖14所示。
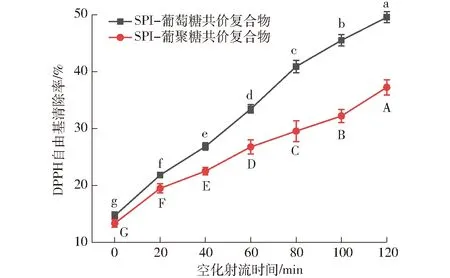
圖14 不同空化射流時間對SPI-葡萄糖共價復合物、SPI-葡聚糖共價復合物乳液自由基清除率的影響Fig.14 Effect of different cavitation jet treatment times on DPPH radical-scavenging activity of emulsion of SPI-glucose and SPI-dextran conjugates
DPPH自由基是一種高穩定性的自由基。DPPH自由基清除能力被廣泛用于評價保健品對不穩定H原子向自由基轉移的抗氧化能力。DPPH-醇溶液最大吸收波長為517 nm,顏色為紫色。環境中的抗氧化劑可作為氫供體與DPPH自由基反應,使其在517 nm處變為黃色,吸光度變小。517 nm處的吸光度變化可以用于評價物質的自由基清除率[37-38]。由圖14可知,隨著空化射流輔助時間增加,SPI-葡萄糖共價復合物、SPI-葡聚糖共價復合物乳液的DPPH自由基清除能力都在不斷增加。美拉德反應產物可以提夠氫原子與DPPH自由基結合,形成穩定DPPH-H分子以清除DPPH自由基。文獻[39]的研究表明,美拉德反應的中間產物和最終產物類黑精都可以作為氫供體,但高級階段產生的主要包括類黑精的褐色化合物是清除DPPH自由基的主要物質。在空化射流輔助處理的條件下,SPI與葡萄糖、葡聚糖的反應速率明顯加快。接枝反應更快向美拉德反應高級階段進行,美拉德反應高級階段產物類黑精的形成不斷增多,使接枝物的DPPH自由基清除能力不斷增加。在相同空化射流處理時間下,SPI-葡萄糖共價復合物乳液的DPPH清除能力更強,這是由于相同時間內SPI葡萄糖的接枝度較大,美拉德反應體系進入高級階段的程度更大,類黑精的形成量更多,使SPI-葡萄糖共價復合物的DPPH自由基清除能力較強。
3 結束語
經過一定時間空化射流處理的糖基化產物乳液的粒徑明顯降低、ζ-電位增大、微觀結構中的液滴逐漸均勻、蛋白吸附率顯著升高、乳析指數降低,這可能是由于空化射流使蛋白質去折疊,溶解性增加,從而使更多親水、疏水基團吸附在油-水界面,減小了蛋白聚集的可能性,從而起到了穩定乳液的作用,抑制乳液的分層;而空化射流處理時間過長會導致蛋白聚沉,使得糖基化產物乳液粒徑開始升高、ζ-電位絕對值減小、微觀結構中液滴開始發生聚集,蛋白吸附率降低,乳析指數呈逐漸上升趨勢,導致乳液的儲藏特性逐漸下降。但乳液抗氧化能力(還原力和DPPH自由基清除能力)始終呈上升趨勢,且其抗氧化能力與空化射流輔助處理時間呈正相關。因此,糖基化產物乳液在空化射流處理80 min時的乳液特性最佳,儲藏特性較好;且相比SPI-葡萄糖共價復合物,SPI-葡聚糖共價復合物乳液更穩定,粒徑分布更均一,表現出更佳的乳液儲藏特性。這為糖基化后的蛋白乳液的改性及空化射流處理在食品方面的應用提供了參考。

