不同生境人參莖葉總皂苷對心律失常小鼠的作用比較
婁云云,房慶偉,李坤,葉冠
(上海醫藥集團股份有限公司中央研究院,上海 201203)
心律失常是一種嚴重的心血管疾病,室性早搏(VPBs)和室性心動過速(VT)等室性心律失常可導致心源性猝死[1]。臨床抗心律失常藥物根據其動作電位的不同階段分為四類,包括Na+通道阻滯劑(Ⅰ類)、β受體阻滯劑(Ⅱ類)、K+通道阻滯劑(Ⅲ類)和Ca2+通道阻滯劑(Ⅳ類)。它們中的大多數藥物都具有嚴重的副作用,并且它們的治療和毒性作用之間的窗口很窄[2]。天然產物具有多靶點、療效顯著、安全性和結構新穎等優點,具有廣泛的臨床應用前景。
人參為五加科(Araliaceae)多年生草本植物人參(PanaxginsengC.A.Mey.)的干燥根及根莖。根據其播種方式及生長環境的不同,把人工播種栽培的人參稱為“園參”;把人工播種并任其在山林野生狀態下自然生長的稱為“林下山參”,習稱“籽海”[3]。目前臨床上使用的人參藥用部位大多為其根及根莖,但該藥用部位收獲周期較長、價格昂貴。而對于人參莖葉這個部位來說,該部位每年采收、價格低廉,而且研究發現林下山參莖葉中的總皂苷含量遠大于其根及根莖[4],具有良好的利用價值。目前,《中國藥典》2020年版也已收錄關于人參莖葉總皂苷提取物的質量標準[3],其中園參莖葉是生產該提取物的主要原料。目前關于人參莖葉總皂苷對心律失常作用的研究報道較少[5-6],其抗心律失常的作用機理也有待闡明。目前尚無林下山參莖葉總皂苷在心律失常方向上的研究報道。在本文中,我們研究比較了園參莖葉總皂苷(GSLS)和林下山參莖葉總皂苷(MSLS)對氯化鋇致心律失常小鼠Ⅱ導聯心電圖的影響,并測定了小鼠心肌Na+-K+-ATP酶及Ca2+-Mg2+-ATP酶的表達;探討了不同生境人參莖葉總皂苷對氯化鋇致心律失常小鼠的改善作用及其可能機制,為后期林下山參莖葉資源在心律失常上的更好應用提供理論依據。
1 材料與儀器
1.1 實驗動物 SPF級BALB/c小鼠80只,雌雄各半,體重16~18 g,由常州卡文斯實驗動物有限公司提供,實驗動物生產許可證號:SCXK(蘇)2016-0010;實驗動物使用許可證號:SYXK(蘇)2017-0040。實驗室通風狀況良好,環境溫度22 ℃左右,環境濕度40%左右,12 h明暗循環。實驗過程符合《實驗動物管理條例》的相關規定。
1.2 藥物與試劑 GSLS(人參莖葉總皂苷含量77.37%,人參皂苷Rg1、Re、Rd含量之和為34.06%),MSLS(人參莖葉總皂苷含量77.07%,人參皂苷Rg1、Re、Rd含量之和為37.46%),均為實驗室自制,其制法參考《中國藥典》2020年版[3]。實驗用園參莖葉及林下參莖葉樣品經葉冠教授級高級工程師鑒定為五加科植物人參(PanaxginsengC.A.Mey.)的干燥莖葉。無水乙醇AR(國藥集團化學試劑有限公司,批號:20181225);水合氯醛(上海阿拉丁生化科技股份有限公司,批號:F2103036);氯化鋇(上海沃凱生物技術有限公司,批號:20200509);ATP酶測試盒(南京建成生物工程研究所,批號:20201201)。
1.3 主要儀器設備 YF116B型打粉機(瑞安永歷制藥機械);BSA 224S電子天平(德國賽多利斯公司);Multiskan FC酶標儀(美國Thermo公司);D3024R型臺式高速冷凍離心機(美國SCILOGEX公司);恒溫金屬浴(美國Thermo公司);MD3000-C型生物信號采集處理系統(安徽正華生物儀器設備有限公司)。
2 方法
2.1 動物分組 SPF級BALB/c小鼠80只,體重約16 ~ 18 g,共分為8組:正常組、模型組、GSLS-L(10 mg·kg-1)、GSLS-M(20 mg·kg-1)、GSLS-H(40 mg·kg-1)、MSLS-L(10 mg·kg-1)、MSLS-M(20 mg·kg-1)、MSLS-H(40 mg·kg-1)劑量組,每組10只。
2.2 模型制備 用0.1%水合氯醛對小鼠進行麻醉,連接生物信號采集處理系統,然后通過小鼠尾靜脈注射0.4%氯化鋇溶液(0.2 mL/20 g)造模,并于4 s內注射完,注射后立即出現心律失常,隨即用生物信號采集處理系統監測每組小鼠Ⅱ導聯心電圖。
2.3 藥物制備 分別精密稱取GSLS和MSLS皂苷14、28、56 mg,用100 μL DMSO充分溶解,用生理鹽水稀釋至14 mL,分別得到GSLS和MSLS低(10 mg·kg-1)、中(20 mg·kg-1)、高(40 mg·kg-1)劑量組。
2.4 藥物干預及取材 各給藥組小鼠預先每天灌胃受試藥物,給藥體積為10 mL·kg-1體重,連續給藥7 d。正常組及模型組灌胃等體積的溶媒。末次給藥后1.5 h,除正常組外,模型組及給藥組動物按“2.2”項下方法進行模型制備。并于氯化鋇造模后1.0 h處死小鼠,解剖取各組小鼠非梗死區心肌組織。
2.5 心律失常持續時間的測定及對心電圖相關波段的影響 用生物信號采集處理系統監測并采集每組小鼠Ⅱ導聯心電圖,觀察小鼠心電圖P波、QRS波以及PQ間期的改善情況。
2.6 小鼠心肌ATP酶的測定 取保存于-80 ℃的非梗死區心肌組織100 mg,應用ATP酶測試盒檢測該組織中Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶活力值。
3 實驗結果
3.1 GSLS與MSLS對模型小鼠心律失常的影響 與正常組比較,模型組小鼠出現持續性快速心律失常;與模型組比較,GSLS-L、GSLS-M、GSLS-H、MSLS-L、MSLS-M、MSLS-H組心律失常持續時間均有所降低(P<0.01);GSLS和MSLS各同等劑量組比較未見統計學差異。此外,GSLS與MSLS對氯化鋇致心律失常小鼠心電圖的P波、QRS波和PQ間期均具有明顯改善作用,結果見表1和表2。
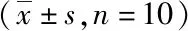
表1 小鼠快速性心律失常持續時間
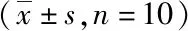
表2 小鼠Ⅱ導聯心電圖的P波、QRS波及PQ間期情況
3.2 GSLS與MSLS對模型小鼠心肌組織中ATP酶活力的影響 與正常組相比,模型組小鼠心肌組織中Na+-K+-ATP酶及Ca2+-Mg2+-ATP酶活力水平顯著降低(P<0.01)。與模型組相比,GSLS-L、GSLS-M、GSLS-H、MSLS-L、MSLS-M、MSLS-H組Na+-K+-ATP酶及Ca2+-Mg2+-ATP酶活力水平均有所升高,其中GSLS-M、GSLS-H、MSLS-M、MSLS-H組具有統計學意義(P<0.05,P<0.01)。GSLS和MSLS各同等劑量組比較未見統計學差異;而GSLS和MSLS對ATP酶活力的影響呈現出劑量依賴性,結果見表3。
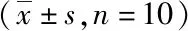
表3 小鼠心肌組織Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶的變化情況
4 討論
心電圖導聯分為肢體導聯(Ⅰ、Ⅱ、Ⅲ、avL、avR、avF)和胸前導聯(V1、V2、V3、V4、V5、V6)。正常心臟除極方向與Ⅱ導聯方向相似,所以Ⅱ導聯上的P波最明顯。非竇性心律及心律失常在Ⅱ導聯上易于識別,因此臨床上最常選擇Ⅱ導聯作為常規監測。P波是由竇房結激動心房引起的,右心房的激動通過P波的前部反映出來,而后部代表左心房的激動。QRS波反映快速心室去極化過程,一般認為Q波是室間隔電興奮過程,R波和S波是左右心室自由壁的興奮過程。P波、QRS波的時限和振幅改變對心律失常的診斷具有重要意義。PR(PQ)間期代表由竇房結產生的興奮經由心房、房室交界和房室束到達心室并引起心室肌收縮所需要的時間,故也稱為房室傳導時間。當發生房室傳導阻滯時,PR間期延長[7]。在此次研究中我們發現,與模型組比較,GSLS-L、GSLS-M、GSLS-H、MSLS-L、MSLS-M、MSLS-H組心律失常持續時間均有所降低。而GSLS和MSLS各同等劑量組比較未見統計學差異。進一步對其Ⅱ導聯心電圖分析發現,GSLS與MSLS對模型小鼠心電圖的P波、QRS波和PQ間期均具有明顯改善作用,表明GSLS與MSLS均可通過調整心房和心室的收縮以及房室傳導時間來改善氯化鋇致小鼠心律失常。
Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶是介導Na+、K+、Ca2+等離子穿過包括心肌細胞在內的膜蛋白[8-9]。Na+-K+-ATP酶是實現Na+和K+的逆電化學梯度跨膜轉運的關鍵酶,它可以把動作電位去極化過程內流的Na+轉運到細胞外,把復極化過程外流的K+運回細胞內。Ca2+-Mg2+-ATP酶則在Ca2+升高到一定程度時被激活,ATP水解供能使細胞內的Ca2+濃度降低。以上兩種ATP酶對于調節心肌細胞的收縮、舒張功能有著很重要的作用。當心肌細胞Na+-K+-ATP酶活性降低時,細胞內Na+增多,K+減少,細胞內Ca2+過多,除引起Ca2+超負荷損傷外,還使細胞內明顯缺K+,導致心肌細胞自律性增高,傳導速度減慢,易致心律失常。同時,細胞膜和肌漿網中Ca2+-Mg2+-ATP酶的功能也發生障礙,使胞內Ca2+超載,這進一步為觸發心律失常奠定了基礎。因此,Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶可作為心律失常的合適生物標志物[10-12]。在此次研究中我們發現,模型組小鼠Na+-K+-ATP酶[(0.40±0.39)μmol·(mg·h)-1]和Ca2+-Mg2+-ATP酶[(0.78±0.48)μmol·(mg·h)-1]的平均值顯著低于正常組,該結果表明心律失常模型小鼠的成功建立。而GSLS和MSLS給藥組小鼠的兩個ATP酶活性較模型組而言均存在不同程度的升高,并且存在劑量依賴性。其中低劑量組(10 mg·kg-1)較模型組有升高,但是沒有顯著性差異;而中劑量組(20 mg·kg-1)和高劑量組(40 mg·kg-1)較模型組有顯著性升高,其中高劑量組最佳。然而GSLS和MSLS各等同劑量組比較未見統計學差異。
人參是一種生長緩慢的多年生植物,其根及根莖在中國已經有幾千年的藥用歷史,現代藥理和化學研究表明其中最主要的生物活性成分為人參皂苷[13]。人參莖葉作為人參的非藥用部位,其資源豐富、生長周期短、價格低廉、皂苷含量豐富,隨著近年來對人參皂苷需求的不斷增加,對于人參莖葉皂苷相關的研究也需進一步加強。Wang等[14]通過HPLC-IT-TOF-MS技術發現了由5個色譜峰組成的特征峰模式可用于區分野生人參、林下山參和園參。與園參相比,林下山參皂苷含量和色譜指紋圖譜與野生人參更接近,而野生人參、林下山參和園參之間的差異主要是由于生長周期的不同造成的。以此類推,我們從化學成分的角度來分析本研究中GSLS和MSLS各等同劑量間沒有顯著性差異的可能原因。首先,林下山參莖葉和園參莖葉不存在生長周期的不同,莖葉每年采收一次,與傳統藥用部位的采收期有明顯不同;第二,此次研究用的是人參莖葉總皂苷提取物,其總皂苷含量相近并且達到了《中國藥典》2020年版人參莖葉總皂苷標準,只是在部分單體化合物的化學組成和含量上的差異;最后,人參莖葉總皂苷提取物通過多靶點、多通路發揮藥效,整體的藥效結果沒有顯著性差異,但是發揮作用的機制可能是千差萬別,需要后期的進一步研究驗證。
綜上所知,Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活性測定聯合Ⅱ導聯心電圖分析對氯化鋇致心律失常小鼠模型的預后和治療具有重要意義,本研究也為后期不同生境人參莖葉資源在心律失常相關疾病上的利用提供理論依據。

