碳硫雙手性鄰苯二甲酰類魚尼丁受體殺蟲劑研究進展
李林珊,謝偉彬,鄭占英,李正名,周 莎
(南開大學 元素有機化學研究所 農藥國家工程研究中心,天津 300110)
近年一些具有傳統作用機制的殺蟲劑品種(如有機氯、有機磷等)因毒性、殘留等問題被禁用,而氟蟲腈(fipronil)、吡蟲啉、噻蟲胺、噻蟲嗪等殺蟲劑因蜂毒或對水生動物不良影響被歐盟限制使用,因此全球對安全、環境友好殺蟲劑的需求愈來愈迫切。創制對人畜和非靶生物體影響較小,具有超高生物活性、高選擇性的綠色殺蟲劑是殺蟲劑可持續發展的迫切需求。魚尼丁受體類殺蟲劑是繼新煙堿類殺蟲劑后受市場歡迎的一類殺蟲產品,其結構新穎、作用機制獨特、高效廣譜。本文介紹了碳硫雙手性鄰苯二甲酰類魚尼丁受體殺蟲劑及其結構活性研究進展,為該類殺蟲劑創制研究提供指導。
1 魚尼丁受體類殺蟲劑
1.1 作用機制
魚尼丁受體類殺蟲劑作用于昆蟲體內非電壓門控鈣離子釋放通道,能有效調控昆蟲體內鈣離子流量,引起昆蟲肌肉調節功能失效,導致昆蟲不自主地抽搐、癱瘓和死亡,從而表現出優異的生物性能[1]。這類殺蟲劑具有對環境友好、廣譜、高效等優勢。
1.2 結構模型
魚尼丁受體主要存在于神經細胞的內質網(endoplasmic reticulum,ER)膜、肌肉細胞的肌質網(sarcoplasmic reticulum,SR)膜上,是由4個相同亞基組成的一類鈣離子釋放通道(calcium release channel,CRC)。圖1展示了其中的2個亞基,每個亞基大約由5 000個氨基酸組成,分子量約為565 kDa,魚尼丁與魚尼丁受體結合的位點位于通道孔道內側。
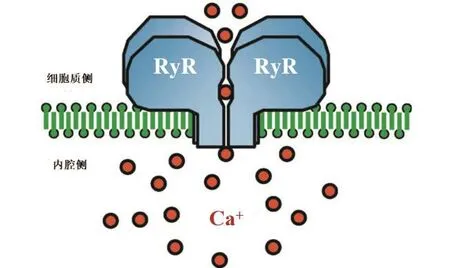
圖1 魚尼丁受體結構示意圖[2]
隨著計算機三維重組技術與冷凍電子顯微鏡的快速發展,已得到了魚尼丁受體的結構模型,圖2為不同角度的魚尼丁受體三維結構的圖像[3]。從側面的角度,魚尼丁受體的結構整體上類似于蘑菇狀,胞漿區(cytoplasmic domains)是較大的傘部部分,該結構將魚尼丁受體與細胞膜緊密聯系起來;RyR的跨膜區(transmembrane domains)是較小的柄部部分,位于C末端,孔徑約1~2 nm,形成鈣離子釋放通道,跨膜區大約包含 4~12個跨膜片段(transmembrane segments)。跨膜區一方面是釋放Ca2+的通道,另一方面能將魚尼丁受體固定于肌漿網(sarcoplasmic reticulum,SR)上。從頂部和底部角度來看,較大的胞漿區和較小的跨膜區均呈正方形。
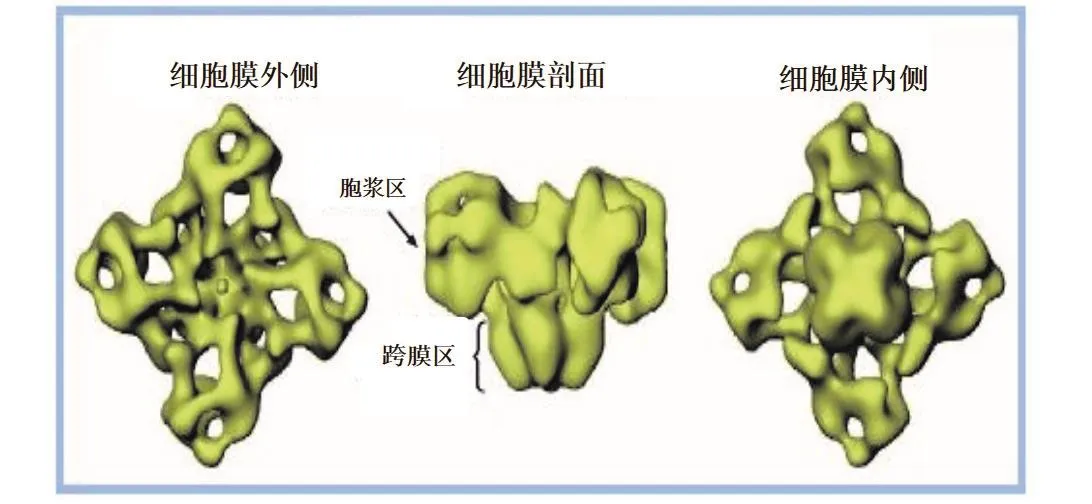
圖2 魚尼丁受體的三維結構圖像——四聚體“蘑菇狀”[3]
1.3 商品化的魚尼丁類殺蟲劑
人們對于昆蟲獨特的作用靶標——魚尼丁受體進行探索,最初研究的主要著眼點在于魚尼丁的結構修飾。第一類作用于魚尼丁受體的植物源農藥是魚尼丁堿(ryanodine),其結構(圖3)復雜難以合成[4],天然魚尼丁堿于20世紀60年代退出殺蟲劑市場。蘭尼醇(ryanodol)是通過魚尼丁結構修飾方法得到的唯一公認的商品化化合物[5]。通過多年的探索研究,商品化魚尼丁受體殺蟲劑有日本農藥公司創制成功的氟苯蟲酰胺(圖4,flubendiamide)[6],它是世界上第一個魚尼丁抑制劑。在此基礎上杜邦公司開發出藥效更優的氯蟲苯甲酰胺和溴氰蟲酰胺[7]。此外,隨后陸續上市的商業化品種有四氯蟲酰胺、環溴蟲酰胺、四唑蟲酰胺和溴蟲氟苯雙酰胺。這類化合物對人體沒有不良影響,專門調節昆蟲體內鈣離子通道[8]。因此,該類超高效殺蟲劑上市后迅速壟斷了國內外市場,代表了創制生態環保型殺蟲劑的新方向。杜邦借此發明已3次獲得國際植保科技界頒發的“最佳研發獎”。
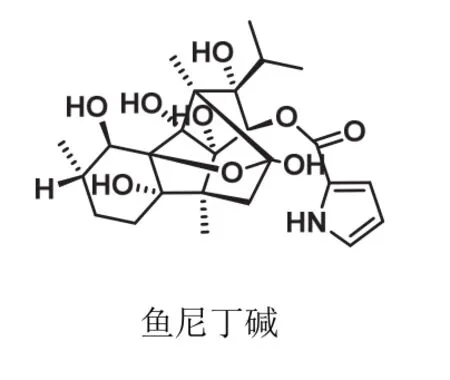
圖3 天然魚尼丁堿的結構式
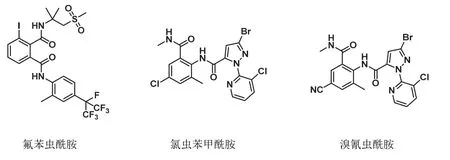
圖4 氟苯蟲酰胺、氯蟲苯甲酰胺和溴氰蟲酰胺
2 含碳硫雙手性魚尼丁受體殺蟲劑研究進展
當今世界上使用的農藥中25%以上具有手性的特點[9]。這類手性農藥,一般含有碳、磷或氮原子等。目前,已商品化的650余種農藥中,手性農藥占全球農藥市場的35%,且其比例仍在上升之中。由于生物體對各手性異構體識別能力的差異,以及不同靶標對不同手性異構體的匹配性關系,因此各手性體之間往往呈現出不同的生物活性[10]。單一高活性手性體或不含無效手性體的手性農藥以低的劑量表現超高的藥效,減少農藥使用量,提高了效益。因此,近年對手性農藥的研究成為熱點。
氟苯蟲酰胺在 1998年發現,2007年上市。據報道,氟苯蟲酰胺在 2018年全球銷售額就已達到4.77億美元[11],2013-2018年的復合年增長率是15.3%。國際上對這種具有新穎作用機制的魚尼丁受體殺蟲劑的手性化學研究報道甚少,創制具有更高生物活性的手性雙酰胺類殺蟲劑和總結其構效關系有待深入探索。
2012年本課題組報道一類硫亞胺和亞磺酰亞胺結構的化合物,研究結果表明此類結構物表現優異的殺東方黏蟲和小菜蛾活性[12,13],個別化合物對小菜蛾的生物活性高于商品化對照藥劑氟苯蟲酰胺,其LC50略低于氟苯蟲酰胺(圖5,表1和表2)。
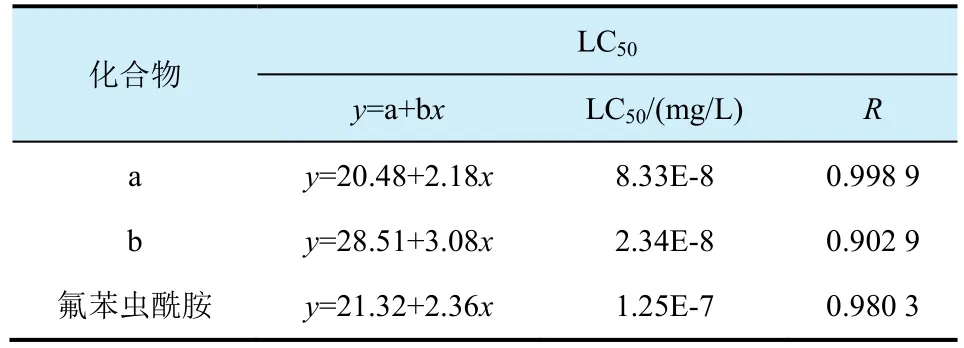
表2 化合物a、b和氟苯蟲酰胺對小菜蛾的半致死濃度對比

圖5 高活性化合物a和b的結構式
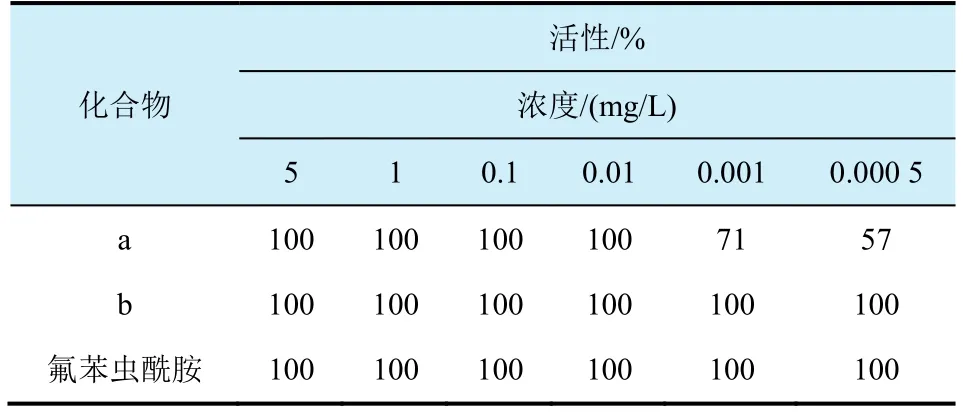
表1 化合物a、b和氟苯蟲酰胺對小菜蛾幼蟲的活性對比
優異的生物活性啟發我們進一步深入探索,保留1個碳手性中心,首次引入第2個手性中心開展了手性硫亞胺和亞磺酰亞胺類的工作,設計合成了未見報道的含碳硫雙手性的鄰苯二甲酰胺類化合物(圖6),進一步研究手性化合物對東方黏蟲和小菜蛾的生物活性。
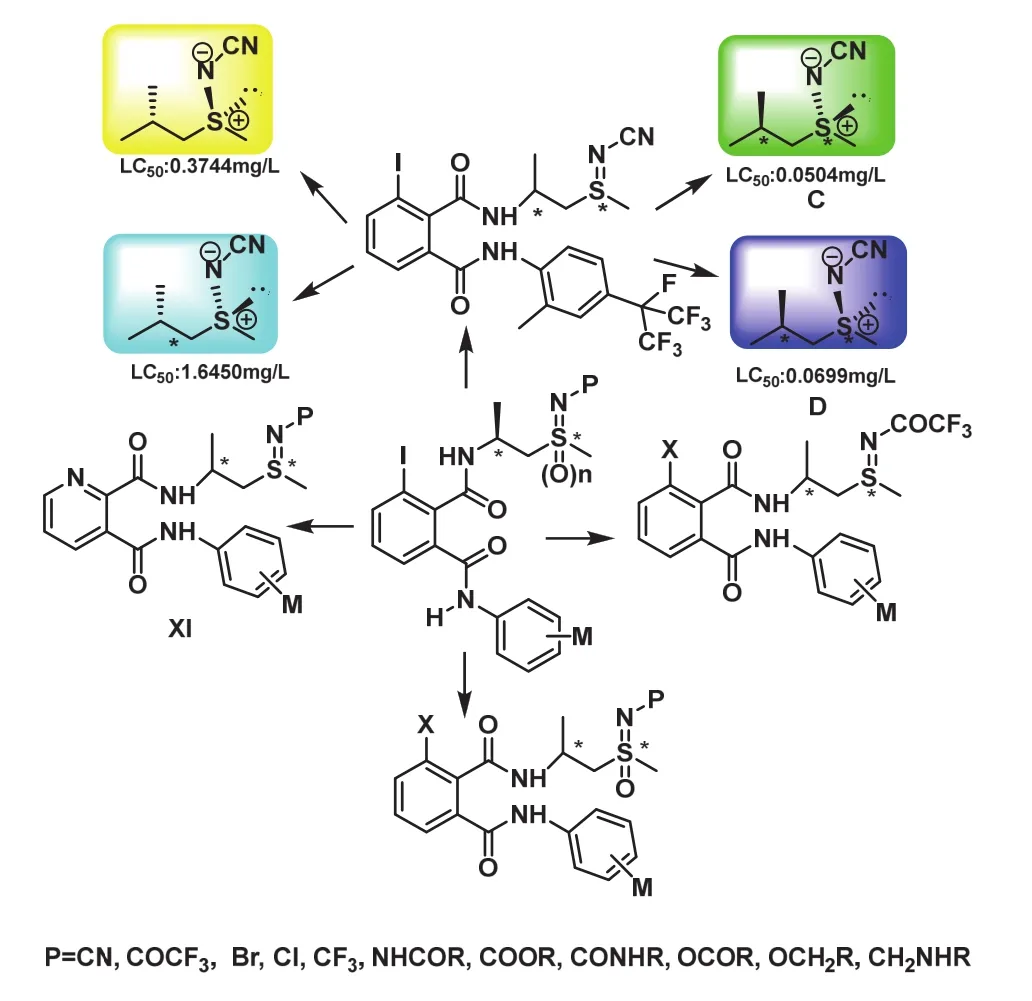
圖6 硫亞胺和亞磺酰亞胺類化合物的結構設計
結構中有2個手性中心,因此試驗中得到4個光學體[14,15],這也是首次報道含有光學活性的硫亞胺和亞磺酰亞胺類結構的鄰苯二甲酰胺類化合物(圖7)。

圖7 N-CN硫亞胺類化合物結構以及對東方黏蟲的生物活性
根據以上數據可以得到N-CN的硫亞胺類化合物不同異構體對東方黏蟲的活性是(Sc, Ss)≥(Sc,Rs)>>(Rc, Ss)>(Rc, Rs)[14];而N-COCF3的硫亞胺類化合物對東方黏蟲的活性規律順序是(Sc, Rs)≥(Sc,Ss)>>(Rc, Ss)>(Rc, Rs)[15]。由此可以推測手性碳和硫共同的協調效應可能致使不同的異構體呈現不同的生物活性。苯環部分化合物的活性最高的為碘取代的化合物,化合物C和D的LC50分別為0.050 4、0.069 9 mg/L,均低于氟苯蟲酰胺(0.123 0 mg/L)。值得一提的是部分化合物對小菜蛾的生物活性遠遠高于對照藥劑氟苯蟲酰胺2個數量級(圖8和表3),化合物E和F對小菜蛾的生物活性分別是100% (10-6mg/L)和80% (10-6mg/L),氟苯蟲酰胺的殺蟲活性是0%(10-4mg/L)。大部分N-COCF3結構物的生物活性優于相應的N-CN結構物的生物活性,可能是N-COCF3的結構具有較好的親脂性和疏水性。CoMFA分析結果表明N-COCF3的體積效應致使N-COCF3結構化合物的活性高于相應的N-CN結構的化合物[16-18]。筆者與中國農科院植保所合作展開對化合物 C進行轉錄測序的相關試驗,測試結果表明:目標化合物 C可能作用于調控鈣離子釋放通道的魚尼丁受體,導致肌質網鈣泵中的鈣離子釋放,當鈣離子進入胞漿,致使胞漿中鈣離子濃度升高激發了相關的肌肉收縮反應,從而使與其相關的肌球蛋白、肌動蛋白、肌聯蛋白、unc-89以及抗肌萎縮蛋白(dystrophin)基因表達量上調[19-21]。
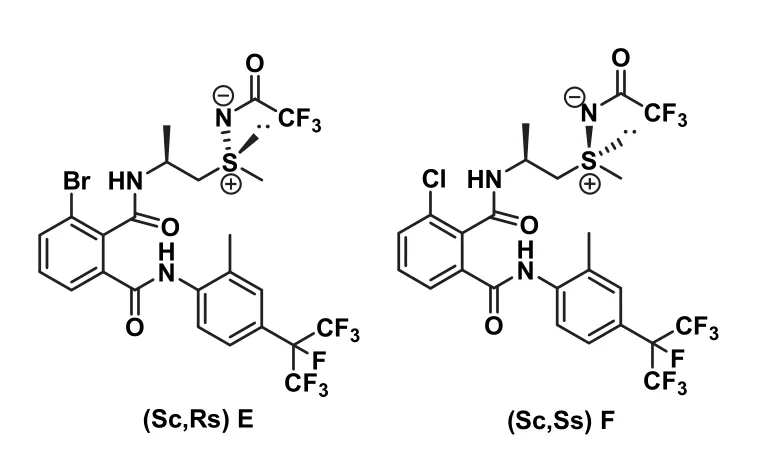
圖8 化合物E和F的結構式
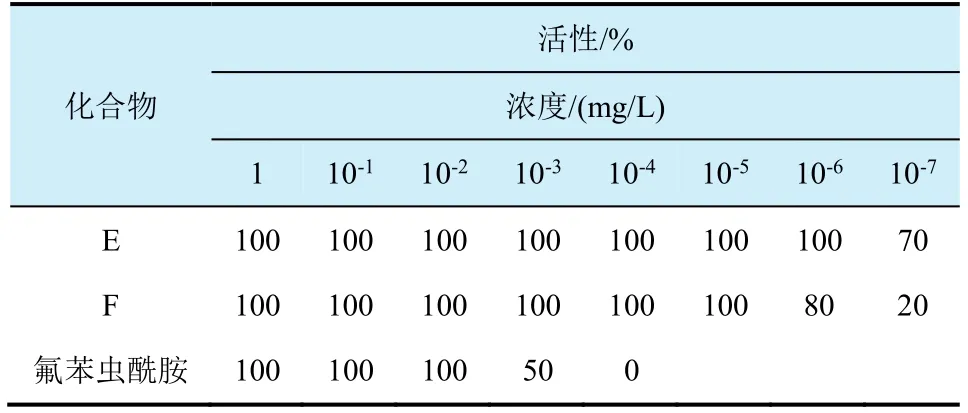
表3 化合物E、F和氟苯蟲酰胺對小菜蛾幼蟲的活性對比
這也是首次將手性硫引入RyR殺蟲劑中,初步地探索手性硫和碳存在協同效應對生物活性的影響。
基于前期對硫亞胺類和亞磺酰亞胺類化合物生物活性的研究[22,23],單甲基手性硫亞胺類和亞磺酰亞胺類結構化合物的生物活性優于相對應的2個甲基的雙酰胺類衍生物。因此筆者初步得出結論,從分子的設計角度來講,脂肪酰胺鏈中第2個甲基在含有硫亞胺和亞磺酰亞胺結構的鄰苯雙酰胺類結構中可能不是生物活性的必要條件,隨后對此類結構進一步拓展,深入研究其構效關系。
Casida宣稱現在是RyR和GABA-R (γ-aminobutyric acid receptor,γ-氨基丁酸受體)的黃金時代[24]。魚尼丁受體殺蟲劑所具有高效低毒、結構新穎、作用機制獨特、對環境友好、對哺乳動物安全等優點,目前是殺蟲劑領域的研究重點和熱點。綠色生態農藥魚尼丁受體殺蟲劑,以及作用于GABA-R獨特的作用位點的異噁唑啉化合物(isoxazolines)和間甲酰胺基苯甲酰胺類化合物具有安全高選擇性的特點[25],更加激發我們對綠色生態殺蟲劑的不斷探索。
3 總結與展望
截至目前,天津大學的尉遲之光教授解析了昆蟲魚尼丁受體的磷酸化功能域的高分辨晶體結構,揭示了昆蟲與哺乳動物的顯著區別[26]。另外該研究團隊通過計算機建模和分子對接的方法研究發現小菜蛾鈣離子通道魚尼丁受體開關調節機理,與殺蟲劑的識別結合機制,以及小菜蛾產生抗藥性的分子機理[27,28]。這對解決殺蟲劑的抗藥性,及綠色農藥研發意義重大。但是雙酰胺類殺蟲劑真正的作用機制還有待進一步明確,殺蟲劑與昆蟲魚尼丁受體殺蟲劑的結合位點和結合機制也有待進一步探討,也未得到殺蟲劑分子與魚尼丁受體對接的單晶結構,因此還有很長的路要走。
新農藥創制不僅要求所創制產品高效,且對溫血動物低毒、對環境無不良影響。碳硫雙手性鄰苯二甲酰類魚尼丁受體殺蟲劑研究進展為創制具有我國自主知識產權的新型魚尼丁受體殺蟲劑提供了一定的理論基礎,對新農藥創制工作具有指導意義。

