化學反應中物質(zhì)過量問題的分析
張 瑞
(安徽省界首第一中學 236500)
物質(zhì)過量問題是高中化學的一種常見問題.因不同物質(zhì)過量可能會引發(fā)不同的化學反應,導致一些學生在分析的過程中出錯率較高.為提高學生的分析能力以及解答該類問題的正確率,教學中應做好物質(zhì)過量問題的分析教學,使學生掌握相關的分析思路與分析技巧,能夠在解題中以不變應萬變.
1 物質(zhì)過量現(xiàn)象的判斷
部分反應中某一物質(zhì)的過量引發(fā)一連貫的反應,對應不同的反應現(xiàn)象.為使學生更好地判斷物質(zhì)過程的反應現(xiàn)象,應要求學生做好化學反應現(xiàn)象的總結(jié),尤其應明確其中的原理,準確把握背后發(fā)生的化學反應.
例1下列操作中,不出現(xiàn)“先產(chǎn)生沉淀,而后沉淀溶解”現(xiàn)象的是____.
(1)將過量CO2通入到飽和碳酸鈉溶液中.
(2)向Fe(OH)3膠體中逐滴加入過量的稀HCl.
(3)將過量CO2通入NaAlO2溶液中.
(4)向澄清石灰水中緩慢通入過量的CO2.
解析(1)碳酸鈉和過量CO2反應生成碳酸氫鈉,因碳酸氫鈉的溶解度小于碳酸鈉,因此會出現(xiàn)碳酸氫鈉沉淀,但并不溶解.
(2)Fe(OH)3膠體會發(fā)生聚沉現(xiàn)象出現(xiàn)沉淀,當加入過量的稀HCl時發(fā)生反應生成氯化鐵,沉淀溶解.
(3)NaAlO2和過量CO2反應生成Al(OH)3沉淀,但沉淀并不溶解.
(4)中先后生成CaCO3沉淀,而后生成可溶的Ca(HCO3)2,沉淀溶解.
綜上符合題的有①③.
2 物質(zhì)過量離子種類的分析
一些物質(zhì)過量會導致一些原本不發(fā)生反應的離子發(fā)生反應.分析該類問題需要掌握物質(zhì)過量對原有離子造成的影響,思考生成哪些新的物質(zhì)、這些生成的物質(zhì)是否與原有離子發(fā)生反應、發(fā)生怎樣的反應等,從而做出準確的判斷.
例2下列各組離子的溶液中,通入(加入)過量某物質(zhì)后,仍能大量共存的是( ).
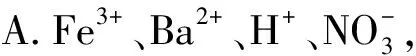
B.H+、K+、Cl-、Ca2+,通入CO2氣體
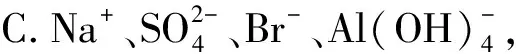
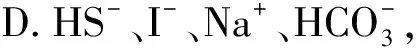
解析A項發(fā)生氧化還原反應:
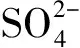
無法大量共存.D項因發(fā)生反應

離子無法大量共存.綜上只有B項正確.
3 物質(zhì)過量相關參數(shù)的計算
計算物質(zhì)過量相關的參數(shù)時需要明確在不同階段發(fā)生的化學反應、生成的具體物質(zhì),又要能夠根據(jù)發(fā)生的化學反應現(xiàn)象找到相關參數(shù)之間的關系.
例3將置于空氣中的NaOH固體樣品溶于水中,而后向其中逐滴加入HCl至過量,生成標準狀況下的CO2體積和加入HCl的體積關系如圖1所示(忽略溶于水中的CO2),則以下判斷錯誤的是( ).
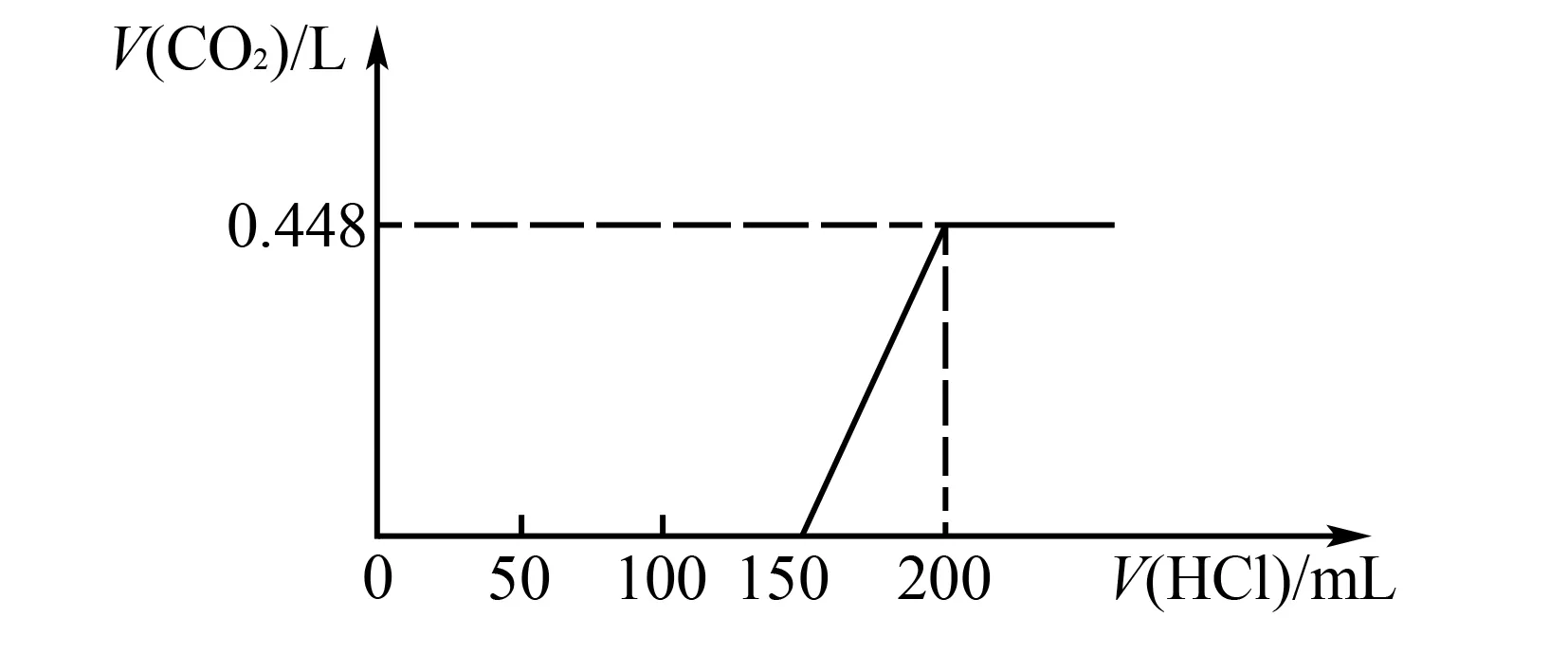
圖1
A.滴加HCl 0~150mL段,發(fā)生的反應依次為

B.所有HCl的物質(zhì)的量濃度為0.4mol/L
C.CO2體積不發(fā)生變化時,溶液中的溶質(zhì)為NaCl
例3:某高校重大事項未嚴格依法依規(guī)進行決策,涉及金額681.9萬元。某高校經(jīng)校長辦公會研究決定“同意啟動新校區(qū)一至六飯?zhí)煤团f校區(qū)飯?zhí)媒y(tǒng)一招標工作”,收取承包費。3年合計收取承包管理費 (折舊費)681.9萬元。上述事項雖經(jīng)集體討論決定,但決策結(jié)果不符合教育部《關于進一步加強高等學校學生食堂工作的意見》第二點規(guī)定的高校內(nèi)食堂的建筑設施由該高校統(tǒng)一提供,對承包經(jīng)營都實行零租賃,免收管理費。
D.樣品中NaOH、Na2CO3的物質(zhì)的量之比為1∶2
解析由圖可知HCl 0~150mL段未出現(xiàn)CO2氣體,發(fā)生的反應依次為:

產(chǎn)生氣體發(fā)生的反應為:
以滴加HCl 150~200mL為研究對象,容易計算出HCl的物質(zhì)的量濃度為0.4mol/L.C項,CO2體積不變化時,溶液中NaHCO.剛好完全反應,溶液溶質(zhì)為NaCl.當加入HCl為200mL時,溶液溶質(zhì)為NaCl,n(NaCl)=0.4mol/L×0.2L=0.08mol.由碳原子守恒可得n(Na2CO3)=n(CO2)=0.02mol;由鈉原子守恒可得固體中n(NaOH)=0.04mol,顯然D項錯誤.
4 過量問題的常見題型分析
4.1 直接給出反應物的量,直接計算
此種類型的題目是最為常見、最為基本和直接的問題,解題基本沒有難度,按照解題步驟進行嚴謹解題.在解題時,需要做好題目的綜合分析,避免出現(xiàn)顧此失彼的情況.
例4在鐵粉和硫粉的混合物中鐵粉為221g,硫粉為8g,對混合物進行加熱,忽略其他損失,可以生成ag硫化亞鐵,將反應后的固體混合物投入到足量的稀硫酸中,可以得到標準狀況下VL氣體,那么a、V的值分別是( ).
A.33、8.4 B.22、5.6 C.29、8.4 D.22、8.4
解析根據(jù)題意n(Fe)=0.375mol,n(S)=0.25mol,因為
可以得出Fe過量,根據(jù)S的量進行計算,得出FeS的質(zhì)量為22g,因為產(chǎn)生的氣體是H2S和H2的混合氣體,計算得出氣體的體積是8.4.
4.2 固體反應物過量,做出定性判斷
在化學反應中,部分反應要求液體是高濃度,當固體反應物過量的情況下,隨著化學反應的進行,溶液的濃度開始降低,使得反應停止,或者出現(xiàn)其他反應.對這樣的問題,不能夠選擇不足量的物質(zhì)做出計算,需要借助動態(tài)化思想,做出定性判斷.如Cu、Ag等金屬和濃硫酸反應、二氧化錳和濃鹽酸反應.在Zn和濃硫酸的反應中,濃度下降之后,還原產(chǎn)物也從二氧化硫變成氫氣.
例5在100mL 18mol/L的H2SO4中,加入64g銅片,并且對其進行加熱,被還原的H2SO4的物質(zhì)的量是( ).
A.等于1.8mol B.等于1mol
C.等于0.9mol D.小于0.9mol
解析通過對題目進行分析,可以看出Cu是明顯過量的,如果直接進行選量計算,得出的結(jié)果是C,很明顯是一個錯誤的答案.根據(jù)題意進行深入分析,隨著化學反應的進行,生成的水使得H2SO4溶液的濃度降低,因此,H2SO4被還原的物質(zhì)的量應當小于0.9,選擇D項.
4.3 混合物與某物質(zhì)反應過量,做好轉(zhuǎn)化計算
在化學反應中,涉及到混合物和某物質(zhì)的過量問題,將混合物抽象轉(zhuǎn)化成單一部分,做出相應的判斷之后,在對其進行計算.
例6 在25℃和101kPa的條件下,CO和H2的混合氣體10L,將其通入到15L的O2中,使其完全燃燒,干燥后恢復到原來的條件,求解:
(1)如果剩余氣體體積是15L,那么原有混合氣體中CO的體積是____,H2的體積是____.
(2)如果剩余氣體的體積是aL,那么原有混合氣體中CO和H2的體積比是____.
(3)如果剩余氣體的體積是aL,那么a的取值范圍是____.
解析此題在解題時,用到的是學生初中階段熟悉的知識,一氧化碳和氧氣以及氫氣和氧氣的燃燒反應,在3個問題中,從數(shù)字到字母,題目難度增加,雖然解題方式比較多,但解題的突破點是對過量問題的討論.根據(jù)化學反應的特點進行分析,可以得出氧氣的消耗是5L,剩余氧氣體積是10L,所有得到的二氧化碳的體積是5L,根據(jù)碳原子守恒定定律可以得出CO的體積是5L,H2的體積是10L.結(jié)合(1)的分析,將其中的數(shù)字轉(zhuǎn)化成字母,得出CO的體積是a-10,H2的體積是20-a,計算出混合氣體中兩種氣體的體積比.(3)題解答中,利用極值思想,假設混合氣體全部是H2,剩余氣體是O2,所以a=10,假設混合氣體全部是CO,a=20,因此得出a的取值范圍是10 在活潑金屬和水直接反應的問題中,不能夠簡單地按照溶質(zhì)的量做出計算,需要對其進行分析,做好量的選擇. 例7 在1 L 0.1mol/L的3份稀鹽酸中,分別放入Na、Mg、Al各0.2mol,產(chǎn)生氫氣的物質(zhì)的量的比是( ). A.1∶2∶3 B.3∶2∶1 C.2∶1∶1 D.1∶1∶1 解析在解題時,如果不考慮過量的情況,按照金屬進行計算,得到的答案是A,但卻是錯誤的答案,根據(jù)3種金屬和稀鹽酸的化學反應,分析可知鹽酸對于3種金屬都是不足量,計算時可能會出現(xiàn)錯誤選項D.在分析時,讓學生對Na和稀鹽酸的反應進行分析,在反應時,鈉和水發(fā)生化學反應,鈉不僅不會剩余,還會產(chǎn)生0.2mol的H2,因此,Na和稀鹽酸的反應中生成的氫氣是Mg、Al的2倍,正確答案是C. 化學反應中某種物質(zhì)過量意味著另一種與之發(fā)生反應的物質(zhì)完全參加反應,在書寫相關的化學方程式時應引起足夠的重視.同時,針對逐漸添加某種物質(zhì)至過量的問題,應搞清楚各個階段參加反應的物質(zhì)以及對應的化學方程式.4.4 溶質(zhì)不足溶劑繼續(xù)反應,應當慎重選量

