鏈霉菌SG17 代謝產物對玉米黃曲霉的抑制作用及其穩定性分析
宋根娣, 王佳偉, 周 斌, 孫新媱, 周 陽, 黃珍珍
(洛陽理工學院 環境工程與化學學院,河南 洛陽471023)
玉米是全球重要的谷類作物,也是我國大宗糧食之一。 據聯合國糧農組織統計資料表明,我國玉米種植面積和總產量位居世界第二, 僅2017 年我國玉米總產量達2.6 億噸, 居三大糧食作物之首[1]。玉米因其具有高蛋白質、高脂肪含量的特點,廣泛應用于食品、飼料等行業。 我國每年用作飼料加工的玉米占總產量的60%左右,并呈現逐年上升的趨勢,玉米總消費量的80%~90%均與人和動物有關,因此玉米的品質安全直接影響人們的健康[2]。
與其他谷物相比,玉米胚部的占比大,吸濕性強,易受黃曲霉的侵染,特別是轉入貯存后,腐生型的黃曲霉菌極易侵染玉米籽粒并迅速生長產生毒素[3]。 高秀芬等對我國不同地區玉米的黃曲霉污染情況進行調查發現,在吉林、河南、湖北、四川、廣東、廣西采集的279 份玉米樣品中,黃曲霉毒素陽性率為 75.63%,毒素平均為 44.04 μg/kg[4]。 及華等對河北省貯存玉米樣品進行分析,結果顯示河北中南部的低平原區,玉米黃曲霉污染率達100%,檢出黃曲霉毒素 B1最高為 61.5 μg/kg[5]。 全球每年因黃曲霉污染而廢棄的糧食占農作物產量的0.5%。 因此,黃曲霉污染已經成為現代農業特別是玉米加工行業急需解決的問題之一。
目前,防治黃曲霉菌的方法主要有兩種:一是通過抑制孢子萌發和菌絲生長,從源頭上控制黃曲霉污染,進而減少毒素產生;二是對已經感染的農作物進行脫毒或毒素降解處理[6]。 針對毒素的處理在實際操作過程中存在成本較高、 具有較強刺激、毒副作用大、易殘留、降解周期長等缺點,影響玉米的品質和適口性,不符合目前玉米加工行業對綠色健康的要求[7]。 因此,從源頭上防控玉米霉變,進而減少黃曲霉毒素危害具有非常重要的研究意義。 源頭防治主要是通過篩選能夠抑制黃曲霉生長的微生物及其次生代謝產物或提取植物天然成分進行防治。 其中天然植物來源的防霉抑菌劑雖然也具有綠色、安全、無殘留的特點,但是其生產成本高,穩定性差,直接制約了其在生產中的應用[8]。 因此,篩選能夠顯著抑制黃曲霉菌生長的拮抗菌,以其發酵液制備抑菌劑,具有更加廣闊的應用前景[9-10]。
作者從畜禽養殖場動物糞便堆積區的土壤中分離獲得一株能夠顯著抑制黃曲霉生長的菌株,暫命名為SG17。通過形態學檢測、培養特征分析、生理生化分析及16S rRNA 序列對比進行初步鑒定,并對其抑菌廣譜性、發酵液抑菌粗提物的活性及穩定性進行了分析測定, 進一步以霉變玉米作為對象,探究該抑菌粗提物對玉米黃曲霉的抑制效果,為開發新型生物防霉劑提供資源。
1 材料與方法
1.1 材料與試劑
SG17 菌株由作者所在實驗室從洛陽本地畜禽養殖場糞便堆積地土壤中分離獲得; 玉米黃曲霉(Aspergillus flavus)、 黑 斑 病 菌 (Alternaria brassicae)、炭疽病菌(Colletotrichum)、辣椒疫霉病菌(Phytophthora capsici)保存于洛陽理工學院微生物實驗室。
PDA 培養基:馬鈴薯 200 g、葡萄糖 20 g、瓊脂18 g、蒸餾水 1 L;自然 pH。
高氏一號培養基:可溶性淀粉20 g、瓊脂20 g、KNO31 g、K2HPO40.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O 0.01g;pH 7.4~7.6。
伊莫松培養基:葡萄糖10 g、酵母膏10 g、牛肉膏 4 g、蛋白胨 4 g、NaCl 2.5 g、蒸餾水 1 L;自然pH。
酵母葡萄糖培養基:酵母膏10 g、蛋白胨20 g、葡萄糖20 g、瓊脂粉18 g、蒸餾水1 L;自然pH。
細菌DNA 快速提取試劑盒、PCR 擴增試劑、染色液制備試劑:天根生化科技(北京)有限公司產品;凝膠回收試劑盒:北京全式金生物工程有限公司產品;其他試劑均為分析純:國藥集團化學試劑有限公司產品。
1.2 儀器與設備
SPX 型智能生化培養箱、Olympus 光學顯微鏡:美國 Bio-Rad 公司產品;PTC-200 型 PCR 儀: 美國MJ Research 公司產品; 全自動凝膠成像分析系統:美國Bio-Rad 公司產品;HZQ-F160 全溫振蕩培養箱:華美生化儀器(江蘇)公司產品;臺式高速冷凍離心機:德國Heraeus 公司產品。
1.3 研究方法
1.3.1 菌株的形態特征分析 將活化后的SG17 接種于PDA 培養基上培養6 d,挑取部分單菌落置于載玻片,加入無菌水涂勻,干燥,固定后用結晶紫混合染液染色30~60 s,水洗,干燥后用顯微鏡觀察形態特征。
1.3.2 菌株培養特征及生理生化鑒定 參照鏈霉菌鑒定手冊[11],28 ℃恒溫培養,在7~14 d 中進行觀察并記錄特征。
1.3.3 菌株分子鑒定及系統發育分析 采用DNA快速提取試劑盒進行菌體DNA 的提取。 16S rRNA的擴增采用通用引物進行,27F:5′-AGAGTITGATC CTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGA CTT-3′, 擴增片段約 1.6 kb,PCR 產物進行瓊脂糖(1 g/dL)凝膠電泳。 目的片段切膠回收后,送至上海生工測序。 目的序列在GenBank 數據庫中進行BLAST 比對, 選擇同源性相近的種屬序列, 利用MEGA6.0 軟件計算遺傳距離,用鄰近法構建系統發育樹。
1.3.4 SG17 抗菌譜的測定 采用對峙法在PDA 固體培養基兩側分別接種SG17 及已經活化培養5 d的病原菌 (直徑約6 mm 的圓形菌餅), 以不接種SG17 的平板為對照,28 ℃恒溫培養5 d, 觀察抑菌情況,重復3 次,根據抑菌帶直徑確定抑菌效果。
1.3.5 SG17 抑菌粗提物的制備 以接種體積分數3%將SG17 接種于100 mL PDA 液體培養基中,在30 ℃以160 r/min 振蕩發酵培養5 d。 將發酵液在4 ℃下以 12 000 r/min 離心 10 min, 上清液經吸附樹脂吸附后解吸,洗脫液冷凍干燥后得到抗菌物質粗提物。 將粗提物加入2 mL 無菌水進行稀釋,并用0.22 μm 除菌過濾器過濾,制備抑菌粗提物原液,4 ℃保存備用。
1.3.6 SG17 抑菌粗提物的穩定性分析
1)熱穩定性測定采用無菌水配制2 mL 質量濃度為1 000 μg/mL 的抑菌粗提物, 過濾除菌后置于40、60、80、100 ℃的水浴鍋中分別處理 30 min 和 60 min, 將處理后的抑菌溶液采用牛津杯法檢測其抑菌圈大小,按照下述公式計算抑菌率,加入等體積的無菌水為對照,重復3 次,確定抑菌活性的變化。
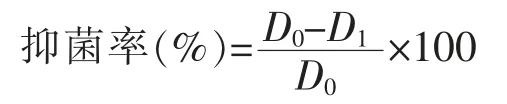
式中:D0為加入無菌水的菌落直徑,mm;D1為加入抑菌粗提物的菌落直徑,mm。
2)儲存穩定性測定按照上述方法配制抗菌粗提物,并在室內環境分別保存 5、10、15、20 d,采用牛津杯法檢測其抑菌圈大小,計算抑菌率確定抑菌活性的變化。
1.3.7 SG17 抑菌粗提物對黃曲霉孢子萌發的抑制分析 參考文獻[12]的方法,取1.5 mL 無菌離心管,分別加入不同質量濃度的抑菌粗提物和黃曲霉孢子,每管中孢子終濃度為2×105CFU/mL,粗提物的最終質量濃度分別為:1 000、500、200、100、50、20、10 μg/mL,以同體積無菌水為對照。 將各管放置在30 ℃恒溫培養箱中孵育 3 d 后, 分別取 100 μL 混合菌液,均勻涂布于PDA 培養基,28 ℃培養2 d,重復3 次,觀察孢子萌發結果。
1.3.8 SG17 抑菌粗提物對玉米黃曲霉的抑制分析挑選顆粒飽滿、 大小均勻的玉米粒, 用體積分數75%的乙醇浸泡處理1 min,再用質量分數1%的次氯酸鈉溶液浸泡處理1 min, 最后用體積分數75%乙醇浸泡處理1 min,無菌水清洗3 次。 將處理后的玉米粒放入無菌培養皿中,每個約20 粒,加入1 mL濃度為2×105CFU/mL 的黃曲霉孢子懸液, 搖勻至玉米表面微干, 再加入1 mL 質量濃度分別為200、100、50 g/mL 的抑菌粗提物, 空白對照加入等體積的無菌水,搖勻后,30 ℃恒溫培養箱中培養,重復3次,觀察玉米上黃曲霉的生長狀況。
1.3.9 數據統計分析 采用SPSS 17.0 軟件進行統計分析, 實驗結果中數據為3 個平行樣品平均值,并用平均數±標準差表示。 組間的差異性分析采用one-way ANOVA 方法,其中P<0.05 表示差異顯著。圖中分別以數值和誤差棒表示, 采用Origin Lab 2017 繪圖分析。
2 結果與討論
2.1 菌株SG17 的形態觀察結果
將菌株SG17 接種于PDA 培養基培養5 d。 如圖1 所示,菌落具有質地致密,表面呈較緊密的絨狀,干燥,多皺,菌落不蔓延,近規則的圓形,微隆起等特征。 在顯微鏡下觀察,氣生菌絲發育良好,多分枝,纏繞較緊密,不形成橫隔;基內菌絲有隔膜,較易斷裂,略短,致密,多分枝,菌絲較平直,基本符合鏈霉菌屬的形態特征。
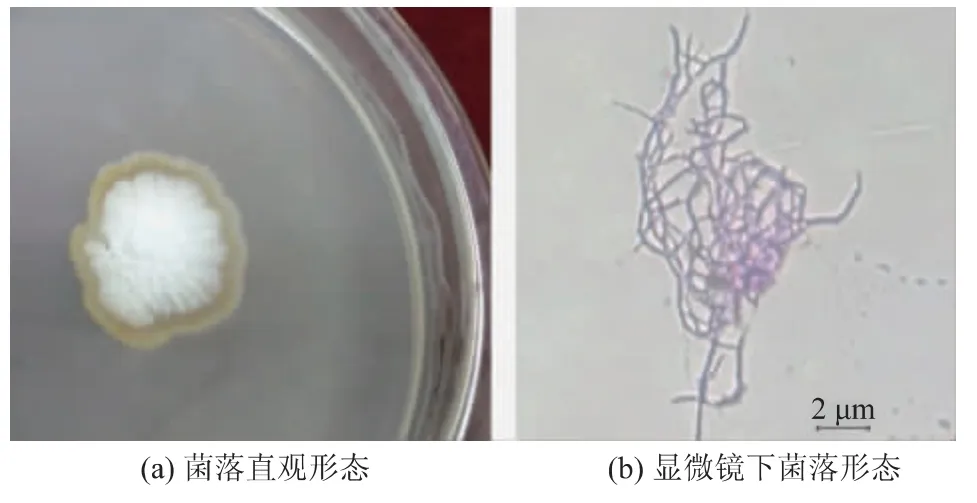
圖1 SG17 菌株的形態特征Fig. 1 Morphological characteristics of strain SG17
2.2 SG17 的培養及生理生化特征
菌株SG17 在5 種培養基上生長的結果見表1,菌株生長較好,氣生菌絲發達,基內菌絲豐富,氣生菌絲顏色從白色到黃色,基內菌絲顏色從褐色到黃褐色。 在伊莫松和營養瓊脂培養基上菌落較大,柴納斯培養基次之,在高氏一號和葡萄糖酵母膏培養基上菌落較小,且在葡萄糖酵母膏培養基上長勢最好,培養3 d 首先出現肉眼可見菌落。在伊莫松培養基上菌落呈顆粒狀,在葡萄糖酵母膏培養基上為絨狀,其余均為表面光滑,且伊莫松和葡萄糖酵母培養基上菌落有明顯突起。 在高氏一號培養基上產生黑褐色色素,其余的產生褐色可溶性色素。 根據菌落特征觀察,該菌株具有鏈霉菌屬的特征。
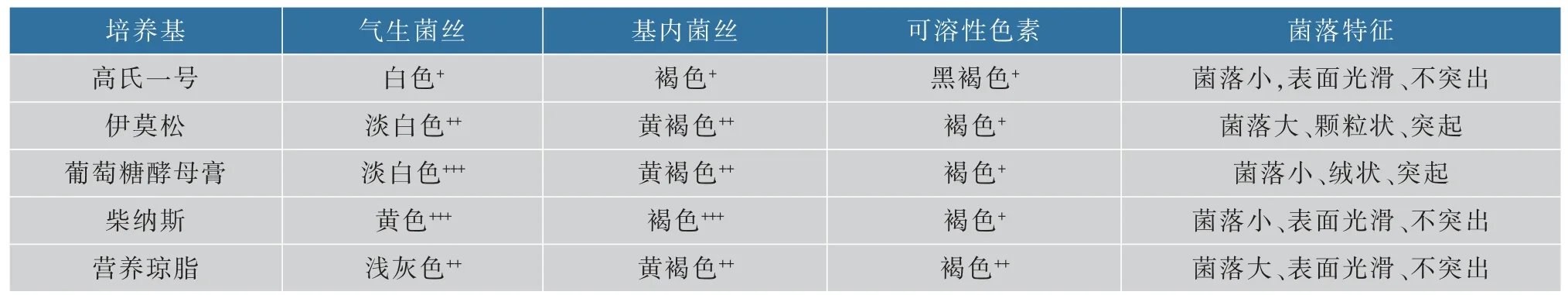
表1 菌株SG17 的培養特征Table 1 Cultural characteristics of SG17
生理生化鑒定結果見表2,菌株SG17 可以使明膠液化,產生淀粉酶,具有酪氨酸酶活性;產生H2S,使牛奶凝固與胨化,但是不能分解纖維素;并且能較好地利用葡萄糖、麥芽糖、蔗糖、肌醇和乳糖等多種碳源。 根據上述的生理生化實驗,該菌株具有鏈霉菌的特征,初步鑒定SG17 為鏈霉菌屬。
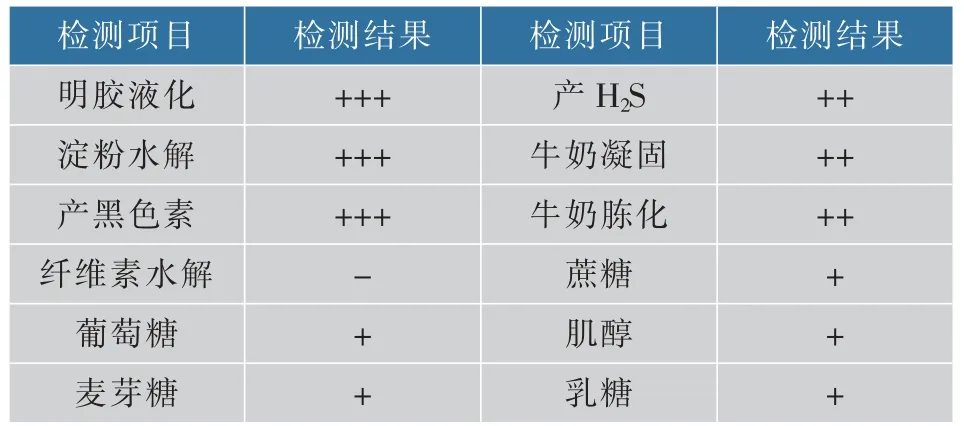
表2 菌株SG17 的生理生化特征Table 2 Physiological and biochemical properties of SG17
2.3 16S rRNA 序列分析結果
菌株SG17 的16S rRNA 序列擴增結果見圖2。將測序后的片段與GenBank 數據庫中的序列進行對比, 同源性較高的菌株均屬于鏈霉菌屬。 選取7株與目標序列相似性高的菌株, 利用MEGA6.0 軟件通過鄰近法構建系統發育樹(見圖3)。 結果表明SG17 菌株與 Streptomyces sp. JXJ 0089 KP193140.1菌株的親緣關系最近, 處于同一分支, 相似度為98%。 結合顯微觀察、培養特征和生理生化特征,初步確定為鏈霉菌屬。 最終的分類還需通過該菌株與其他已報道的相似菌株之間的核酸雜交實驗進行分析。
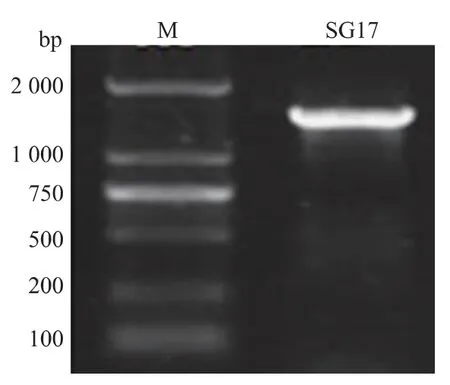
圖2 SG17 菌株16S rRNA 擴增結果Fig. 2 Electrophoresis result of 16S rRNA

圖3 菌株SG17 的系統發育樹Fig. 3 Phylogenetic tree of SG17
2.4 菌株SG17 的抑菌譜分析
由圖4 可知, 菌株SG17 對4 種病原真菌均有較強的抑制作用,抑制率在50%以上。圖4(e)是SG17發酵液抑制黃曲霉菌的結果, 抑菌圈直徑約為38 mm,證明菌株SG17 發酵液能夠顯著抑制黃曲霉菌的生長。 鏈霉菌屬于放線菌,在土壤、海洋中分布廣泛。 目前已經應用的天然活性物質中有70%~80%來自鏈霉菌,具有抗病原細菌、抗病原真菌、抗寄生蟲、抗腫瘤等作用[13]。劉春靜等從土壤中分離一株鏈霉菌TD-1, 其代謝產物對構巢曲霉、(Aspergillus nidulans)、純綠青霉(Penicillium verrucosum)、赭曲霉(Aspergillus ochraceus) 、黃曲霉(Aspergillus flavus)、黑曲霉(Aspergillus niger)等污染糧食作物的病原真菌均具有明顯的抑制活性[14]。 SG17 同屬于土壤源鏈霉菌, 能夠顯著抑制4 種病原真菌的生長,具有一定的廣譜性,并且產生的抑菌活性物質在發酵液中,初步確定為胞外物質。
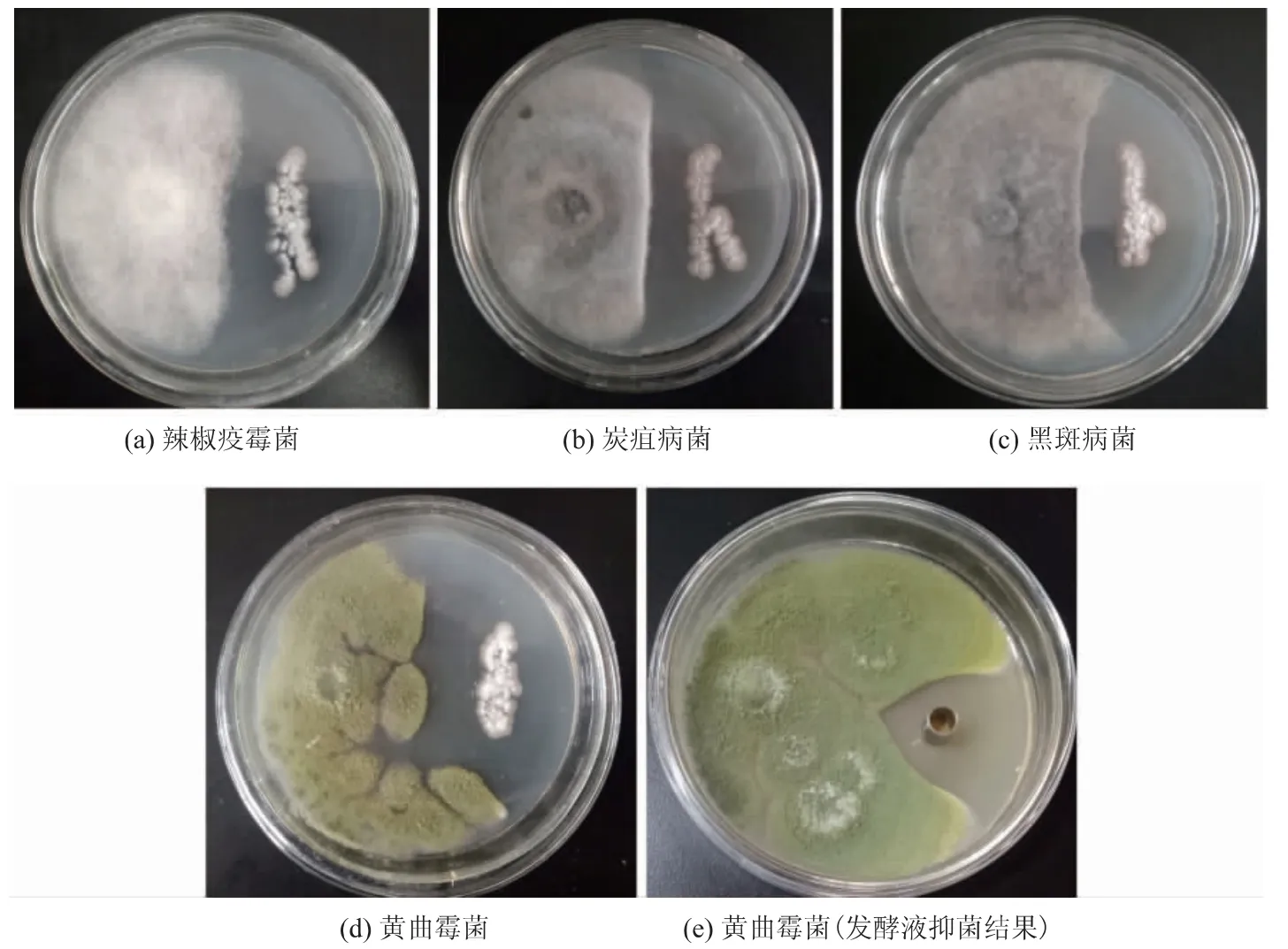
圖4 SG17 菌株及其發酵液的抑菌活性Fig. 4 Inhibition effect of strain and fermentation filtrate of SG17
2.5 SG17 抑菌粗提物的穩定性分析
目前,利用微生物次級代謝產物制備生物抑菌劑的研究很多,而實際產品很少,其主要原因在于發酵產生的抑菌物質對環境耐受性差,制約了其應用。 該研究中,SG17 抑菌粗提物對玉米黃曲霉病原菌的抑制率隨著溫度升高呈現下降趨勢,但仍保持在40%以上。 如圖5 所示,40 ℃處理后的抑菌率與對照無顯著差異,60、80、100 ℃處理 30 min 后,抑菌率分別為 (47.81±0.07)%、(46.75.81±0.31)%、(41.36±0.37)%,顯著低于對照組(P<0.05),而 100℃處理60 min 與30 min 的抑菌率無顯著差異。 周啟升等分離的S24 菌株,其抗菌物質經100 ℃水浴20 min 處理后效價無顯著變化, 加熱到100 min 效價降低18.18%, 證明該活性物質對熱比較穩定,具有潛在的應用價值[12]。 相似地,SG17 抑菌物質在100 ℃條件下處理60 min,其抑菌率降低了16%,且30 min 和60 min 處理后抑菌率無顯著差異, 證明SG17 產生的抑菌物質中,主要活性成分具有較好的熱穩定性。
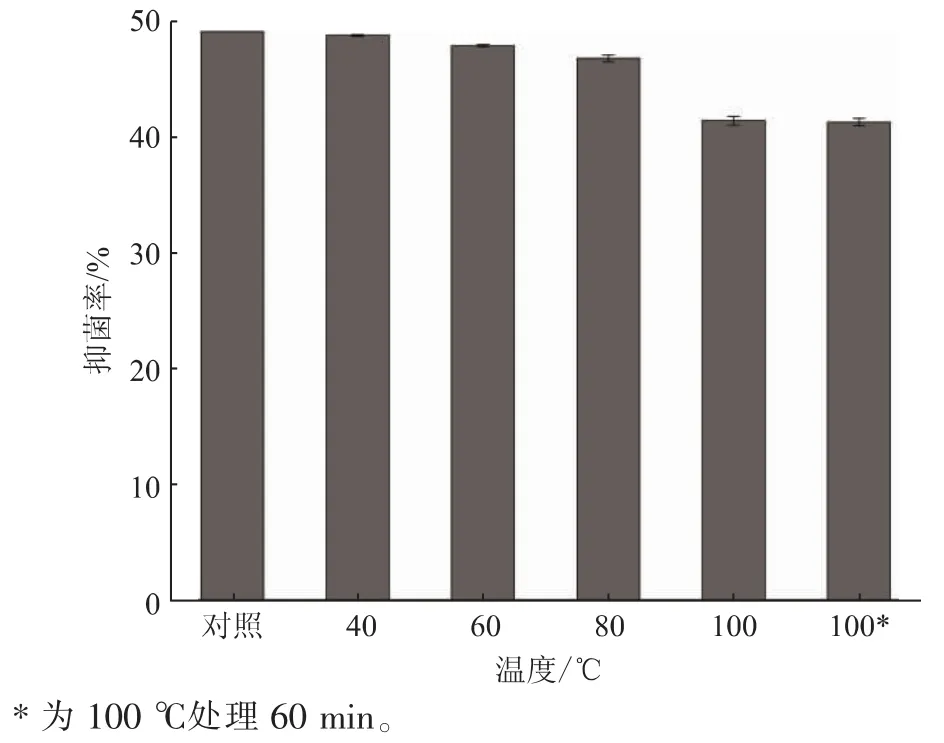
圖5 SG17 抑菌物質的熱穩定性結果Fig. 5 Thermal stability of antifungal active substances of SG17
存放穩定性的結果見圖6,放置15 d 的抑菌率為(25.95±0.68)%,顯著低于對照組(P<0.05),而放置 20 d 的抑菌率僅為(3.64±0.31)%,已無明顯的抑菌作用。 而劉春靜等獲得的一株鏈霉菌TD-1,其發酵產物在不同溫度條件下抑菌活性均高于未處理的對照組,且保存20 d 抑菌活性不變。 而SG17 的抑菌粗提物在室內分別放置15、20 d, 其抑菌率顯著低于對照組,其原因可能是菌種差異導致的。
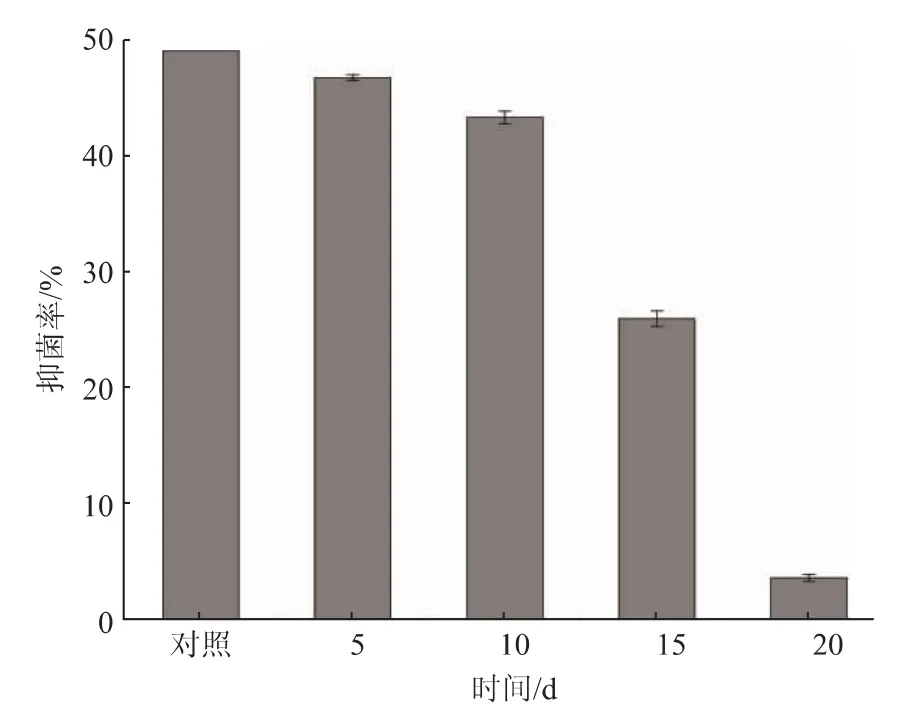
圖6 保存時間對SG17 抑菌物質的影響Fig.6 Effects of storage time on antifungal active substances of SG17
2.6 SG17 抑菌粗提物對玉米黃曲霉的抑制結果分析
對比不同質量濃度抑菌物質對黃曲霉孢子萌發的影響見圖7。 加入20 μg/mL 抑菌物質的平板上,菌落數顯著低于對照組,抑制效果比較明顯。 加入50 μg/mL 抑菌物質的混合菌液平板上, 沒有肉眼可見的菌落萌發, 說明50 μg/mL 的抑菌物質粗提液可以有效抑制黃曲霉孢子的萌發。
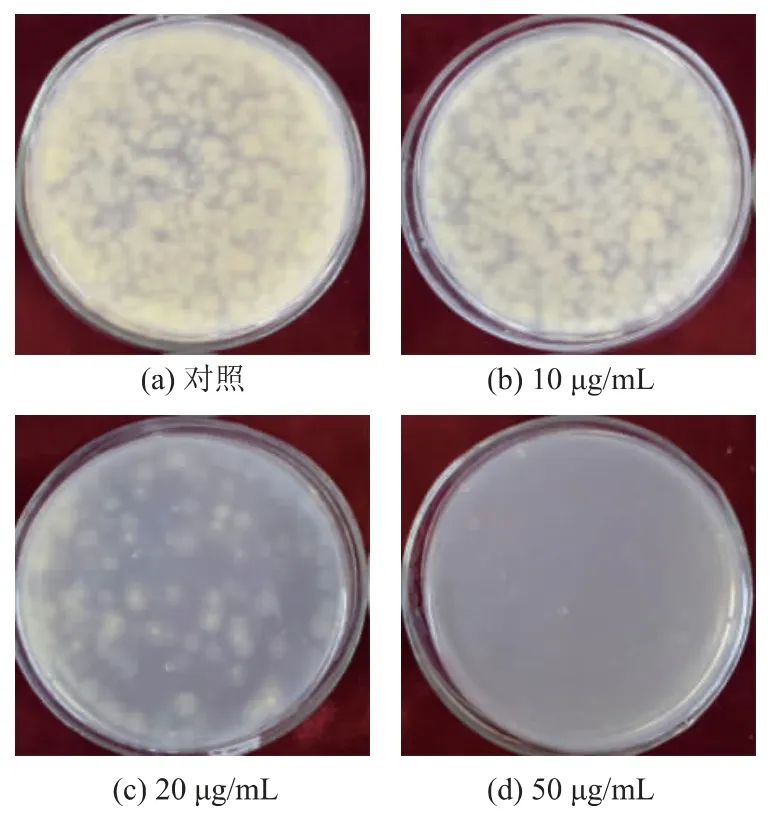
圖7 SG17 抑菌物質對黃曲霉孢子萌發的影響Fig. 7 Effects of SG17 antibacterial substances on the spore germination of Aspergillus flavus
以往圍繞黃曲霉污染的生物防治及其抑菌活性研究主要通過培養基平板對峙實驗完成[15-16]。 為了分析SG17 的實際應用價值, 在平板對峙實驗的基礎上,將抑菌粗提液直接加入黃曲霉處理的玉米中進行培養,結果見圖8。 加入50 μg/mL 抑菌物質的玉米上僅有6 粒玉米有明顯的黃曲霉菌生長,加入100 μg/mL 抑菌物質的玉米上未見到明顯的黃曲霉菌。繼續培養至14 d,100 μg/mL 抑菌物質處理的玉米上有3 粒出現黃曲霉菌生長,抑菌率為80%以上,這與穩定性研究的結果一致(見圖6)。 因此,SG17 抑菌物質在玉米黃曲霉污染防治方面具有廣泛的應用潛力。

圖8 SG17 抑菌物質對玉米黃曲霉的抑制作用Fig. 8 Inhibition effects of SG17 antibacterial substances on Aspergillus flavus in corn
3 結 語
目前,黃曲霉污染仍然是全球玉米作物在飼料及其他深加工領域應用的主要問題之一。 研究表明,各種細菌、放線菌、真菌等均有抑制黃曲霉生長的作用。 且具有不破壞營養成分、環境友好等特點。通過篩選對黃曲霉菌生長有顯著抑制作用的微生物及其代謝產物制備生物抑菌劑, 從源頭進行防治,具有廣泛的應用價值。 作者從洛陽本地畜禽養殖場動物糞便堆積區的土壤中篩選獲得多種對黃曲霉有抑制活性的菌株, 其中SG17 菌株的抑菌活性最強。 通過形態學觀察、培養鑒定、生理生化檢測及16S rRNA 序列對比分析,初步確定為鏈霉菌屬。進一步研究表明SG17 產生的抑菌活性物質具有較好的熱穩定性和環境適應性,并能有效抑制玉米黃曲霉的污染。
而作者僅對SG17 發酵液中的抑菌成分進行了簡單提取和濃縮,在粗提物中是否存在其他風險物質,仍不確定。 因此,下一步的研究重點在于發酵液粗提物中直接抑菌物質的分離提取,進而制備抑菌劑用于黃曲霉的生物防治。 目前作者所在課題組已經完成了發酵條件優化的工作, 正在對SG17 菌株發酵液中直接抑菌物質進行分離純化和結構解析,這將進一步擴大該菌株及其代謝產物在糧食特別是玉米中對于黃曲霉防治方面的應用。

