如何控制術后炎性腸梗阻的“蝴蝶效應”
——以腸瘺術后為例探討
張玉亮,龔冠聞,江志偉
作者單位:南京中醫藥大學附屬醫院普外科,江蘇 南京210000
腸道手術病人術后腸梗阻發生原因復雜,目前大量研究表明腸道的手術創傷及機體炎癥反應是導致術后腸梗阻的主要原因[1-4]。術后早期腸梗阻發生率在5%左右[5],其中炎性腸梗阻占90%[6-7],由此可見腸道手術后腸梗阻主要以炎性腸梗阻為主。根據目前的治療共識[8],盡管術后早期炎性腸梗阻經過對癥治療有效,然而仍然有部分病人治療過程中存在病情進一步加重的可能,甚至危及其生命。如何避免術后炎性腸梗阻進行性加重,以及怎樣規范治療術后進行性加重炎性腸梗阻,尚需要進一步研究。本研究通過分析1例腸瘺術后進行性加重炎性腸梗阻病人的治療過程,為該種疾病進一步的規范治療及病情評估提供參考依據。具體情況報告如下。
1 資料與方法
1.1 一般資料男,77 歲,身高171 cm,體質量55 kg,體質量指數(BMI)18.8 kg/m2,腹壁結腸造口停止排氣、排便20 d。病人于2019 年3 月19 日在全麻下行腹腔鏡輔助直腸癌腹會陰聯合切除術,術后病理診斷為直腸潰瘍型管狀腺癌,病理分期為T3N0M0。病人術后行6 次化學治療,其中1 次同步放化療。2020 年5 月于外院復查發現肝轉移,進而行單抗化療(具體療程及用藥不詳),化療過程順利,復查磁共振檢查(MR)肝內轉移灶體積未見明顯減小,后改用口服靶向藥物治療。2020 年8 月24 日因腹部疼痛及肛門部腫痛不適,病人于外院就診,考慮小腸瘺,予沖洗引流保守治療。因保守治療效果不佳,遂于2020年9月27日行膿腫沖洗切開引流術+末端回腸部分切除吻合術,術后予以消炎、抗感染、止血等對癥治療。2020 年10 月11 日出現腹脹、無排氣排便,腹部手術切口持續滲出淡黃色樣液體,予以復查腹部CT 提示:(1)直腸術后,腹壁造瘺術后;骶前軟組織腫脹;部分小腸擴張積液,腸壁稍增厚;(2)肝臟多枚低密度灶,考慮部分轉移瘤、部分囊腫可能。考慮病人術后繼發腸梗阻,遂予抗感染、胃腸減壓、營養支持等對癥治療。雖經積極治療,病情未見好轉,反而進一步加重。病人于2020 年11月3日轉入南京中醫藥大學附屬醫院普外科進一步治療。病人入院時意識清楚,精神萎靡,腹脹比較明顯,偶有腹痛,無發熱,近期體質量下降約5 kg。
1.2 治療方案基礎治療:禁食禁飲,維持水電解質平衡,輸入白蛋白維持蛋白在正常范圍,根據病情需要連續使用抗生素6 d,同時常規使用生長抑素及抑酸護胃治療。聯合使用激素短期治療,每日靜脈輸入一次甲潑尼龍40 mg,連續使用4 d。營養治療:病人接受中心靜脈導管輸入全腸外營養支持治療,每天輸注時間持續18~20 h。腸外營養方案為碳水化合物3.2 g·kg?1·d?1,氮量0.2 g·kg?1·d?1,脂肪乳1 g·kg?1·d?1,糖與胰島素比為5∶1,ω-3 魚油脂肪乳10 g,谷氨酰胺20 g,并補充維生素、水、電解質和微量元素等。腸道減壓治療:胃鏡下將經鼻型小腸梗阻導管插入胃部,通過導管中的導絲引導將導管遠端盡可能推送到擴張明顯的腸管處,導管盡量推向小腸遠端,使用注射器向導管末端前氣囊注入約10 mL 生理鹽水。在確定導管放置位置后,緩慢拉出管中導絲,留置在鼻腔外面的導管松弛,鼻外緣處導管暫不固定,導管外接負壓吸引引流胃腸道的積氣、積液。小腸導管可由腸管蠕動慢慢到達梗阻遠端,讓病人適當活動促進導管推送,告知病人在活動的過程中注意保護導管,避免牽拉脫位。
1.3 觀察指標觀察記錄病人每日導管引流出的液體及氣體量、腹脹情況、通氣情況、排便情況;采用流式細胞儀測定T淋巴細胞亞群CD3+、CD4+、CD8+細胞、CD4+/CD8+比值;采用酶聯免疫吸附測定檢測血清炎性因子白介素(IL)-1b、IL-2、IL-6、IL-8、IL-10、腫瘤壞死因子α(TNF-α)水平;記錄治療過程中白細胞、中性粒細胞、淋巴細胞、超敏C 反應蛋白(hs-CRP)、總蛋白、白蛋白、前白蛋白的指標變化;觀察治療過程中腹部CT檢查影像學變化。
2 結果
2.1 臨床療效變化病人在入院治療15 d 后腸道功能明顯改善,11月20日造口排氣,11月21日恢復少量飲水,11 月28 日拔出小腸梗阻導管,并在拔出小腸梗阻導管的當天恢復腸內營養,11月30日停用腸外營養后恢復半流質飲食,并以腸內營養粉為輔助營養,于12 月3 日恢復正常飲食痊愈出院。根據護理觀察記錄小腸梗阻導管引流情況,導管置入第1~4天主要以大量氣體為主,從第5天開始以引流液為主,到第12 天引流量達到最高值,此后引流量逐漸下降,見圖1。
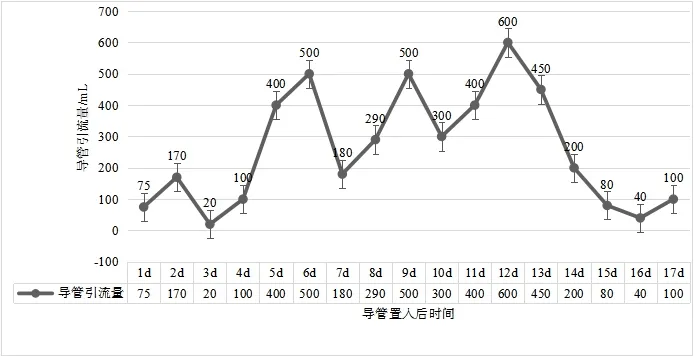
圖1 腸瘺術后進行性加重炎性腸梗阻導管置入治療過程中引流量變化情況
2.2 治療過程中炎性指標、營養指標變化病人在入院治療后第3 天,白細胞計數及中性粒細胞計數降低,并逐漸平穩在正常指標范圍;白細胞及中性粒細胞計數較治療前輕微降低,淋巴細胞計數較治療前增加,見圖2。hs-CRP 在治療過程中階梯式顯著下降,在治療后第14 天指標恢復正常,見圖3。IL-6 的水平較治療前明顯降低,IL-1b、IL-2、IL-8、IL-10、TNF-α 指標水平治療前后無明顯改變;CD3+、CD4+T 淋巴計數較治療前明顯升高,CD8+T 淋巴細胞恢復在正常范圍。見表1。治療后總蛋白、白蛋白逐漸恢復并維持在正常范圍,前白蛋白在治療過程中遞進式顯著增加,見表2。
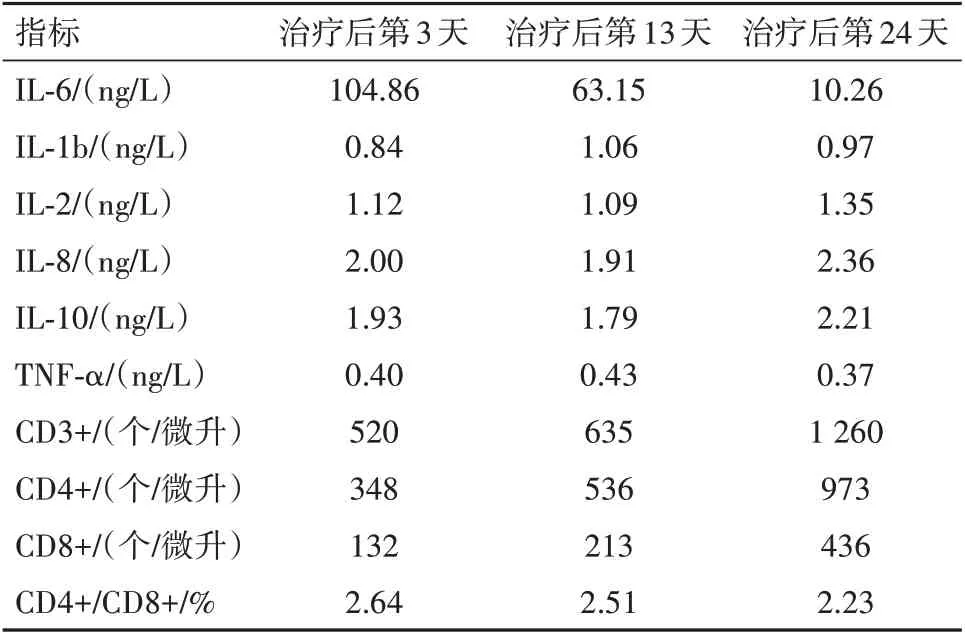
表1 腸瘺術后進行性加重炎性腸梗阻治療過程中細胞因子、免疫指標變化情況/(g/L)
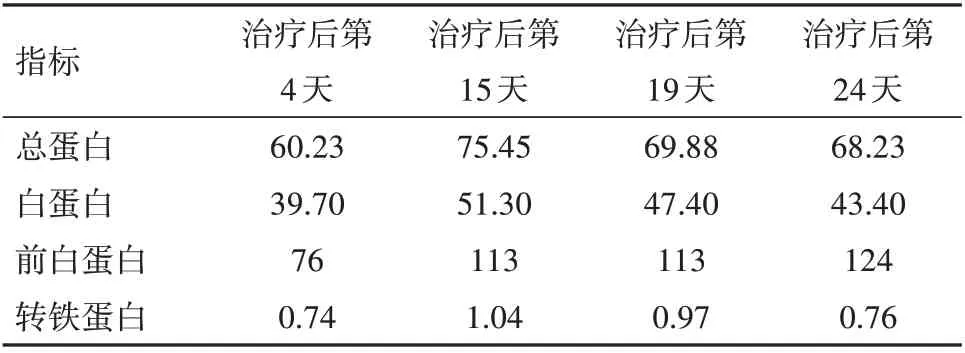
表2 腸瘺術后進行性加重炎性腸梗阻治療過程中營養指標變化情況/(g/L)
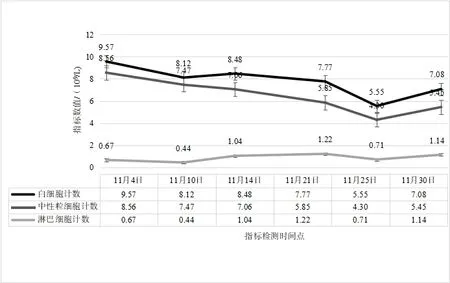
圖2 腸瘺術后進行性加重炎性腸梗阻療程中白細胞、中性粒細胞及淋巴細胞計數變化情況
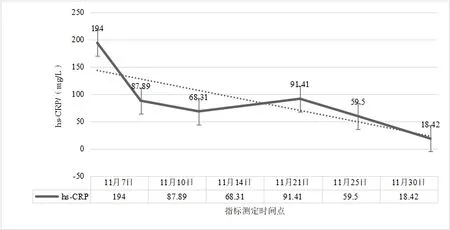
圖3 腸瘺術后進行性加重炎性腸梗阻超敏C反應蛋白(hs-CRP)水平在治療過程中變化情況
2.3 腹部CT 檢查圖像變化2020 年11 月9 日腹部CT 檢查提示直腸癌術后改變,中下腹壁皮下積氣、積液,考慮感染可能,腹部腸管擴張伴氣液平、盆腔積液,考慮腸梗阻;11月18日復查CT檢查提示直腸癌術后改變,較2020 年11 月9 日片相仿,腸梗阻較前有所好轉,盆腔積液較前減少;12月3日腹部CT 檢查顯示腹部腸管擴張伴氣液平較治療前明顯好轉,盆腔少量積液。
3 討論
3.1 術后炎性腸梗阻與損傷、炎癥術后炎性炎性腸梗阻多發生在各種腹部手術之后,發生時間多在2 周之內[9],部分病人甚至可能在術后1 月之后發病[10]。術后炎性腸梗阻發病最主要原因與手術直接相關,尤其胃腸道相關手術的損傷是直接誘發因素。首先,手術的損傷是發病的基礎,腸壁的損傷勢必會直接造成結構的改變,從而引起功能的改變[11]。由于手術所致腸壁黏膜受損、術中附近組織破壞、術中壞死組織殘留等因素,從而引起損傷部位的炎癥發生、繼發腹腔內炎癥反應,進一步造成腸壁廣泛水腫、炎性滲出而促使炎性腸梗阻發生的可能[12-13]。術后炎性腸梗阻一般是無菌性炎癥表現,部分合并腹腔細菌感染,如果治療方案精準,大部分術后炎性腸梗阻經過保守對癥治療可痊愈。為什么部分手術后病人會發生炎性腸梗阻?因為醫療技術水平的差異,總有部分病人術后發生炎性腸梗阻,甚至在治療過程中病情進一步加重,腸道梗阻廣泛擴張加重腹腔壓力升高、甚至腸壁壞死穿孔,進而腹腔感染誘發膿毒癥,以致危及生命。因此,及時有效的治療手段是挽救術后炎性腸梗阻病人的關鍵。控制炎癥進一步加重是前提,應根據病人不同炎癥反應狀況,給予針對性控制炎癥反應治療。本例病人是腸瘺術后所致,本身合并腹腔感染,根據病情的需要,在治療早期給予抗生素抗感染、甲潑尼龍抗炎,這樣有助于快速有效的控制炎癥。抗生素在使用6 d 后,根據病人體征及復查結果,予以及時停用,持續長時間使用抗生素對治療意義不大,反而可能有害。糖皮質激素能快速有效的控制炎癥反應[14-15],使用甲潑尼龍明顯改善術后炎性腸梗阻病情,但是長時間使用可能會造成免疫抑制、增加吻合口瘺等風險[16]。根據目前相關研究及本例病人治療特點,甲潑尼松短期使用對促進病人康復是有積極意義的,對于炎性梗阻較重的病人是否能延長使用時間,從而得到更多的益處,則需要進一步臨床論證。血清hs-CRP 水平的變化可以反映機體炎癥情況;機體活化的單核巨噬細胞能合成和分泌大量炎性因子,這些炎性因子大量的釋放進一步加重機體炎癥反應,從而加重病人病情[17]。在治療過程中,病人白細胞及中性粒細胞計數有所降低,并維持在正常范圍之內波動。然而,病人血清hs-CRP 及IL-6的水平較治療前逐漸顯著降低,這表明hs-CRP 和IL-6 的指標變化與術后炎性腸梗阻改善有密切相關性,且反映炎癥變化敏感性較強。IL-1b、IL-2、IL-8、IL-10、TNF-α 在治療過程中未見明顯改變,雖然有研究表明TNF-α 在兒童術后炎性腸梗阻的治療過程中有所降低[18]。
3.2 術后炎性腸梗阻與腸腔壓力炎性腸梗阻如梗阻未能有效控制,病人腸腔會進一步積氣、積液,加重腸腔擴張,腸道擴張水腫以致炎癥反應加重,促進腸腔又進一步積液、積氣,從而形成惡性循環,腸梗阻病情進一步加重。因此,腸腔壓力的大小變化可以直接反映腸道梗阻癥狀是否得到有效控制,及時地減輕腸腔壓力是治療梗阻的重要措施。本例病人在保守治療1個月過程中,病情逐漸加重,入院后予以復查CT 檢查提示小腸明顯擴張,大量積氣、積液。根據此前的治療結果分析,目前簡單的胃腸減壓治療對緩解腸腔壓力作用微乎其微,予以及時行小腸梗阻導管置入至小腸梗阻腸腔,從而可以快速減輕腸道壓力、減輕腸道水腫、降低炎性滲出,進一步減輕病變部位炎癥反應[19]。病人在小腸導管置入后前5 d,導管引流主要以氣體為主,考慮導管尚未進一步深入所致。隨著導管進一步到達梗阻部位,液體引流量明顯增加,并且達到峰值。在接下來治療過程中,隨著病情的改善,導管引流量呈波浪形進行性下降。隨著腸梗阻導管引流量的持續降低,病人的癥狀明顯改善,治療過程中復查腹部CT檢查提示腸道擴張顯著改善。因此,在炎性腸梗阻常規減壓治療而未見好轉的情況下,可考慮及時更換腸道減壓治療方式,由于腸腔壓力不能及時控制,單純的抗炎、使用生長抑素減少腸液分泌等常規治療,并不能控制病人病情,反而病情可能呈現波浪式進行性加重,以致延誤病人治療。雖然有研究表明腸梗阻導管置入對老年胃腸腫瘤病人術后早期炎性腸梗阻治療效果確切[20],但是腸梗阻導管置入的最佳治療時機該如何選擇,目前尚未有具體標準。如果考慮腸梗阻導管治療方式優于常規的胃腸減壓治療,那么所有的炎性腸梗阻病人都采取這種治療方式,可能會給部分病人增加經濟負擔和治療不適,因為有部分早期炎性腸梗阻病人常規胃腸減壓治療也可治愈。如何制定腸梗阻導管置入標準、如何選擇最佳治療時機,到達“合理”“及時”的治療效果,將是今后進一步的研究方向。
3.3 術后炎性腸梗阻與營養營養支持治療對術后炎性腸梗阻病人治療尤為重要,機體營養攝入依靠腸內或腸外營養,因病人腸道梗阻,暫不能腸內營養,維持機體營養代謝平衡主要依靠腸外營養。腸外營養不僅能基本維持病人機體營養狀況、電解質平衡,而且減輕腸腔負擔,可以影響機體消化液的分泌,進一步減輕腸道壓力,間接改善腸道擴張,能有效抑制腸壁周圍炎癥反應,這有利于促進術后炎性腸梗阻病人腸道功能盡快恢復正常狀態[21]。腸外營養不僅要滿足機體穩定劑能量代謝的需要,而且要充分合理使用減輕炎癥反應、保護腸道黏膜的營養制劑,目前常用的減輕炎癥反應及保護腸黏膜屏障的藥物是魚油脂肪乳和谷氨酰胺。研究表明魚油脂肪乳劑可明顯降低胃腸腫瘤術后炎癥反應、增強免疫,因此在術后炎性腸梗阻病人腸外營養中合理添加魚油脂肪乳,可能對減輕腸道炎癥反應有積極作用。因此在本例病人腸外營養配置中,合理使用了魚油脂肪乳劑及谷氨酰胺,這樣可以起到減輕炎癥、增強免疫和保護腸黏膜功能的協同加強作用[22-23]。病人在治療過程中,白蛋白水平升高并逐漸穩定,血清前白蛋白進行性升高,同時淋巴細胞計數、CD3+、CD4+T 淋巴計數較治療前明顯升高,這表明營養功能改善的同時,機體免疫功能也得到明顯改善。免疫功能的增強不僅能增加機體抵抗力,而且還能促進炎癥反應的降低,進而可減少機體營養物質分解,體現了營養、免疫及炎癥反應三者相互協同作用。
綜上所述,根據本例病人治療過程的療效分析,表明了在術后炎性腸梗阻治療過程中,有效的控制炎癥反應、合理的營養支持、及時的腸腔減壓如同“三駕馬車”并駕齊驅,同時又相互影響。這“三駕馬車”如果使用不當,那么就很可能控制不了“蝴蝶的翅膀”,進而發生對預后嚴重不良影響的“蝴蝶效應”,例如術后進行性加重炎性腸梗阻的發生。hs-CRP 和IL-6 的指標變化可考慮作為術后炎性腸梗阻不良“蝴蝶效應”的重要觀察指標,從而能夠有效的評估病情變化,及時指導更改治療方案,但需要今后進一步大量的臨床病例研究驗證。

