肌肽對血管平滑肌細胞鈣化的影響及機制研究
金朝霞, 徐成勝
(長江大學附屬黃岡市中心醫院心內科, 湖北 黃岡 438000)
血管鈣化(vascular calcification)是慢性腎病和慢性心血管疾病共同的顯著病理改變,也是這類疾病的致病基礎之一。羥基磷灰石(又稱羥磷灰石、堿式磷酸鈣異位沉積于血管壁為其病理特征[1]。血管鈣化是密切相關于心血管疾病發病率和死亡率增高的危險因素,發病于80%的血管損傷患者和90%的冠狀動脈患者中[2]。血管平滑肌細胞(vascular smooth muscle cell,VSMCs)在生長因子、機械應激損傷下,從正常的收縮表型向成骨和軟骨表型的分化在血管鈣化中發揮關鍵作用[3]。由于血管鈣化機制尚未明確,目前有關預防和治療血管鈣化的藥物或方法未得到批準,研發和臨床的血管鈣化防治目標仍面臨長期的探索。肌肽(β-丙酰胺-L-組氨酸)是一種內源性二肽,在體內發揮多種生物效應,包括抗炎、抗氧化、抗糖基化、螯合金屬離子、促進傷口愈合等,而炎癥、氧化應激、糖基化等病理過程都是血管鈣化發生發展的誘導因素。然而,肌肽在血管內的生理角色尚不清楚,以及肌肽能否抑制血管鈣化。本研究基于血管平滑肌細胞在體外由高磷誘導成骨向分化為基礎,研究肌肽對血管鈣化的影響。
1 資料與方法
1.1試劑與儀器:試劑:β-磷酸甘油(G9422)和肌肽(C9625)均購于Sigma;α-SMA抗體(博士德 BM0002);β-catenin(51067-2-AP)、BMP-2(18933-1-AP)和Runx2(20700-1-AP)均購于Proteintech;GSK3β(Phospho-Ser9)購于Signalway(貨號11002-1);β-actin(Santa Cruz sc-47778);小鼠 IgM-SABC 免疫組化染色試劑盒(博士德 SA1026);堿性磷酸酶試劑盒(南京凱基);茜素紅S(Sigma,A5533);BCA定量試劑盒(武漢啟動子);Ⅱ型膠原酶和彈力蛋白酶均購于美國Worthington Biochemical Corporation;滅菌PBS、鏈霉素/青霉素、胎牛血清、DMEM均購于Hyclone公司。儀器:倒置顯微鏡(重慶光電儀器有限公司 XDS-1B);超凈工作臺(蘇州安泰空氣技術有限公司);CO2細胞培養箱(力新儀器有限公司 HF151UV);Sunrise A5082酶標儀(奧地利Tecan公司);NanoDrop ND-2000超微量核酸蛋白測定儀(德國Thermo 公司);Mini-PROTEAN Tetra Electrophoresis System電泳轉膜系統和Power Pac Universal電泳儀均來自美國Bio-rad公司。
1.2實驗動物:SPF級Wistar大鼠,6周齡,80~100克體重,購于華中科技大學同濟醫學院實驗動物中心,動物使用符合倫理學標準。
1.3原代VSMCs分離培養和鑒定:注射1mL 3%的戊巴比妥用以麻醉大鼠,75%酒精清潔大鼠腹部后,剪開胸腔,小心剪下大鼠胸主動脈。無菌操作下,放入滅菌PBS中沖洗血污,在體式顯微鏡下小心去除周邊脂肪和結締組織,放置于1mg/mL Ⅱ型膠原酶中,37℃消化30 min后小心剝離血管外膜;然后用彎鑷背側小心刮去血管內膜,最終獲得中層組織;將該組織用含10X雙抗的滅菌PBS沖洗三次后,放置于含20%FBS的DMEM高糖培養液中,過夜孵育。次日,將中層組織剪成1mm3大小的組織塊,加入消化液(1mg/mL Ⅱ型膠原酶、0.5mg/mL 彈力蛋白酶)酶解90min,每隔15min無菌吹打以利于細胞脫離;結束后加入等體積含20%FBS的DMEM高糖培養液,轉移到15mL離心管中,800rpm離心10 min,細胞沉淀用含20%FBS的DMEM高糖培養液重懸后接種于T25培養瓶中,置于37℃,5% CO2細胞培養箱中。每隔3d換液,直至細胞長滿瓶壁,常規傳代,取3~6代細胞用于實驗。
1.4VSMCs的平滑肌細胞鑒定:取第3代VSMCs接種于6cm培養皿中,待細胞長至80%左右密度,棄去培養基,PBS沖洗一遍后用4%多聚甲醛固定細胞,PBST沖洗三遍;經5% BSA室溫封閉20min后,經抗α-SMA一抗(1∶200)4℃雜交過夜,PBST沖洗三遍后同生物素化山羊抗小鼠IgM室溫雜交20min;最后用DAB顯色。顯微鏡下隨機選擇5個視野,計數染色陽性的細胞數量和總數量,計算陽性率。
1.5實驗分組及處理方法:取第3代VSMCs,按照1×105/孔接種于6孔板,待細胞貼壁后,更換為新鮮的培養液,并分為3組:對照組(無添加)、鈣化組(10mM β-磷酸甘油誘導)、肌肽組(10mM β-磷酸甘油誘導和10mM 肌肽干預)。所有細胞均培養于含15%FBS的高糖DMEM培養液中,置于37℃,5% CO2細胞培養箱,每隔2d換液,連續10d。
1.6茜素紅S染色:待鈣化誘導和肌肽干預10d后,棄細胞上清,4%多聚甲醛固定,超純水清洗2次后,加1%茜素紅染液(pH4.1)室溫染色10min。
1.7堿性磷酸酶活性測定:處理10d后,采用組織裂解液裂解細胞,取上清進行測定。按照說明書依次加入顯色底物、顯色劑,在酶標儀520nm處測定各組吸光值。
1.8Western blot:加入組織裂解液裂解各組細胞,提取總蛋白,用BCA定量試劑盒檢測蛋白濃度,用以計算上樣所需體積;用10%聚丙烯酰胺凝膠(SDS-PAGE)行蛋白電泳,主要參數為:恒壓80V,溴酚藍條帶進入下層膠時恒壓120V,蛋白Marker所需分子量處充分分開后,停止電泳;然后將蛋白轉移至PVDF膜,200mA恒流轉膜2h;經含5%脫脂奶粉的TBST封閉1h后,用一抗4℃雜交過夜,TBST清洗三遍后,放于二抗溶液中,室溫孵育2h;TBST清洗三遍后,最后用ECL顯影、定影。
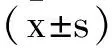
2 結 果
2.1原代大鼠VSMCs的生長狀態和鑒定:由圖1a所示,可見來源于大鼠胸主動脈的VSMCs經傳代培養后,大部分形態為梭形的貼壁細胞。低密度接種后,細胞成簇狀生長,中心區域細胞多層疊加生長,并有平滑肌細胞特有的“峰—谷”樣生長特征(圖1b)。用抗α-SMA抗體對第3代VSMCs進行平滑肌特征鑒定,免疫組化檢測發現,細胞胞漿內有棕褐色染色顆粒,證明培養細胞為VSMCs,經顯微鏡下計數后證實,99%的細胞均為VSMCs,基本沒有內膜內皮細胞和外膜成纖維細胞的污染(圖2)。

圖1 光鏡下VSMCs細胞形態

圖2 免疫組化檢測VSMCs細胞的α-SMA表達
2.2肌肽下調抑制VSMCs的成骨分化:茜素紅染料可特異性的與鈣發生顯色反應,生成紅色產物。經β-磷酸甘油的10d誘導,可見對照組VSMCs培養孔內無紅色染色,為陰性反應(圖3a);鈣化組培養孔內呈顯著陽性反應,細胞外彌漫著紅色的鈣沉積,說明VSMCs鈣化模型成功建立(圖3b);10mM肌肽干預組VSMCs的染色強度明顯下調,僅可見少量的鈣鹽沉積(圖3c)。

圖3 茜素紅染色檢測各實驗組的鈣鹽沉積
2.3肌肽對ALP活性的時間效應:如圖4所示,各組ALP活性均隨培養時間推移而上調,其中鈣化組在β-磷酸甘油誘導下,ALP活性水平上調更加明顯,在第8~10天之間,活性顯著高于對照組(P<0.05);10mM肌肽干預后,同鈣化組相比較,第4~8天時,ALP活性水平下調,但無顯著統計學差異(P>0.05),第10天時,肌肽組ALP活性顯著低于鈣化組,差異有統計學意義(P<0.05)。

圖4 生化實驗檢測培養不同時間各實驗組的ALP活性
2.4肌肽對鈣化VSMCs成骨細胞標志物表達的影響:與鈣化組相比較,10mM肌肽干預后,BMP-2和Runx2的蛋白表達均顯著下調,差異有統計學意義(P<0.05),提示肌肽可能在VSMCs向成骨細胞分化過程的后期發揮抑制作用(圖5)。

圖5 Western blot檢測各實驗組BMP-2和Runx2的表達情況
2.5肌肽對VSMCs鈣化進程中細胞凋亡的影響:Cleaved-caspase3是凋亡因子caspase3的激活狀態,如圖6所示,鈣化組Cleaved-caspase3水平較對照組上調,差異有統計學意義(P<0.05),肌肽組Cleaved-caspase3水平下調,與對照組水平接近,低于鈣化組蛋白水平,差異有統計學意義(P<0.05)。

圖6 Western blot檢測各實驗組Cleaved-caspase3的表達情況
2.6肌肽對VSMCs鈣化進程中β-catenin信號通路的影響:如圖7所示,與對照組相比較,鈣化組GSK-3β(Ser9)表達下降,β-catenin水平顯著上調(P<0.05);與鈣化組相比較,肌肽組GSK-3β(Ser9)蛋白水平顯著上調,β-catenin水平下調(P<0.05),差異有統計學意義(P<0.05)。

圖7 Western blot檢測各實驗組GSK-3β(Ser9)和β-catenin的表達情況
3 討 論
研究表明機體鈣磷代謝失衡原因造成的鈣鹽沉積結果是血管鈣化的主要病理表現,是機體冠狀動脈鈣化重要原因之一[4]。堿性磷酸酶由成骨細胞生成和分泌,是標志成骨細胞特異性成熟的標志物,而骨形態發生蛋白-2(Bone morphogenetic protein-2,BMP-2)和Runt相關轉錄因子2(Runt-related transcription factor-2,Runx2)是成骨分化過程重要標志蛋白,具有促進成骨細胞分化為骨細胞的作用,同時,二者還可以上調ALP表達[5,6]。β-磷酸甘油在細胞內堿性磷酸酶的作用下轉變為無機磷酸鹽,是平滑肌細胞鈣化的主要誘因[7]。細胞凋亡在VSMCs的鈣化進程中居于初始階段的關鍵地位,而caspase 3是細胞凋亡的特異性標志物之一,在凋亡進程中居于核心地位,是一切凋亡信號傳導的最終共同通路。Wnt信號通路可影響內皮細胞增殖、分化、遷移,調節血管的生成發育,與血管鈣化密切相關[8]。
本研究發現,鈣化組的紅色鈣沉積明顯,呈顯著陽性反應,在β-磷酸甘油刺激的4~10d內,鈣化組的堿性磷酸酶活性水平隨時間延長穩步升高,且均高于同期無處理對照組(P<0.05),表明血管平滑肌發生鈣化,而經肌肽處理后,鈣沉積明顯減少,堿性磷酸酶活性下調,提示。同時鈣化組BMP-2、Runx2水平顯著上升,肌肽干預后顯著降低(p<0.05),提示肌肽負調控高磷誘導的VSMCs體外骨向分化。鈣化組cleaved-caspase 3(caspase 3活化形式)蛋白水平上調,肌肽干預顯著下調cleaved-caspase 3的蛋白表達,提示肌肽下調的VSMCs凋亡可能參與了該細胞的成骨向表型轉化。肌肽組GSK-3β(Ser9)蛋白水平顯著上調,β-catenin水平下調(P<0.05),差異有統計學意義(P<0.05),提示肌肽抑制了Wnt信號通路。Ommati[9]等研究發現異環磷酰胺腹腔注射大鼠后,尿內堿性磷酸酶水平升高,500mg/kg肌肽的干預可顯著下調過量激發的ALP,與本研究結果相似。這表明肌肽可體外抑制大鼠血管平滑肌鈣化進程,在血管鈣化過程中發揮重要作用,其機制可能是通過抑制細胞凋亡、成骨分化及Wnt信號通路。
綜上所述,肌肽具有抑制VSMCs鈣化的保護作用,表現為通過上調GSK3β磷酸化,抑制β-catenin信號通路,進而降低骨向分化標志物蛋白表達,下調堿性磷酸酶活性和成骨細胞成熟、減少鈣沉積,同時可減少VSMCs的細胞凋亡水平。本研究為深入探討VSMCs鈣化及成骨向表型轉化的分子機制提供了實驗依據,并擴展了肌肽的新的生物效應,為其臨床應用提供新的支持。

