早產兒血清血紅素加氧酶-1與支氣管肺發育不良的關系
徐佳瑤 蔡瑞瑞 雷冰 尚利宏
支氣管肺發育不良(bronchopulmonary dysplasia, BPD)是早產兒的一種嚴重疾病,易引起早產兒早期死亡[1]。近年來,隨著圍生醫學及新生兒診療技術的進步,早產兒存活率明顯提高,然而,BPD的發病率卻居高不下[2]。目前,BPD的病因及發生機制仍不明確,缺乏確切的防治手段。血紅素加氧酶-1 ( heme oxygenase-1, HO-1 )是血紅素代謝的限速酶,在大多數組織細胞中可被氧化應激和炎癥誘導表達,而BPD的發生可能與炎癥反應相關[3]。本文通過分析早產兒血清中HO-1水平,初步探討HO-1與BPD的關系,以期早期診斷BPD并行早期干預,改善患兒預后。
資料與方法
一、研究對象
選取我院2019年01月至2019年12月胎齡≤32周、出生體重≤1500g且住院治療時間≥28 d的早產兒為研究對象,行前瞻性研究。共256例符合條件,納入研究。根據是否患BPD分為BPD組(n=66)和非BPD組(n=190);BPD組根據氧療情況分為輕度BPD組(n=38)和中/重度BPD組(n=28);從非BPD組中篩選出60例與BPD組一般情況無統計學差異的患兒作為對照組。BPD診斷及分度標準參照美國國立兒童健康和人類發展研究院對BPD的定義[4]。排除標準:(1)合并嚴重先天畸形;(2)患有遺傳代謝病或染色體病。
二、研究方法
包括收集孕母及患兒臨床資料和血標本采集及保存。孕母一般情況:如分娩方式、是否合并胎膜早破、宮內窘迫等;患兒臨床情況:如性別、體重、胎齡、是否合并新生兒窒息、氧療情況等。在早產兒出生時及生后2周留取靜脈血,離心5min,分離血清,置-80℃冰箱保存,采用酶聯免疫吸附試驗檢測BPD組與對照組血清HO-1水平。
三、統計學方法
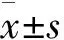
結 果
一、不同組別孕母及早產兒臨床資料比較
BPD組與非BPD組早產兒孕母剖宮產、宮內窘迫、合并妊娠期糖尿病等之間的差異均無統計學意義(P>0.05)。與非BPD組相比,BPD組平均胎齡及平均出生體重較小,合并新生兒窒息比例及RDS Ⅲ~Ⅳ級比例較高,機械通氣時間、總氧療時間及生后2周抗生素使用時間較長,差異有統計學意義(P<0.05)(見表1)。
二、早產兒血清HO-1水平比較
從非BPD組早產兒中共篩選出60例作為對照組(見表2)。出生時血清HO-1水平:BPD組與對照組相比、輕度BPD組與中/重度BPD組相比,差異均無統計學意義(P>0.05);生后2周血清HO-1水平:BPD組與對照組相比、輕度BPD組與中/重度BPD組相比,差異均有統計學意義(P<0.05)(見表3、4)。

表1 BPD組與非BPD組早產兒臨床情況比較

表2 BPD組與對照組早產兒一般情況比較
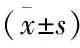
表3 BPD組與對照組HO-1水平比較
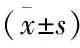
表4 BPD組內輕度組與中/重度組HO-1水平比較
討 論
BPD的發病機制尚不明確,目前認為BPD是在遺傳因素的基礎上由多種因素導致而成[5]。有研究顯示早產和低出生體重是BPD的重要危險因素[6-7]。這主要是由于出生體重低的早產兒,肺泡結構不成熟以及肺表面活性物質分泌不足,肺泡易萎陷導致功能不全,此時期早產兒必須通過長期的呼吸支持維持生命。而早產兒吸入過量氧氣產生的氧自由基會激發炎癥介質過度釋放,引起細胞損傷,導致肺泡壁破裂、肺部炎性反應,進一步導致BPD的發生。另有研究表明BPD與感染、機械通氣、氧化應激和高氧、動脈導管未閉、孕母絨毛膜羊膜炎、子癇前期等有關[7-9]。此外,研究報道分娩前羊水過少持續時間超過4天、早產兒白細胞介素-1、白細胞介素-6水平也是早產兒BPD發生的危險因素[10-11]。本研究顯示除外胎齡、出生體重及總氧療時間,窒息、RDS Ⅲ~Ⅳ級以及生后2周內抗生素使用時間與BPD的發生顯著相關。因此,臨床工作中,應在早產兒生后早期積極行呼吸支持并治療感染,但臨床情況好轉后,應盡可能縮短氧療時間及抗生素使用時間,以減少BPD的發生。
血紅素加氧酶( heme oxygenase, HO )是廣泛存在的抗氧化防御酶之一,主要降解內源性鐵原卟啉血紅素,使血紅素降解為亞鐵離子、一氧化碳和膽綠素。其有三種活性亞型,HO-1、HO-2和HO-3。HO-1,即熱休克蛋白32,是一種可誘導的血紅素加氧酶的異構體,在應激條件下可被多種刺激如感染、細胞因子、紫外線照射等激活后,表達上調[12],通過調節血紅素或其降解產物的水平,從而起到抗炎、抗氧化和免疫調節的作用[13]。而肺氧化應激性損傷在BPD的發生發展中作用顯著[14]。江曉琴等[15]學者研究發現,未完全發育的肺組織長期處于高氧條件下時,胞漿中的HO-1表達水平升高,表明HO-1與高濃度氧所致的肺損傷關系密切。另有研究表明,在機械通氣所致肺損傷家兔體內,肺損傷并未隨HO-1的表達增高而減輕,而外源性HO-1誘導劑可以上調HO-1表達并減輕家兔肺組織損傷,提示HO-1含量只有達到一定水平才能發揮其抗炎、抗氧化損傷的保護作用[16]。因此,合成和發現新的無細胞毒性的HO-1誘導劑可能是一種改善氧化損傷和炎癥反應的創新策略[17]。
然而,盡管HO-1具有眾所周知的抗炎和抗氧化作用,但當HO-1活性明顯上調時,則起到相反作用,破壞細胞膜的完整性[18],誘導細胞內不穩定的鐵積累,導致ROS的大量產生[19],Suttner等[20]研究亦證實了這一點。同時,這一效應被證明是導致LPS誘導的內毒素休克中觀察到的細胞功能障礙的原因之一[21]。本研究發現生后2周時BPD組HO-1水平明顯升高,且中/重度組較輕度組升高明顯,表明早產兒血清中高水平的HO-1可能造成了肺組織的過氧化損害,從而促進了BPD的發生發展,提示HO-1的變化可為早期輔助診斷BPD提供幫助。
綜上,早產兒生后早期血清HO-1可能參與調節BPD的發生和發展過程,對預測BPD的嚴重程度有一定的提示意義。

