阻塞型睡眠呼吸暫停綜合征動物模型豬的建立
吳茜 李莉 李紅蔚 李建國 華靜娜 王星 張東
孫祥軍 王程
參考文獻
阻塞性睡眠呼吸暫停(OSA)是一種非常普遍的是一種慢性睡眠障礙疾病,可能導致心血管疾病、高血壓、癱瘓和身體機能惡化,并影響患者生活質量[1],根據年齡和性別不同,在一般人群中發病率為3%至17%[2]。此外,OSA與肥胖密切相關,在過去的20年里,由于肥胖癥的流行,OSA的患病率大幅上升,超過60%的OSA患者存在肥胖。迄今為止國內外尚缺乏理想的、接近于臨床病理狀態的動物模型,導致其發病機制和病理生理機制研究滯后。目前常以低氧或直接在氣管內造成阻塞建立OSA模型,繞過了造成人類OSAS最重要的部位-上氣道。目前尚未見上氣道阻塞合并肥胖的OSA模型報道。本研究探索建立肥胖因素相關的有上氣道阻塞的OSA動物模型,為OSA的研究提供更符合其病理生理學特點的研究工具。
資料與方法
一、 實驗動物
巴馬豬1頭,購自天津市百農實驗動物繁育科技有限公司,雄性,體重36kg。分早、中、晚三次給予全價飼料(天津名門動物食品有限公司提供),自由飲水,飼養溫度18~26℃,濕度10%~80%。本研究經過本醫院倫理委員會批準,批準號:2019-HHXT-020。
二、 儀器
電子支氣管鏡(安保股份有限公司Ambu A/S aScope3,型號:403001000);CT(聯影CT960+);生命體征監護儀(GE Healthcare Finland Oy Kuortaneenkatu 2, Fi-00510 Helsinkin, Finland,型號:B20i)。
三、 試劑
鹽酸塞拉嗪注射液(長沙拜特生物科技研究所有限公司);丙泊酚注射液(四川國瑞藥業有限公司);咪達唑侖注射液(江蘇恩華藥業股份有限公司);碘普羅胺造影劑300(拜耳公司)。
四、 方法
1 肥胖模型的制作:給予巴馬豬全價飼料喂養,每天自由飲食。
2 阻塞性睡眠呼吸暫停模型的制作:實驗動物豬飼養肥胖后進行該操作。手術當天早晨禁食、禁水,測定體重。給予速眠新和米達唑侖以1 ∶1 0.5 mL/kg進行肌肉注射誘導麻醉。成功麻醉后建立耳緣靜脈通路,靜脈間斷推注丙泊酚用于術中維持麻醉。麻醉后將動物呈仰臥位,固定四肢,予脈搏、血氧飽和度監護。電子支氣管鏡經豬鼻腔進鏡,觀察豬聲門上及口腔各結構滿意(圖2),使用TBNA穿刺針分別于軟腭及兩側顎咽弓處注射生理鹽水與碘普羅胺造影劑混合物7.5 mL(圖3),氣管鏡觀察雙側顎咽弓隆起滿意(圖4),鏡下可見豬咽腔變窄,術中密切觀察動物狀態,防止窒息。
五、 觀察指標
觀察巴馬豬的外形,測量體重,計算肥胖指數。觀察實驗動物豬睡眠過程中呼吸暫停和低通氣的次數。電子計算機斷層掃描CT觀察頸部局部組織影像學改變。
結 果
一、 臨床結果
喂養3個月后,實驗動物豬體重增至68kg(圖1)。豬外形肥胖,頸圍粗,體重指數達到40kg/m2,睡眠過程中出現鼾聲及血氧飽和度下降,給予鹽水注射后鼾聲逐漸加重,偶可觀察到呼吸暫停。有明顯的血氧飽和度下降,最低時血氧飽和度為84%。檢測豬睡眠過程中睡眠呼吸暫停低通氣指數(apnea hypopnea index, AHI)為≥5次/h。
二、 影像學結果
在頸部注射生理鹽水4小時后應用支氣管鏡于實驗動物豬聲門上方注射生理鹽水后進行頸部CT掃描,生理鹽水注射4小時后頸部CT證實可見實驗動物豬咽腔內可見到不規則環狀陰影,咽部狹窄(圖4)。提示有氣道結構變化,局部氣道狹窄。
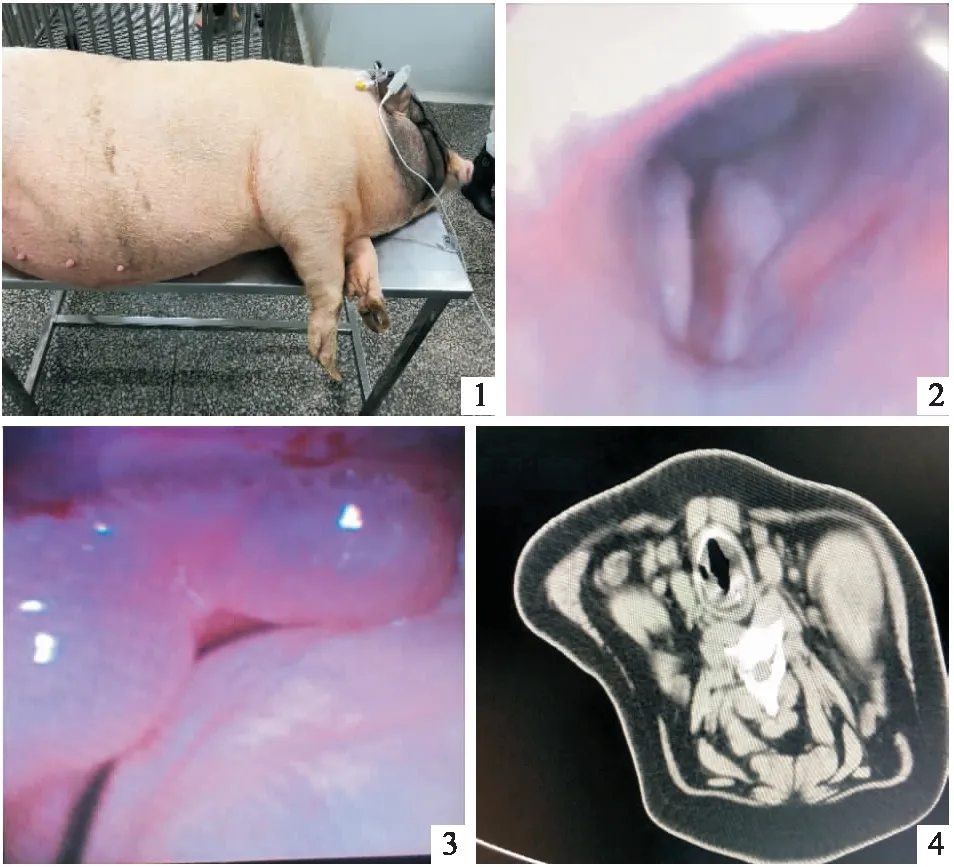
圖1 飼養后體型肥胖的實驗豬 圖2 正常聲門上結構 圖3 聲門上方注射生理鹽水后 圖4 咽腔可見不規則環狀影
討 論
阻塞性睡眠呼吸暫停是一種復雜的疾病,由多種因素引起,包括上呼吸道解剖結構改變、肥胖等。阻塞性睡眠呼吸暫停(OSA)影響了高達20%的人群,隨著肥胖達到流行病的比例,其患病率也在增加。大量研究表明,肥胖是OSA的重要危險因素,體重變化與OSA嚴重程度[3]有關。從病理生理角度來看,OSA的特征為睡眠高阻力性呼吸,導致呼吸暫停及呼吸不足,高阻力的形成歸結為上氣道解剖學狹窄和咽部肌肉功能異常。上氣道解剖易感性是導致咽塌陷發生的關鍵因素之一,由此引起OSA的解剖因素包括上氣道狹窄和肥胖[4-8]。肥胖會導致睡眠時的咽部塌陷,這是一個眾所周知的危險因素[3]。肥胖OSA患者軟腭脂肪沉積較多。阻塞性睡眠呼吸暫停患者的咽脂肪墊面積較大[4]。肥胖OSA患者的舌底也可以觀察到舌頭體積增大,脂肪沉積增多[5]。中央型肥胖也可導致上呼吸道的解剖易感性OSA。腹部脂肪組織的積聚減少了肺體積。 基于上氣道解剖易感性,自發性阻塞性睡眠呼吸暫停在幾種動物中已被證實。英國斗牛犬的大軟腭導致上呼吸道狹窄,是最早的動物模型之一,與人類OSA[6]相似。牛頭犬的OSA主要出現在快速眼動睡眠中,與肥胖無關。相比之下,尤卡坦迷你豬則出現與肥胖相關的OSA[3]。
人際交往中存在若干心理效應,這些心理效應在課堂教學中會發揮一定的作用,一定程度上影響著思想政治教育的實效性。善于利用心理效應的積極方面,克服其對思想政治教育效果的不良影響,可以起到改善思想政治教育效果的作用。
OSA常見誘因是上氣道阻塞,可自發及外界誘因引起。既往文獻報道超過60%的OSA患者有肥胖,患者可見咽部結構(即舌根、軟腭和咽壁)周圍積聚脂肪組織,局部脂肪組織多導致上氣道狹窄、組織性質改變、臨界壓力增加、靜息肺容量減少,最終導致低氧血癥和代謝激素改變[9]。另一方面,OSA也可能加速體重增加,因為在OSA中經常看到的睡眠碎片與瘦素下降和胃饑餓素水平增加有關[10]。因此,OSA與肥胖具有相似的病理生理機制,可能相互作用并相互增強。既往OSA動物模型的方法多以低氧方式誘導建立。具體方法為將小型豬放入低氧倉,模擬缺氧的機制,但這種方法不能模擬出OSA患者實際的血氧波動情況。此外,也有通過人工氣道狹窄的方式建立OSA模型,多采用注射凝膠、安裝計算機控制的活塞等方法造成上氣道狹窄,模擬OSA患者氣道和血氧波動的情況。但凝膠制作模型的方法有其缺陷,局部凝膠量的控制較為困難,相對不可逆,模型質控困難,一致性不能得到良好控制。
本研究在預實驗過程中嘗試通過支氣管鏡注射凝膠于聲門上的方法來制作OSA模型,但在實驗過程中反復嘗試,凝膠在通過支氣管鏡的過程中即凝固,不能到達預計的注射部位。因此,本課題組調整造模方案為先誘導肥胖OSA模型,模擬肥胖相關OSA。進而聯合聲門上注射生理鹽水的方法造成上氣道狹窄,制造動物上氣道的狹窄,所建立的動物模型與OSA的自然病理狀態比較相符,具有穩定、可靠、重復性好的特點。避免了既往一些模型建立中采用單純采用低氧方式誘導OSA模型,忽略了阻塞性 OSAHS 最重要的部位,即上氣道在OSA的重要作用。本研究中的實驗動物豬模型更加符合OSAHS 的自然病理狀態,為研究肥胖相關OSA的理想大型動物模型。
OSA動物模型目前尚無公認的評價標準, 動物模型與人類OSA疾病特征是否相符最為重要。主要的觀察指標包括所建立的動物模型是否具有鼻鼾、呼吸暫停、睡眠紊亂等OSA的癥狀;咽部解剖結構是否出現咽壁軟組織增厚、咽腔的徑線是否改變;是否有呼吸紊亂。本實驗結果顯示實驗動物在OSA造模過程中出現的癥狀和觀察指標符合OSA臨床和影像學特征。本研究的創新之處在于聯合肥胖及上氣道阻塞兩種方法進行造模,更加貼近動物和人體上氣道OSA的病理生理改變,造模方法具有操作簡單,可重復性高的特點,為今后OSA模型的進一步研究提供了一種新的安全有效、可行的方法。
由于本方法建立OSA模型為探索性研究,存在一定的局限性。咽部注射生理鹽水造成的上氣道狹窄的持續時間可能不夠長,一定時間后生理鹽水吸收后,其導致的局部阻塞效應會減輕消失,可能更加適合用于短期的的OSA研究,在此基礎上建立穩定的OSA模型,值得進一步探索。本研究在肥胖的基礎上制造上氣道狹窄,為OSA動物模型的制作提供了一個新的思路。

