安寐丹干預斑馬魚睡眠剝奪模型晝夜節律及能量代謝作用機制研究*
汪 卿,游秋云,丁 莉,夏 婧,王 平
(湖北中醫藥大學老年醫學研究所 武漢 430065)
睡眠是生命活動中不可缺少的一種生理現象,良好的睡眠有利于生長發育、機體恢復以及保持心理健康等。但隨著現代人生活方式的變遷,尤其是新冠疫情引發的后續心理問題,導致失眠癥的發病率逐年增高。中國睡眠研究會公布的中國成人失眠患病率已經達到57%[1]。長期失眠不僅會導致生活質量下降,還會造成能量代謝紊亂,增加肥胖、糖尿病及代謝綜合征等疾病的風險[2]。
研究表明,生物節律和內穩態是調控睡眠的兩大關鍵因素,二者又互為影響[3]。一方面生物鐘的節律表達參與了機體能量代謝的調控。全基因組基因表達譜分析發現,大約有15%的轉錄組基因呈周期性表達,其中大部分是參與編碼碳水化合物、脂肪酸代謝、膽固醇生物合成的重要調節劑[4]。另一方面晝夜節律的破壞是誘發代謝性疾病的危險因素。如輪班工作者患二型糖尿病、胃腸疾病、肥胖、代謝紊亂等的發病率顯著升高[5];小鼠時鐘基因(Clock)突變、時鐘管理基因(Bmal1)缺陷或SCN受損,都會引起葡萄糖耐受能力、胰島素敏感性降低,表現為食欲旺盛、晝夜飲食節律減弱,并且隨著年齡的增長問題更為突出[6]。可見,生物鐘網絡和代謝調控網絡是交織在一起,提示我們可以通過研究生物鐘基因調控能量代謝的機制,來探索失眠防治的方向和路徑[7]。
相較于以中樞神經系統鎮靜催眠為主的化學藥物長時間使用會出現藥物依賴、呼吸抑制、損傷認知和精神系統等副作用,中醫藥在失眠防治領域中顯示出獨特優勢[8]。經典古方安寐丹,出自清代陳士鐸《石室秘錄》一書。書云:“心經之病,怔忡、不寐等癥,乃心血少矣……”方中人參益心氣,丹參、當歸補心血,麥冬養心陰,菖蒲開心竅,茯神、棗仁、甘草補心神,五味子斂心氣,諸藥合用,共奏益氣養心安神之功效。臨床用于治療虛證失眠并隨癥加減能收到良好效果[9]。課題組前期實驗也證實,安寐丹可通過修復線粒體分裂/融合失衡狀態、食欲素水平等改善睡眠剝奪(SD)模型大鼠神經細胞凋亡,恢復晝夜節律及學習記憶水平[10-11]。安寐丹浸泡給藥后能恢復光照SD斑馬魚幼魚晝夜節律,且鎮靜催眠效果隨劑量升高而增加,其機制可能與調節MAPK/MNK/eIF4E通路相關[12]。本研究選用模式生物斑馬魚為研究對象,采用咖啡因做誘導劑建立成年斑馬魚睡眠剝奪模型,觀察安寐丹浸泡給藥后對晝夜節律和能量代謝水平的影響,探討了安寐丹在調控斑馬魚睡眠中的作用機理。
1 材料與方法
1.1 實驗動物
實驗所用斑馬魚為4月齡野生型AB系,購自國家斑馬魚資源中心并于湖北中醫藥大學老年醫學研究所斑馬魚實驗室繁殖飼養,參照Westerfield方法[13],設置溫度為28℃,光黑交替循環為14 h:10 h,每天按時喂食豐年蝦兩次。
1.2 實驗藥物與儀器
1.2.1 主要藥物與試劑
安寐顆粒(湖北中醫藥大學老年醫學研究所提供[14]);褪黑素(Sigma公司,批號:M5250);咖啡因(巴菲爾公司,批號:58-08-2);RNA提取液(批號:G3013)、RT First Strand cDNA Synthesis Kit(批號:G3330)、2×SYBR Green qPCR Master Mix (High ROX) [A Synthesis Kit(批號:G3322)],以上試劑均由武漢賽維爾生物技術有限公司提供;總蛋白定量測試盒考馬斯亮藍法(批號:A045-2)、超微量三磷酸腺苷(ATP)酶測試盒(批號:A070-6),以上試劑均由南京建成弘大生物科技有限公司提供;尼氏染色液(南京生航生物技術有限公司,批號:DL-082)。
1.2.2 主要儀器與設備
斑馬魚行為分析系統(法國View Point Life Science,Videotrack Track 3.5)、T迷宮(法國 View Point Life Science,TF105B)、實時熒光定量聚合酶鏈反應儀(Real time-PCR,美國Bio-Rad公司,CFX96)、超微量分光光度計(美國Thermo公司,ND2000)、酶標檢測儀(美國Biotek公司,Epoch)、病理包埋機(德國Leica公司,RM2016)、切片機(德國Leica公司,RM2016)、熒光倒置顯微鏡(日本Olympus公司,IX71)。
1.3 實驗分組
1.3.1 分組及給藥
將斑馬魚隨機分成5組,分別為空白組、模型組、褪黑素組、安寐丹低劑量組、安寐丹高劑量組,每組15尾。空白組:正常飼養;模型組:用25 mg·L-1的咖啡因溶液浸泡24 h[15];褪黑素組:用25 mg·L-1的咖啡因溶液浸泡給藥22 h后再轉移到0.464 mg·L-1褪黑素溶液中浸泡給藥2 h;安寐丹低組:用25 mg·L-1的咖啡因溶液浸泡給藥22 h后再轉移到0.129 g·L-1安寐丹溶液中浸泡給藥2 h;安寐丹高組:用25 mg·L-1的咖啡因溶液浸泡給藥22 h后再轉移到0.514 g·L-1安寐丹溶液中浸泡給藥2 h。各組每日放入T迷宮中訓練,以此循環4天。
1.3.2 樣本采集
行為學檢測結束后,將斑馬魚放入冰水混合物中處死,于冰上迅速分離腦、肝臟等組織,用于組織切片樣本固定于4%多聚甲醛溶液放于4℃冰箱備用,用于分子生物分析樣本裝于滅菌EP管放于-80℃冰箱備用。
1.4 指標檢測
1.4.1 24 h行為學檢測
將各組斑馬魚置于斑馬魚行為分析系統中,根據成魚游動速率設置參數范圍為:靜止(<5 mm·s-1,黑色)、小運動(5-25 mm·s-1,綠色)、大運動(>25 mm·s-1,紅色),監測24 h內斑馬魚不同狀態運動計數、運動時間和運動距離。儀器將自動追蹤斑馬魚的行為軌跡,檢測結束后自動產生數據記錄與行為軌跡圖。
1.4.2 T迷宮實驗
T型迷宮由水平等長的左右臂和垂直起始臂組成,在起始臂的最前端設置一個可控的擋板隔開,根據斑馬魚顏色偏好[16],右臂標記綠色,并在深水區放置孵化的豐年蝦食物設為營養富集區(EC區),左臂標記紅色,不放置食物。
實驗測試包括3個階段:第1個階段是適應階段。將所有斑馬魚都放入T迷宮中自由游動,以適應新環境,為期2天。第2階段是訓練實驗。將每組斑馬魚分別放在T迷宮的起始區域,待魚適應穩定30 s后,輕輕抽出隔板,記錄斑馬魚在T迷宮中探索6 min的行動軌跡,分別記錄第1次進入EC區的時間以及在EC區停留的總時間,未進入者記為0 min,超過6 min記為6 min。測試時間內沒有進入EC區的將被人為引導到EC區,并讓它在其中停留1 min。訓練測試連續4天每天1次。第3階段是正式實驗。在最后1次訓練實驗的第2天進行記憶能力正式實驗,但不以食物作為獎勵,以評估學習記憶情況。配合斑馬魚行為分析系統記錄并分析每尾斑馬魚的行為軌跡。
1.4.3 尼氏染色觀察中腦神經元形態
全腦經4%多聚甲醛固定后,用PBS沖洗組織表面,切片機連續冠狀切片,PBS洗片3次,將切片放入1%尼氏染色液染色中浸染10 min。然后使用蒸餾水沖洗,用分色液分化10 s以清除背景。梯度乙醇脫水,再用二甲苯透明。最后中性樹膠封片,在顯微鏡下進行拍照,觀察中腦神經元及尼氏小體變化。
1.4.4 Real time-PCR檢測clocka、bmal1、晶體蛋白基因(Cry)1a、系列周期基因(Per)1a、per2mRNA表達水平
取斑馬魚腦組織,使用TRIzol提取總RNA溶于15 μL ddH2O并進行逆轉錄,而后使用Real time-PCR反應,以rpl13a為內參測定時鐘基因clocka、bmal1、cry1a、per1a和per2的相對量。結果采用 2-ΔΔCT法表示各mRNA表達。引物設計均由武漢賽維爾生物技術有限公司代合成,引物序列見表1。
1.4.5 定磷法測定肝臟中Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶及總ATP酶活力
由于ATP酶可分解ATP生成二磷酸腺苷和無機磷,因此測定無機磷含量可間接判斷ATP酶的活性。首先,取斑馬魚肝臟,準確稱取組織重量進行勻漿,采用考馬斯亮藍法測定斑馬魚肝臟蛋白濃度。然后采用定磷法按照超微量Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶、總ATP酶測試盒說明書進行檢測。計算公式:組織中ATPase活力(U·mg-1)=(測定OD值-對照OD值)(/標準OD值-空白OD值)×標準品濃度(0.02 μmol·mL-1)×6*×7.8**/待測樣本蛋白濃度(mg·mL-1),注:6*:定義上為每小時,實際操作為10 min反應,所以必須乘6;7.8**:反應體系中7.8倍稀釋

表1 引物序列
1.5 統計學方法
用SPSS 23.0統計軟件處理所有采集數據,運用Graphpad Prism 6.0繪制圖形。數據通過單因素方差分析,使用LSD、沃德-鄧肯法對組間進行統計評估,以平均值±標準差()表示,當結果P<0.05時被認為具有統計學意義。
2 結果
2.1 安寐丹對SD斑馬魚24 h自主活動的影響
結果顯示,與空白組相比,SD斑馬魚靜止狀態總計數、持續時長、覆蓋距離減少,大運動狀態總計數、持續時長、覆蓋距離增加,24 h晝夜節律變化幅度特征降低,但未見統計學差異。與模型組相比,藥物干預能恢復模型晝夜節律特征,其中褪黑素、安寐丹高劑量可增加靜止狀態計數(P<0.05)、減少大運動狀態計數(P<0.05),安寐丹低劑量增加靜止狀態計數(P<0.05)(圖1,表2)。
2.2 安寐丹對SD斑馬魚學習記憶能力的影響
除模型組外,各組隨著訓練時間延長第1次進入EC區時間均有不同程度的縮短。正式實驗結果顯示,與空白組相比,模型組第1次進入EC區的時間顯著增加(P<0.05),多在主臂徘徊,少數斑馬魚進入EC區后又游出,累計停留時間減少。與模型組相比,褪黑素組斑馬魚第1次進入EC區的時間顯著縮短(P<0.05),EC區的停留時間顯著增加(P<0.05),安寐丹組也出現改善效果,但差異無統計學意義(圖2,表3、4)。

圖1 安寐丹對SD斑馬魚24 h自主活動的影響(n=4)

表2 各組24 h不同狀態總計數(n=4)
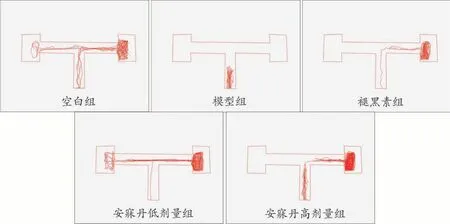
圖2 正式實驗各組T迷宮軌跡圖(n=5)
2.3 安寐丹對斑馬魚中腦神經元的影響
尼氏染色是觀察神經細胞改變的一種檢測方法,染色結果顯示,空白組斑馬魚中腦組織神經細胞數目正常,視蓋區細胞集中分布在中央灰質層,尼氏小體多見,著色顯著,核相對完整。與空白組比較,模型組中腦神經細胞數目明顯減少,細胞周圍裂隙增寬,尼氏小體明顯減少,著色淺。經安寐丹干預后,SD斑馬魚神經元胞體較為飽滿,丟失情況明顯好轉,尼氏小體部分可見,著色加深,且高劑量效果優于低劑量組。褪黑素組同樣可見中腦神經元數目增加,損傷減輕(圖3)。
2.4 安寐丹對腦組織clocka、bmal1、cry1a、per1a、per2 mRNA表達的影響
Real time-PCR結果顯示,與空白組相比,模型組bmal1和cry1a基因的mRNA相對表達量顯著上調(P<0.01)。與模型組比較,褪黑素及安寐丹處理后能降低bmal1和cry1amRNA相對表達量(P<0.01)(表 5)。

表3 各組第一次進入EC區時間(n=5)

表4 各組在EC區累計停留時間(n=5)

表5 各組斑馬魚腦組織clocka、bmal1、cry1a、per1a、per2 mRNA相對表達量(n=3)

表6 各組斑馬魚肝臟Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶、總ATP酶活力(n=6)
2.5 安寐丹對肝臟Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶及總ATP酶活力的影響
模型組肝臟Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶及總ATP酶活性均較正常斑馬魚減少,但差異未見統計學意義。安寐丹干預后,高劑量組三種酶的活性均顯著增加(P<0.05,P<0.01);低劑量組總ATP酶活力顯著增加(P<0.05)。褪黑素組總ATP酶及Na+-K+-ATP酶活力顯著增加(P<0.01)(表6)。
3 討論
睡眠剝奪是一種造成動物失眠的有效方式[17],咖啡因是制造SD模型的常用中樞神經系統興奮劑,通過結合神經遞質腺苷A2A受體抑制睡眠,增強覺醒。我們前期實驗結果證實咖啡因能有效誘導斑馬魚SD模型[18],尤其是高劑量的咖啡因,可以通過影響海馬神經元凋亡加重SD模型認知損傷[19]。故本實驗采用模式生物斑馬魚為研究對象,選取咖啡因誘導建立斑馬魚SD模型。實驗結果發現與空白組相比,模型組24 h行為學節律特征降低,靜止狀態總計數、持續時長、覆蓋距離均減少,運動狀態則顯著增加,并且以大運動為主;睡眠還可以幫助記憶信息存儲,SD則會影響大腦編碼神經元整合信息,降低學習記憶水平[17]。實驗發現SD模型學習記憶能力受損,隨著訓練時間延長第1次進入EC區的時間未見縮短,與空白組相比,正式實驗中進入EC區時間顯著增加(P<0.05),累計停留時間減少;與人腦不同,魚腦的形態是原始的,與視器有關的中腦占主要地位,通過發達的視網膜接收區來控制運動行為[20]。尼氏染色顯示SD模型中腦神經細胞、尼氏小體數目減少,裂隙增寬,著色變淺,提示模型的行為學變化與神經細胞受損密切相關。
晝夜節律的產生依賴于生物體自身的生物鐘系統以及鐘控基因組建的復雜的調控網絡,其中CLOCK和Bmal1形成異源二聚體誘導鐘控基因PER和CRY的轉錄,并隨著誘導基因的轉移增多形成負反饋,構成了節律震蕩最為重要的驅動回路[21]。因此我們從鐘控基因入手繼續探討了造成模型行為學改變的機制,發現SD模型的核心生物鐘基因clocka、bmal1(P<0.01)、cry1a(P<0.01)、per1a、per2mRNA表達水平較空白組升高,提示SD導致內源性生物鐘紊亂,這可能是引起睡眠-覺醒周期異常的重要原因。
同時生物鐘參與了機體能量代謝的調控并依賴于細胞膜上的離子泵等限速酶[22]。離子泵即ATP酶,鈉鉀泵是細胞的Na+-K+-ATP酶,鈣鎂泵是細胞的Ca2+-Mg2+-ATP酶,它們都參與了細胞逆濃度梯度的主動運輸,且酶的活性與轉運強度成正比。有研究發現SD令興奮性神經遞質谷氨酸釋放,通過谷氨酸離子型受體使鈣離子內流,細胞內鈣離子含量升高[23]。我們實驗也證實SD使能量代謝Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶及總ATP酶活性降低,會減少物質的交換和毒素的外排,從而破壞代謝穩態。提示SD會干預生物鐘基因功能,打破肝細胞跨膜轉運平衡,影響能量代謝。
安寐丹是中醫治療失眠癥的代表方,針對上述SD導致的行為學、細胞形態學及分子生物學改變結果,我們發現與模型組相比,安寐丹能恢復模型晝夜節律特征,增加靜止狀態計數(P<0.05)、減少大運動狀態計數(P<0.05);縮短第1次進入EC區的時間,增加EC區的停留時間;保護神經元胞體結構,增加尼氏小體數目;降低生物鐘基因clocka、bmal1(P<0.01)、cry1a(P<0.01)、per1a、per2mRNA 相對表達量;升高 Na+-K+-ATP酶(P<0.05)、Ca2+-Mg2+-ATP酶(P<0.01)及總ATP酶(P<0.05)活力,并且結果呈現出劑量相關性。提示安寐丹對生物鐘基因異常表達導致晝夜節律紊亂,影響能量代謝穩態,造成神經元損傷這一過程有顯著的拮抗作用。
另外褪黑激素作為一種潛在的同時參與調節睡眠覺醒和能量代謝的激素[24],設為陽性對照藥,實驗發現褪黑素可顯著改善SD斑馬魚的鎮靜和睡眠質量,維持代謝平衡,與安寐丹低劑量組相比在降低bmal1(P<0.05)、cry1a(P<0.01)mRNA水平上更為顯著,但與安寐丹高劑量組相比未見明顯差異。
綜上所述,安寐丹可以恢復斑馬魚睡眠剝奪模型晝夜節律,增強學習記憶能力,保護神經元結構,其機制可能與干預bmal1、cry1a等生物鐘基因,提高Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶、總ATP酶等能量代謝酶活性相關。但本實驗并未對生物鐘干預能量代謝的關鍵途徑進行深一步的探討,后期將繼續開展晝夜節律與能量代謝的關聯性分析和機制研究。

