肝移植術后再發噬血細胞綜合征的個體化藥物治療實踐*
何佳珂,馬景勝,楊文濤,朱紅飛,杜文鵬,吳觀勝,尹成龍,劉海浪,
鄒華2,姜正堯2,李國惠2,饒美英4,郭曉暉2,李齊根2,鐘林2
(1.南昌大學第二附屬醫院藥學部,南昌 330006;2.南昌大學第二附屬醫院器官移植科,南昌 330006;3.南昌縣人民醫院藥劑科,南昌 330200;4.南昌大學第二附屬醫院輸血科,南昌 330006)
患者,女,45歲,身高160 cm,體質量62 kg。2020年5月25日因左腳扭傷在當地中醫院就診,服用中藥治療(處方后經我院中醫科會診無肝毒性藥物),后因皮膚黃、眼黃,尿黃,先后就診于當地及我院肝病科,診斷為亞急性肝功能衰竭:藥物性損害?行護肝、退黃、人工肝治療,效果不佳,肝功能持續惡化并出現肝性腦病。2020年7月4日轉入器官移植科,體溫38 ℃,輔助檢查:總膽紅素(T-BiL)748.9 μmol·L-1,天冬氨酸氨基轉移酶(AST)124.5 U·L-1,丙氨酸氨基轉移酶(ALT)82.90 U·L-1,凝血時間(PT)45.9 s,國際標準化比值(INR) 3.94,纖維蛋白原(Fib)0.83 g·L-1,白細胞(WBC)2.87×109·L-1,紅細胞(RBC)3.07×1012·L-1,血紅蛋白(Hb)93 g·L-1,血小板(PLT)98×109·L-1。血培養陰性;胸腹部CT:肺部少許炎癥灶,肝臟符合急性壞死的表現,脾大,少量腹腔積液。患者既往體健,無高血壓、糖尿病、乙肝病史,巨細胞病毒(CMV)、EB病毒(EBV)、單純皰疹病毒陰性,自身免疫性肝病陰性,無食物藥物過敏史,無煙酒嗜好。術前診斷:①急性肝衰竭;②肝性腦病2期;③終末期肝病模型(MELD)評分:38分。
2 主要治療經過
2020年7月5日行心臟死亡器官捐贈(DCD)來源同種異體肝移植術,手術順利,術中出血約800 mL,使用注射用甲潑尼龍琥珀酸鈉(甲強龍)500 mg,術后注射用甲強龍240 mg,qd,每天減少劑量40 mg。第1天晚開始給予他克莫司膠囊(商品名:普樂可復,2 mg,q12h),嗎替麥考酚酯膠囊(商品名:驍悉,0.5 g,q12h),注射用哌拉西林鈉/他唑巴坦鈉(商品名:特治星,4.5 g,q12h),注射用醋酸卡泊芬凈(商品名:科賽斯,70 mg,qd),注射用更昔洛韋(0.25 g,qd)預防感染,予注射用奧美拉唑鈉 (40 mg,q12h) 抑酸、注射用生長抑素(3 mg,q12h)降低門脈壓、輸注懸浮紅細胞等對癥及支持治療。
術后第3天,患者體溫38 ℃,痰細菌培養結果肺炎克雷伯菌、超廣譜β-內酰胺酶(ESBLs)陽性,中心靜脈導管(CVP)尖端細菌培養表皮葡萄球菌(苯唑西林耐藥,利奈唑胺敏感MIC=1),臨床藥師建議抗菌藥物調整為注射用亞胺培南/西司他丁鈉(商品名:泰能,1 g,q8h),利奈唑胺注射液(商品名:斯沃,600 mg,q12h),繼續使用卡泊芬凈(50 mg,qd)。
術后前4 d相關指標恢復順利,凝血功能恢復正常,T-BiL降至94 μmol·L-1,但術后第5天各項檢驗指標反彈,開始出現持續高熱(體溫>38.5 ℃),可溶性CD253260 pg·mL-1(術前標本)。第6天開始肝功能惡化加劇:T-BiL 284 μmol·L-1,AST 1 026 U·L-1(第7天3 666.10 U·L-1),ALT 517 U·L-1(第7天1 622.80 U·L-1),PT 22.2 s,INR 1.93。術后第6~8天,臨床藥師與醫師討論后給予兔抗人胸腺細胞免疫球蛋白(商品名:即復寧,ATG,100 mg,50 mg,50 mg),靜注人免疫球蛋白(IVIG,20 g,20 g,20 g),增加他克莫司膠囊劑量(3 mg,q12h),并留取痰液、血液、尿液、引流液標本進行相關培養。
術后第9天,鐵蛋白112 005.30 ng·mL-1,可溶性CD259 957 pg·mL-1,WBC 12.38×109·L-1,RBC 2.57×1012·L-1,PLT 10×109·L-1,HGB 81 g·L-1,CRP 24.50 mg·L-1,中性粒細胞(N)% 94.7%,T-BiL 243.16 μmol·L-1,AST 1 460.70 U·L-1,ALT 1 541.40 U·L-1,PT 19.8 s,INR 1.71,白細胞介素(IL)-6 9.38 pg·mL-1,IL-10 75.17 pg·mL-1,IL-8 34.99 pg·mL-1,血液、尿液、痰液、引流液細菌培養陰性,真菌(1-3)-β-D-葡聚糖 <5 pg·mL-1,GM試驗0.22,群體反應性抗體Ⅰ類11%,Ⅱ類6%,他克莫司全血谷濃度7.49 ng·mL-1,臨床藥師建議抗菌藥物調整為頭孢哌酮鈉/舒巴坦鈉(商品名:舒普深,1.5 g,q12h),繼續給予ATG 50 mg,IVIG 20 g。
術后第11天行骨髓穿刺,骨髓涂片顯示:髓片可見噬血組織細胞,確診HPS,經血液內科會診后采用HLH-2004方案治療:依托泊苷(VP-16)150 mg·(m2)-1,地塞米松10 mg·(m2)-1·d-1。臨床藥師與醫師討論后繼續IVIG 10 g,減少他克莫司膠囊劑量(2 mg,q12h),行血漿置換等對癥及支持治療。
術后第14天,無畏寒發熱,T-BiL 197.20 μmol·L-1,AST 43.80 U·L-1,ALT 107.30 U·L-1,CRP 15.84 mg·L-1,WBC 11.96×109·L-1,RBC 2.38×1012·L-1,PLT 125×109·L-1,HGB 75 g·L-1,N% 88.2%,PT 11.1 s,INR 0.97,他克莫司全血谷濃度13.80 ng·mL-1,臨床藥師建議他克莫司減量至1 mg,q12h,停用抗菌藥物。在繼續HLH-2004方案化療2周和對癥治療后(期間輸注懸浮紅細胞2次),患者肝功能、凝血功能、血常規基本正常,于術后29 d順利出院,繼續給予他克莫司膠囊1 mg,q12h,醋酸潑尼松片 20 mg,qd,并于1周后至血液科繼續行下一階段化療。患者隨訪1年半,健康生存。
3 討論
HPS為非獨立疾病,是各種致病因素如遺傳、免疫抑制劑、惡性腫瘤、感染等導致機體免疫功能紊亂引起的一種過度炎性反應,導致多器官功能障礙,按照病因分為原發性和繼發性。HPS發病機制目前仍不明確,不同類型HPS遺傳背景和發病機制不完全相同,但具有共同病理生理特征——細胞毒T細胞和巨噬細胞堆積,NK細胞和殺傷T淋巴細胞功能缺陷以及細胞因子風暴[1-5]。HPS輕重程度與免疫細胞活化程度以及細胞因子水平有關,如腫瘤壞死因子α(TNF-α)、IL-6、IL-8、IL-10、干擾素(INF)-γ等。
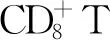
支持治療(包括及時靜脈輸注IVIG、應用ATG、調整抗感染方案、使用血液制品以及采用血液凈化策略等)在HPS治療中同樣重要。IVIG Fc段能夠抑制吞噬作用;阻斷免疫復合物進入IgG Fc部分受體(FcγRs),封閉激活性FcγRs,上調抑制性FcγRⅡB;改變糖皮質激素受體(GR)結合親和力;調節樹突細胞(DCs)成熟與功能,抑制DCs成熟,T細胞分化,細胞因子的釋放以及B細胞產生抗體,抑制抗體依賴的細胞毒性;通過新生兒Fc受體(FcRn)調控抗體半衰期,加速病理性IgG代謝;抑制活化補體成分在靶組織沉積,減弱補體介導的損傷[10-12]。IVIG Fab段能夠作為免疫調節蛋白抗體,中和自身抗體和多種分子(細胞因子、趨化因子、受體、粘附分子);超抗原和病原體抗體以及天然抗體[10,13]。大劑量靜脈注射IVIG,對改善危重HPS患者預后具有重要作用[14-15]。ATG選擇性作用于T淋巴細胞,識別T細胞表面活性物質,如CD2、CD3、CD4、CD8、CD11a、CD25等,進而被補體依賴性溶解和由單核細胞和吞噬細胞作用形成的Fc-依賴性調理素機制從循環中清除,衰竭T細胞。本例患者從術后第6天起使用IVIG調節免疫,ATG免疫誘導,減少吞噬血細胞作用,緩解細胞因子造成的多臟器功能損害。
3.2治療性血漿置換(TPE)對藥物清除的影響以及劑量調整 本例患者輸注懸浮紅細胞5次(術中及術后第1,6,17,23天),輸入血小板4次(術后第8-11天),TPE2次(術后第12,13天)對癥支持治療。作為一種重要的血液凈化方式,TPE主要清除免疫球蛋白、免疫復合物、內毒素、細胞因子、炎性介質等大分子物質。藥物表觀分布容積(Vd)和血漿蛋白結合率(fb)是影響TPE清除的2大關鍵藥動學參數[16-17]。一般來說,Vd小(<0.2~0.3 L·kg-1)和fb高(>80%)的藥物大部分分布在血管內,最易受TPE影響。藥物劑量、內源性清除率、嚴重疾病或身體水合狀態、其他因素如營養狀況等也會改變Vd和fb,影響TPE清除效果。順鉑、慶大霉素、萬古霉素等藥物在體內呈現多室動力學特征,室間親和力和再分布速率存在差異,因此給藥與TPE的時間間隔,TPE維持時間和治療頻率對體內藥物水平影響程度不同。TPE中或TPE后即刻測定藥物濃度,可能忽略TPE引起的藥物再分布,進而低估或者高估清除效果。不論Vd高低,如果給予足夠時間,藥物逐漸分布到血管外,TPE對濃度影響越來越小。而快速清除的藥物,當消除器官功能正常或改善時,受TPE的影響最小。當總藥物清除率增加30%或內源性清除率<4 mL·min-1(急性腎損傷或其他器官功能障礙)且藥物半衰期>2 h(TPE近似維持時間)時,TPE才可能對藥物水平產生顯著的臨床影響[17]。
對鈣調磷酸酶抑制劑而言,他克莫司和環孢素主要分布在紅細胞,他克莫司fb約99%,Vd為0.85~1.41 L·kg-1,半衰期23~46 h,治療劑量下,末次給藥與TPE間隔1~7.5 h,TPE清除可以忽略不計[18-19]。環孢素fb90%~98%,Vd為4~6 L·kg-1,半衰期8.4 h,末次給藥與TPE間隔2~13 h,環孢素濃度改變6%~36%,體內藥量清除0.2%~0.3%[20-21]。總的來說,TPE對鈣調磷酸酶抑制劑暴露量影響輕微,但臨床應注意監測谷濃度。霉酚酸酯(MMF)fb97%,Vd為3.6 L·kg-1,霉酚酸(MPA)Vd為54 L,MMF半衰期18 h,MPA半衰期8~16 h,末次給藥TPE間隔4~7.5 h,濃度改變19%~70%,體內藥量清除0.44%~2.8%[18,22]。可以看出,TPE治療對MMF濃度影響不大,但是給藥后立即行TPE或當藥物仍處于分布相時行TPE(時間間隔<4 h),TPE對MMF清除增加,因此TPE后給藥更為合適。潑尼松fb90%~95%,Vd為0.6~0.7 L·kg-1,半衰期3~4 h,末次給藥與TPE間隔0.42~1.16 h,體內藥量清除約0.83%,受TPE清除影響小[23]。巴利昔單抗Vd為4.5~12.7 L,半衰期4~10.4 d,末次給藥與TPE間隔6 h,藥物濃度改變65%~72%,體內藥量清除約46%[24-25],說明TPE影響顯著巴利昔單抗濃度,需追加給藥,使濃度高于IL-2R飽和水平(0.2 μg·mL-1)。IVIG呈現多室動力學(約76%免疫球蛋白M存在于血管內)特征,Vd<0.3 L·kg-1[26],提示大多數IVIG對TPE清除敏感,為確保療效,應考慮TPE后給藥或追加給藥。
4 結論
肝移植術后發生HPS的報道筆者較少見到,自2001年來國內外中心共報道16例,雖然積極治療,但是仍有9例患者在術后2個月內死亡,總體生存率非常低[27]。迫切需要在非實體器官移植術后HPS治療方案基礎上為肝移植術后HPS患者建立特定的治療策略。由于HPS臨床表現多樣,缺乏特異性,一旦診斷應馬上治療,也可以在不完全符合診斷標準時,邊治療,邊觀察病情。臨床藥師應積極全程參與HPS等罕見疑難重癥的診療過程,積極評估藥物療效,協助臨床制定個體化用藥方案,提升藥學服務水平,促進臨床用藥的有效安全。

