BRCA1、BRCA2、RAD51和FANCD2在上皮性卵巢癌中的表達及其與臨床病理特征的關系
劉蘭蘭,王志新,袁思銳,石春燕,盧子文,胡興,劉晗青,屠志剛
(1. 江蘇大學生命科學學院,江蘇 鎮江 212013; 2. 江蘇大學藥學院,江蘇 鎮江 212013; 3. 江蘇大學附屬醫院婦科,江蘇 鎮江 212001)
卵巢癌是最常見的婦科惡性腫瘤之一[1-2]。傳統的化療藥物不良反應大,總體療效差。近年來,選擇性高、不良反應小的靶向藥物已成為抗卵巢癌新藥研發領域的熱點,其中包括了血管內皮生長因子(vascular endothelial growth factor,VEGF)抑制劑[3]、多聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase, PARP)抑制劑[4-5]等。PARP抑制劑是一類新興的、基于協同殺傷機制的卵巢癌靶向治療藥物[6]。PARP抑制劑可以選擇性殺死DNA雙鏈斷裂同源重組修復機制不完整的癌細胞,而對正常細胞作用輕微。早期研究發現,PARP抑制劑對于具有乳腺癌易感(breast cancer susceptibility,BRCA)基因缺陷的卵巢癌患者有很好的治療效果。然而,隨著研究的深入,人們發現PARP抑制劑對于很多沒有BRCA基因缺陷的患者也非常有效[7]。考慮到DNA雙鏈斷裂的同源重組修復需要多種蛋白的共同調節[8],因此推測卵巢癌患者中普遍存在DNA雙鏈斷裂的同源重組修復機制的障礙。
已有研究顯示,DNA雙鏈斷裂的同源重組修復需要數十個蛋白協同完成。其中研究最多的有乳腺癌易感1(BRCA1)、乳腺癌易感2(BRCA2)、DNA修復蛋白RAD51和范可尼貧血D2蛋白(FANCD2)等[9-11]。將具有DNA雙鏈斷裂修復障礙的卵巢癌患者從紛繁復雜的卵巢癌病例中鑒定出來,進一步使用PARP抑制劑對其進行個性化治療,將具有很好的臨床應用前景和社會價值。基于以上考慮,本研究采用免疫組織化學染色法(immunohistochemistry,IHC)檢測上皮性卵巢癌(epithelial ovarian cancer,EOC)組織中BRCA1、BRCA2、RAD51和FANCD2的表達,并應用GEPIA和Ualcan分析它們與EOC患者臨床病理特征的關系。
1 材料與方法
1.1 標本來源
收集江蘇大學附屬醫院2007年1月至2018年12月未經治療的EOC患者的術后組織標本,去除轉移癌和分類不明確的癌組織,最終保留了84例符合標準的EOC組織標本。對84例EOC按照WHO標準進行分類,包括漿液性卵巢癌55例、黏液性卵巢癌16例和卵巢透明細胞癌13例;根據FIGO分期標準進行分類,Ⅰ~Ⅱ期29例,Ⅲ~Ⅳ期55例。出現淋巴結轉移38例,腹膜轉移39例。患者的平均年齡為54歲,<50歲患者56例。
篩選標準: ① 確診前患者未患過任何重大疾病;② 未采用過其他附加治療手段;③ 手術后獲得的癌組織均用石蠟包埋制成包埋塊,并通過HE染色后由病理學研究人員進行專業鑒定,確定有無病變。另收集6例正常卵巢組織作為對照。本研究經過江蘇大學醫學倫理委員會的批準。
1.2 主要試劑
BRCA1抗體(美國Milllipore公司);BRCA2抗體、FANCD2抗體、RAD51抗體(美國Abcam公司);人鼠通用型二抗、免疫組化試劑盒和DAB染液購自基因科技(上海)股份有限公司;蘇木素和伊紅染液購自珠海貝素生物公司;其他IHC試劑如無特殊說明,均購自國藥集團。
1.3 免疫組織化學染色
標本均用石蠟包埋,切成厚度為4 μm的組織薄片;刷子緩慢移動組織薄片至提前加熱的水浴鍋做展片處理,1~2 min后使用載玻片將其撈出放于烤片機上3~5 min使其完全貼附于載玻片上;脫蠟處理并進行抗原修復及過氧化氫封閉后;將4種抗體用PBS按合適比例稀釋后(BRCA1和BRCA2按1 ∶200稀釋,RAD51和FANCD2按1 ∶100稀釋),滴于石蠟標本上,并置于4 ℃冰箱中孵育過夜;之后按照DAB顯色液操作方案對切片顯色;最后蘇木素染色后脫水封片。
由兩位研究人員對染色結果進行雙盲確認,對陽性細胞的染色強度以及在整張切片中的占比進行評分。染色強度評分標準:無棕黃色0分,淡棕黃色1分,棕黃色2分,棕褐色3分。陽性細胞占比評分標準:無陽性細胞即為0分,陽性細胞1%~25%為1分,26%~50%為2分,51%~75%為3分,76%~100%為4分。每個視野評分為陽性細胞的染色強度分值與占比分值的乘積[12]。每個病例的評分取兩位評分人員分數的平均值。
1.4 使用GEPIA分析BRCA1、BRCA2、RAD51和FANCD2基因在EOC組織中的表達
通過GEPIA(http://gepia.cancer-pku.cn/)平臺分析TCGA(the cancer genome atlas)數據庫中4種基因在EOC組織及癌旁組織中的mRNA表達,以驗證本次實驗數據的可靠性。設置篩選條件如下,① Gene:BRCA1/BRCA2/RAD51/FANCD2;② Differential Methods: ANOVA;③ |Log2(FC)|>1;④ 顯著性參數q-value Cutoff: 0.01;⑤ Cancer name: OV。
使用GEPIA中Spearman分析法對TCGA數據庫中BRCA1、BRCA2、RAD51及FANCD2mRNA表達的相關性進行分析。
1.5 使用Ualcan分析BRCA1、BRCA2、RAD51和FANCD2基因表達與EOC患者臨床病理特征的關系
使用Ualcan(http://ualcan.path.uab.edu/index.html)在線分析TCGA數據庫中BRCA1、BRCA2、RAD51和FANCD2的mRNA表達與EOC患者年齡、腫瘤組織學分級、種族和TP53突變情況之間的關系。設置篩選條件如下,① enter gene symbol:BRCA1/BRCA2/RAD51/FANCD2;② TCGA dataset:OV。
1.6 統計學方法
應用SPSS 19.0軟件進行統計學分析。4種蛋白在EOC和正常卵巢組織中的表達差異采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 BRCA1、BRCA2、 RAD51和FANCD2蛋白在EOC組織中的表達
IHC染色結果顯示,BRCA1 、BRCA2、 RAD51和FANCD2蛋白在細胞核和細胞質中均有分布(圖1)。對IHC切片進行評分顯示,BRCA1蛋白在EOC組織和正常卵巢組織間的差異無統計學意義,其他3種蛋白在EOC組織中的陽性表達率顯著高于正常卵巢組織,見表1。
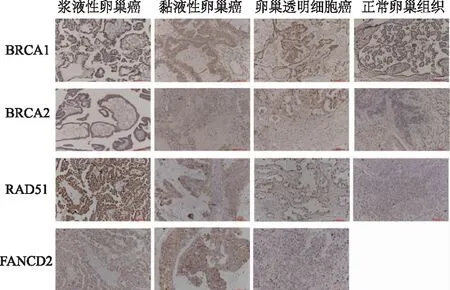
圖1 4種蛋白在不同組織學類型EOC組織中的陽性表達(免疫組化,標尺100 μm,×200)
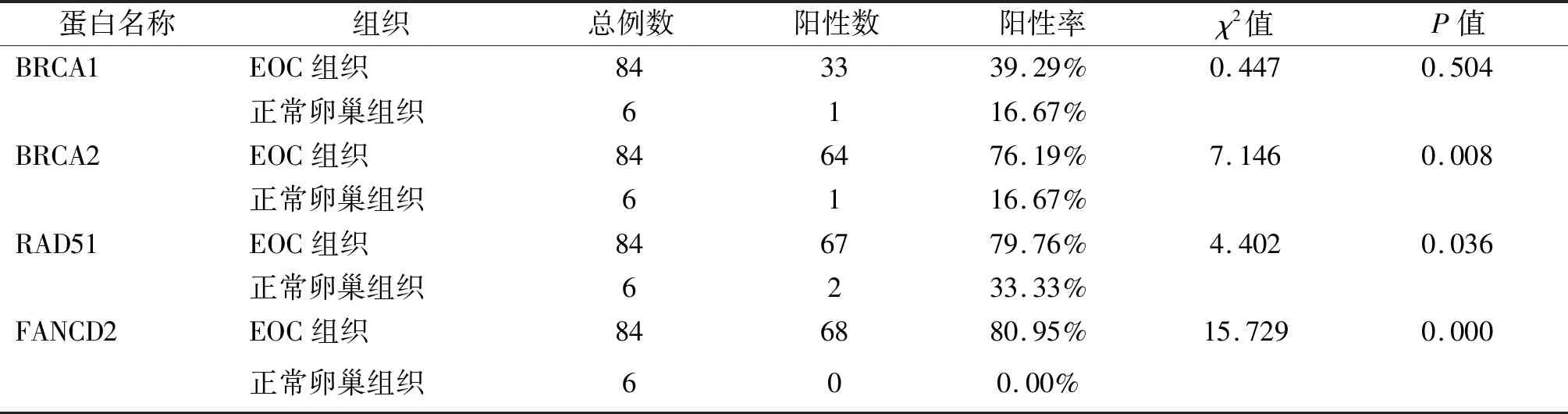
表1 4種蛋白在EOC組織和正常卵巢組織中的表達
2.2 BRCA1、BRCA2、RAD51和FANCD2 mRNA在EOC組織中的表達
GEPIA分析結果顯示,與正常卵巢組織相比,BRCA1、BRCA2、RAD51和FANCD2的mRNA相對表達量在EOC組織中明顯上升(圖2A),差異有統計學意義;而且它們的表達水平兩兩之間均呈明顯正相關(圖2B)。
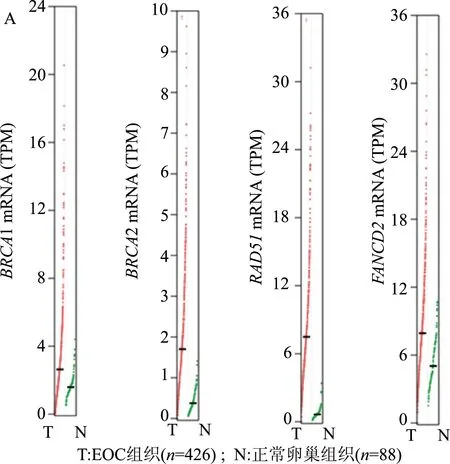
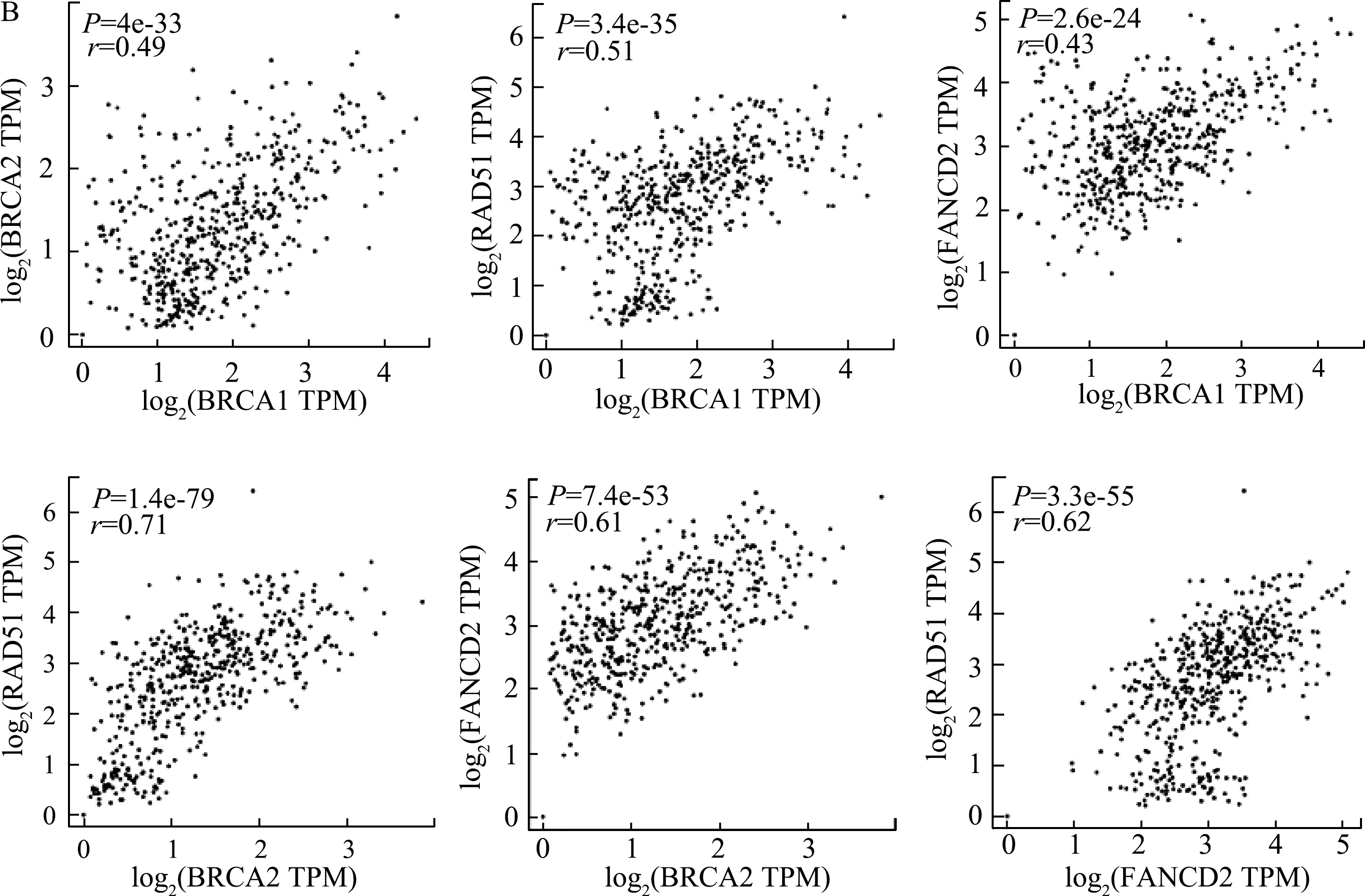
圖2 GEPIA分析EOC組織BRCA1、BRCA2、RAD51和FANCD2 mRNA表達及相關性
2.3 BRCA1、BRCA2、RAD51和FANCD2 mRNA表達與EOC患者臨床病理特征的關系
Ualcan分析結果顯示,BRCA1mRNA在41歲以上患者中的表達明顯高于41歲以下患者(圖3A)。4種基因在EOC組織學2級及以上腫瘤中的mRNA表達均較高,其中,RAD51mRNA在3級腫瘤中的表達顯著高于2級(圖3B)。FANCD2mRNA在非洲裔人種中的表達顯著高于白種人(圖3C),其他mRNA表達在不同人種中無顯著差異。TP53突變的EOC組織中BRCA1、RAD51和FANCD2mRNA表達顯著高于TP53未突變EOC組織(圖3D)。
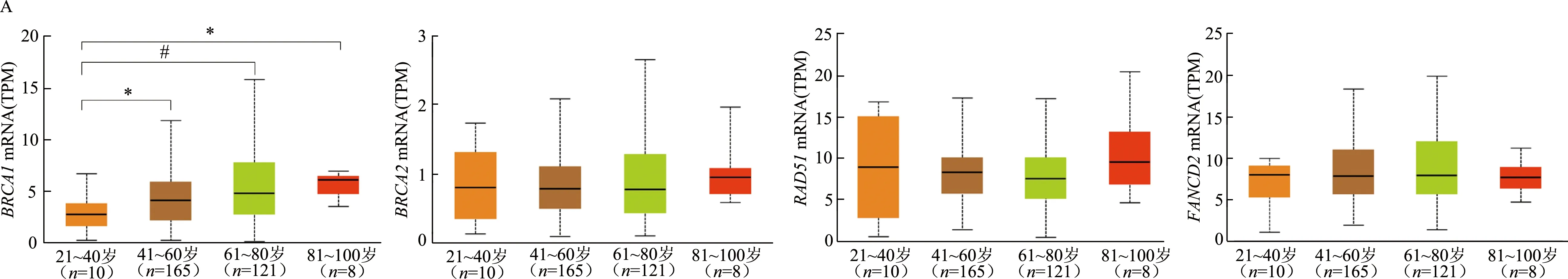

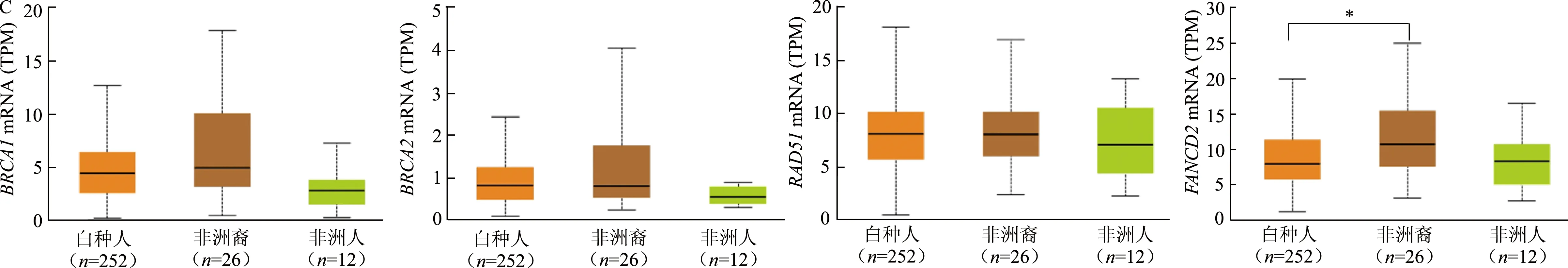
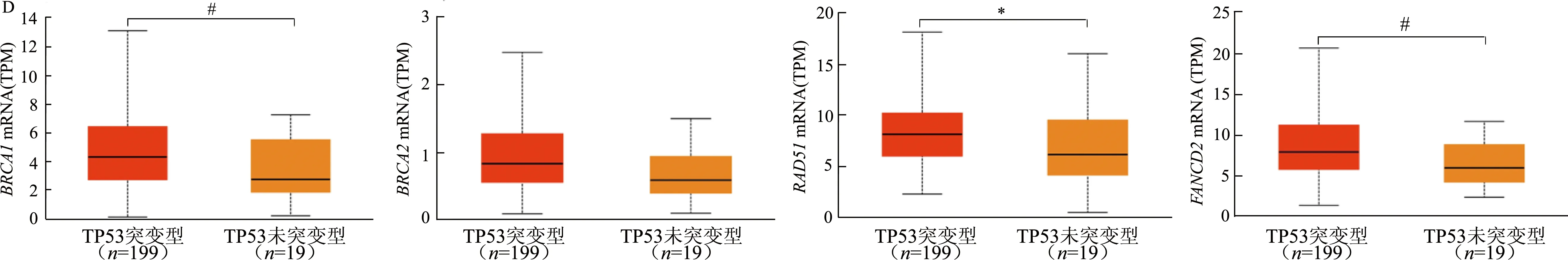
*: P<0.05,#: P<0.01
3 討論
BRCA1和BRCA2是經典的抑癌基因,在DNA雙鏈斷裂同源重組修復中起舉足輕重的作用[13-14]。此外,在同源重組修復中,RAD51蛋白起到了鏈間交換的作用,斷裂DNA發出的損傷信號會使FANCD2蛋白激活并與BRCA1蛋白轉移至損傷位點修復DNA[15]。雖然BRCA1、BRCA2、RAD51蛋白在同源重組修復中起到重要作用,但根據前人研究[7],卵巢癌中還存在其他多種同源重組基因缺陷,復雜的同源重組修復過程可能由于某一種蛋白的缺陷而發生改變[8]。有研究顯示[7],BRCA2和RAD51基因突變可以促進卵巢癌的發生發展。本研究結果表明,除了BRCA1與正常對照無顯著差異外,BRCA2、RAD51和FANCD2蛋白在EOC組織中均高表達。研究證實BRCA1、BRCA2、RAD51和FANCD2蛋白在多種癌癥中過表達,而且這些蛋白的過表達有可能是患者不良預后的指標[16-19]。隨后,通過GEPIA對TCGA數據庫BRCA1、BRCA2、RAD51和FANCD2基因在EOC組織中的mRNA表達水平進行整合分析,發現與正常卵巢組織相比,以上4種基因的mRNA表達水平均明顯升高,且兩兩之間均呈正相關。 Ualcan分析顯示EOC組織中BRCA1、BRCA2、RAD51和FANCD2的mRNA表達與患者年齡、腫瘤組織分級、種族及TP53突變情況明顯相關。BRCA2、RAD51和FANCD2蛋白的高表達提示在卵巢癌中可能存在DNA雙鏈斷裂同源重組修復通路的持續激活。同源重組修復發生缺陷會改變基因組穩定性,常常促使細胞癌變[20]。EOC的發生可能與持續存在的DNA雙鏈斷裂修復相關[21]。本研究結果提示,BRCA2、RAD51和FANCD2蛋白有望成為診療卵巢癌新的標志物。
卵巢癌中之所以會出現持續激活的DNA雙鏈斷裂修復現象,可能是因為DNA雙鏈斷裂修復通路的某些節點發生紊亂,從而對DNA損傷修復有關途徑造成阻礙;未能被及時修復的DNA損傷位點會持續發出信號以招募DNA損傷修復蛋白累積至損傷位點;上述兩個過程相互促進,惡性循環,導致了DNA雙鏈斷裂修復通路持續激活卻又無法有效修復DNA損傷的現象。綜上所述,本研究結果為探索基于PARP抑制劑的卵巢癌靶向治療提供了新策略。

