基于代謝組學技術的不同白酒揮發性成分差異分析
◎ 張春生,趙文靜,董良飛,施 蕊
(1.云南財經大學 旅游與酒店管理學院,云南 昆明 650221;2.云南財經大學 統計與數學學院,云南 昆明 650221;3.西南林業大學 園林園藝學院,云南 昆明 650224)
白酒系世界七大蒸餾酒之一,其歷史悠久、風味獨特,深受我國廣大消費者的喜愛與青睞。白酒是一種復雜的多組分體系,主要成分為乙醇和水,約占總質量的98%~99%,剩余的微量成分為一些酯類、醛類、酸類、芳香族及高級醇類化合物[1]。雖然這些微量成分總占比不足2%,但卻是影響白酒品質的關鍵,其種類、含量及相互間比例的差異賦予了白酒不同的香型與風味[2-3]。目前,用于白酒微量成分分析的技術手段主要有色譜[4]、質譜[5]、光譜[6]和電子傳感技術[7]等,其中氣相色譜-質譜聯用技術(Gas Chromatography-Mass Spectrometry,GC-MS)對于低沸點的揮發性組分靈敏度高、分離性好,已廣泛用于白酒的摻假識別[8]、香型判定[9]及年份鑒定[10]等。此外,近年的應用實踐表明,頂空固相微萃取箭型(Headspace Solid-Phase Microextraction Arrow,HS-SPME Arrow)技術可顯著降低前處理時白酒揮發性成分的流失,且新型的SPME Arrow比常規型號擁有更大的吸附表面積與體積,富集效果更佳,檢測結果也更接近真實酒樣[11-12]。
代謝組學是繼蛋白質組學和基因組學后新近興起的一種組學技術,旨在利用現代分析儀器對生物體內的小分子代謝物(相對分子量<1 kDa)進行檢測與鑒定,以尋找內源分子與生理病理變化間的相對關系[13]。根據研究對象的不同,代謝組學可分為靶向和非靶向兩類,前者主要聚焦一類、一組或一群特定代謝物的分析,后者則是無偏向性地對所有檢出的代謝物進行全面分析[14],其間最關鍵、最核心的問題是多變量數據矩陣的處理[15]。代謝組學自20世紀90年代末誕生以來發展迅速,目前已成為臨床醫學、生命科學、環境科學等領域的重要研究工具,同時也為食品科學研究提供了新思路、新方法,如食品成分分析[16]、質量鑒別[17]、風險監測[18]。
基于此,本文將新型HS-SPME Arrow與GC-MS聯用,結合代謝組學技術建立白酒揮發性成分差異分析方法,以同一品牌不同醬香型白酒為例,在全面解析揮發性成分的基礎上對差異成分進行篩選和標示,以期為白酒品質的客觀評定提供理論依據和現實參考。
1 材料與方法
1.1 材料與儀器
1.1.1 實驗材料
實驗選取貴州茅臺鎮某酒業公司兩種酒精度為53%(體積分數)的醬香型白酒(編號為GB和1915)作為研究對象,GB和1915各成一組,每組設3個平行酒樣,6個酒樣依次編號為GB-a、GB-b、GB-c、1915-a、1915-b和1915-c。質控樣本由GB和1915酒樣等量混合制備而成,對應編號依次為mix01、mix02、mix03。
1.1.2 儀器與試劑
Agilent 8890-5977B氣相色譜質譜聯用儀;Agilent DVB/CAR/PDMS三相Arrow萃取頭;Millipore-Q超純水系統。正己烷(Merck)為色譜純;氯化鈉(國藥)為分析純;標準品(Sigma-Aldrich)為色譜純;實驗用水為超純水。
1.2 試驗方法
1.2.1 酒樣前處理
取1 mL酒樣于進樣瓶中,向瓶內加入5 mL飽和氯化鈉溶液和10 μL正己烷內標液,采用全自動HSSPME進行揮發性成分萃取富集以供GC-MS分析。
1.2.2 固相微萃取條件
老化溫度:250 ℃,老化時間:5 min;孵化溫度:60 ℃,孵化時間:10 min;萃取溫度:60 ℃,萃取時間:20 min;轉子轉速:400 r·min-1;解吸時間:5 min。
1.2.3 氣相色譜及質譜條件
色 譜 柱:DB-5MS(30 m×0.25 mm×0.25 μm)毛細管柱;進樣口溫度:250 ℃;升溫程序:40 ℃保持5 min,以6 ℃·min-1升至280 ℃,維持5 min。載氣:氦氣;流速:1 mL·min-1;質譜條件:EI離子源,離子源溫度230 ℃,傳輸線溫度280 ℃,電離電壓70 eV,四極桿溫度150 ℃。
1.3 數據處理
基于邁維(嘉興)生物技術有限公司MVGC 1.0數據庫,運用MassHunter軟件(Agilent)進行質譜峰信息提取,經數據過濾、保留指數計算、歸一化處理完成酒樣揮發性成分的定性定量分析。采用多元統計方法對酒樣質譜數據進行主成分分析(Principal Component Analysis,PCA)、正交偏最小二乘法判別分 析(Orthogonal Partial Least Squares Discriminant Analysis,OPLS-DA),并對差異判定模型進行評價。結合OPLS-DA模型的變量重要性投影VIP值(Variable Importance in Project)、P值(P-value)和差異倍數FC值(Fold Change)篩選差異成分,運用3.5.0版R軟件Pheatmap程序(版本1.0.12)繪制差異成分聚類熱圖,對差異倍數值進行對數處理(log2FC)進一步明晰差異顯著的前20個成分。
2 結果與分析
2.1 酒樣揮發性成分總體分析
GB、1915酒樣和質控樣本mix經前處理后,在優化設定的GC-MS條件下首先獲得總離子流圖,繼而基于MVGC 1.0數據庫,運用MassHunter軟件完成酒樣揮發性成分定性定量分析。表1的統計結果顯示,GB和1915兩種酒樣無論是揮發性成分的種類還是數量都保持高度一致,即15類229個揮發性成分,這是由于兩酒樣系同一品牌的兩款同香型白酒所致。229個揮發性成分中,被視為白酒香味主體物質的酯類數量占絕對優勢,達82個,占比超35%,其次為芳烴類、雜環化合物、酮、醛、烷烴等,酸、硫化物、醚、烯烴和其他類物質檢出量均不超過2個,占比均不足1%。

表1 GB和1915兩種酒樣揮發性成分分類與數量統計表
2.2 酒樣差異判定與差異揮發性成分篩選
2.2.1 主成分分析(PCA)
主成分分析是一種常用的“線性降維”方法,即在盡可能保證數據矩陣“信息量不丟失、不減少”的情況下使用少數幾個綜合指標(主成分)概覽和揭示原始變量的內部結構,并將多維度數據轉化為可視化的散點圖[19]。通過主成分分析可初步了解樣品組間和組內樣品間的相似性或差異度大小,GB和1915兩種酒樣質譜數據主成分分析結果見圖1。從二維主成分分析結果,即圖1(a)中可以直觀看出,GB和1915酒樣組間分離明顯,這說明雖然兩種酒樣揮發性成分種類、數量高度一致,但含量方面存在可視化差異,從組內差異來看,1915酒樣總體小于GB酒樣,這意味著1915酒樣間的相似度更高,揮發性成分的質量控制更為穩定。三維主成分分析結果如圖1(b)所示,由圖可知,PC1、PC2和PC3的可解釋差異分別為74.8%、12.17%和5.76%,累計可解釋差異達92.73%[15]。

圖1 兩種酒樣二維和三維主成分分析散點圖
2.2.2 正交偏最小二乘法判別分析(OPLS-DA)
PCA雖能有效提取樣品間的差異度信息,但對相關性較小的變量并不敏感,PLS-DA(Partial Least Squares Discriminant Analysis)作為一種有監督模式識別的分析方法可有效消除此缺陷[15]。OPLS-DA則是一種結合了正交信號矯正和PLS-DA的回歸建模方法,其最大特點是可以去除自變量與分類變量無關的數據變異,從而使模型變得簡單和易于解釋,判別效果及主成分得分圖的可視化效果更加明顯[20-21]。根據OPLS-DA模型對GB和1915兩種酒樣質譜數據進行分析后繪制的OPLS-DA得分圖如圖2(a)所示,沿橫坐標方向可以看出,1915酒樣分布在置信區間左側,GB酒樣分布在置信區間右側,兩酒樣組間分離明顯,沿縱坐標方向可以看出,GB酒樣組間差異度較大,這與PCA分析結果相一致,PC1、PC2兩者累計可解釋差異86.5%。OPLS-DA模型驗證圖2(b)顯示,R2X=0.865,R2Y=0.999,Q2=0.991,即模型符合要求,具備出色的預測能力[15]。

圖2 OPLS-DA得分圖和模型驗證圖
2.2.3 差異揮發性成分篩選
基于OPLS-DA結果,采用將差異倍數值FC、P值與OPLS-DA模型的變量重要性投影VIP值相結合的方法進行差異成分篩選,凡滿足FC≥2,FC≤0.5,P<1和VIP≥1任一條件,即認為該成分在兩酒樣組間存在顯著差異。據此標準,GB與1915酒樣數據結果經篩查共得到12類79個差異顯著的揮發性成分(表1),占共有物質(229個)的34.50%。其中差異較多的成分分別為酯(19個)、雜環化合物(16個)和芳烴(14個)3類物質,分別占比24.05%、20.25%和17.72%,累計占差異成分總數的62.03%。
2.3 酒樣揮發性差異成分分析
2.3.1 差異成分聚類熱圖分析為更直觀地觀察差異成分的變化規律,采用等方差縮放(Unit Variance Scaling,UV)方法對各變量進行歸一化處理,進而運用R軟件的Pheatmap程序繪制GB與1915酒樣組間差異成分聚類熱圖,結果如圖3所示。經統計,79個差異成分中,1915酒樣有26個揮發性成分相對含量顯著高于GB酒樣,占79個差異成分的32.91%,53個揮發性成分相對含量顯著低于GB酒樣,占79個差異成分的67.09%。

圖3 差異成分聚類熱圖
2.3.2 差異成分分析
對GB和1915兩種酒樣差異成分的差異倍數進行對數處理(log2FC),含量差異較大的前20個成分見表2。與GB相比,1915酒樣中的2-二甲基-4-乙烯基-1-苯、(2,2-二乙氧基乙基)-苯、1,2,3,4-四氫-2,6-二甲基萘、2-萘酚、4-十一烷酮、(Z)-6-十五碳烯-2-酮、4-十三烷酮、2,4,6-三(1-甲基乙基)苯酚、3-甲基-2(3H)-苯并呋喃酮以及苯乙醛的相對含量明顯較高;4-甲基-2-(2-甲基丙基)-1,3-二氧戊環、異戊基二甲基吡嗪、吡咯、2,3-二甲基-5-[(甲硫基)丙基]吡嗪、甲基丁酸乙酯、2-O-庚-4-基1-O-(2-甲基丙基)苯-1,2-二羧酸酯、N-(1-甲基乙基)-苯甲胺、萘、3-甲醛以及1-(2,4-二羥基苯基)-乙酮的相對含量明顯較低。
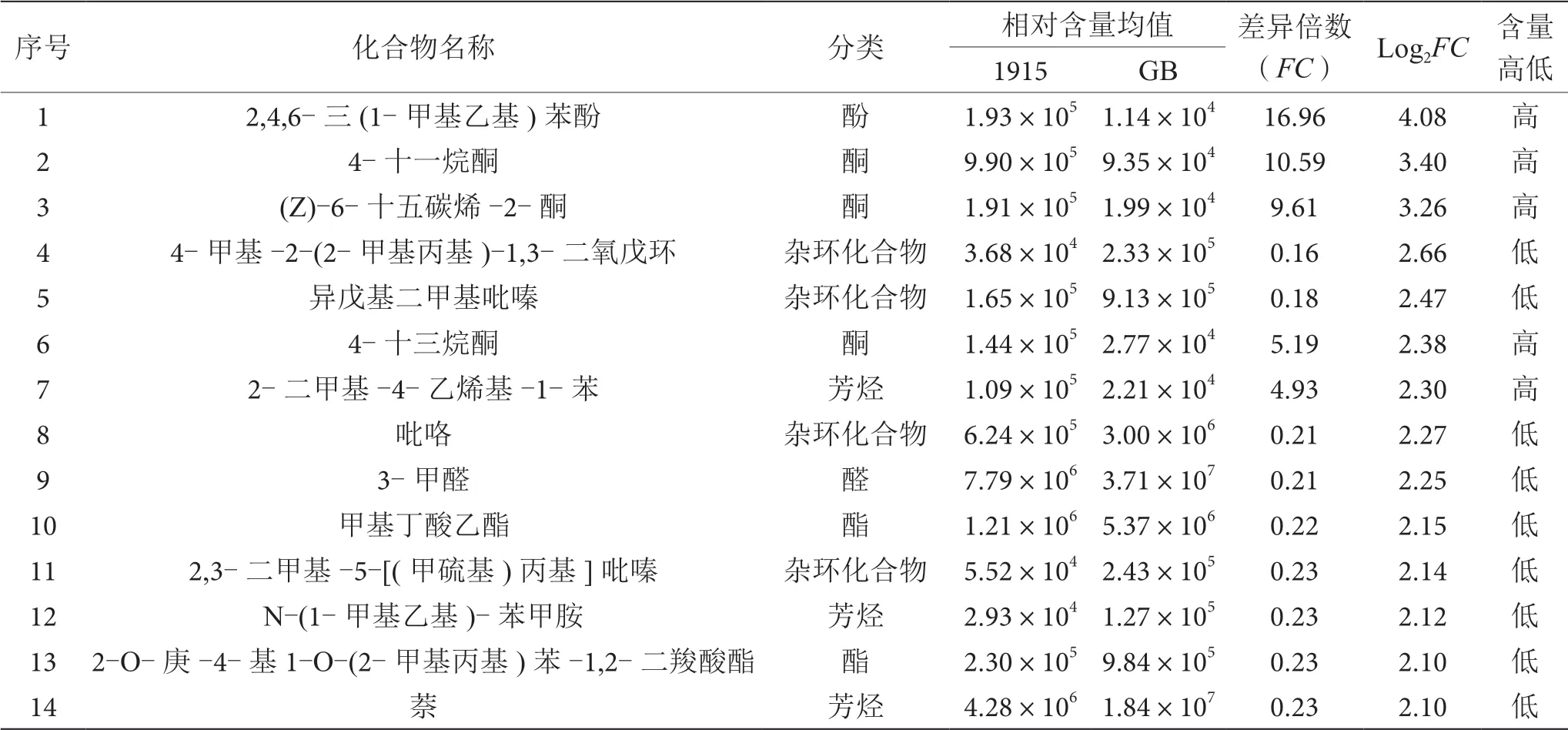
表2 GB和1915酒樣含量差異最大的20個成分表

續表2
3 結論
白酒風味物質種類繁多,含量甚微,傳統的單一手段難以準確快速地完成樣品(組)間的差異判定與成分篩選。本研究將HS-SPME-Arrow-GC-MS檢測手段與代謝組學技術結合應用于不同白酒揮發性組分差異分析中。經比對,兩種醬香型白酒檢出成分的種類、數量高度一致,酯類物質占比超35%。主成分分析結果顯示,兩酒樣組間可視化差異明顯,1915酒樣組內相似度更高,提取到的PC1、PC2和PC3累計可解釋差異達92.73%。基于OPLS-DA建立的差異成分識別模型,229個檢出成分中共篩選出12類79個差異成分,酯類、雜環化合物和芳烴為差異個數最多的3類成分,1915酒樣中26個差異成分相對含量高于GB。通過對酒樣組間差異成分的倍數進行對數處理明確得出了差異最大的前20個成分。本研究建立的不同白酒揮發性成分差異分析方法高效可行,結果可視化效果佳,可為白酒的真偽鑒別和品質評定提供理論依據與實踐參考。

