急性髓系白血病患者伊達比星聯合阿糖胞苷化療預后的相關因素
羅泉芳 王薇
作為臨床治療急性髓系白血病(acute myeloid leukemia,AML)的常用化療方案,阿糖胞苷(IA方案)具有較好的臨床療效,且中樞神經毒性較小,安全性較好[1]。但研究顯示,部分AML患者經IA方案化療后,效果并不理想,增加復發風險[2]。而研究指出,與初發性AML相比,復發性AML患者經化療治療后,臨床有效率更低,病死風險更高,預后相對較差[3]。因此分析AML患者經IA方案化療治療預后的影響因素,并采取針對性治療措施,對降低患者疾病復發、延長患者生存時間具有重要臨床意義。鑒于此,本研究就AML患者經IA方案化療治療預后不良的影響因素做以下分析。
1 資料與方法
1.1 一般資料 回顧性分析,收集2018年12月至2020年3月廣西壯族自治區南溪山醫院收治的經IA方案化療且完成12個月隨訪的57例預后不良AML患者資料,納入預后不良組;收集同期醫院收治的經IA方案化療且完成12個月隨訪的57例預后良好AML患者資料,納入預后良好組。2組一般資料比較有可比性。見表1。

表1 一般資料比較 n=57
1.2 納入與排除標準
1.2.1 納入標準:①AML符合《成人急性髓系白血病(非急性早幼粒細胞白血病)中國診療指南(2011年版)》[4]中相關診斷標準;②法美英(France,America,Britain,FAB)分型[5]為M0~M2,M4~M6型;③全部患者均為初發AML,且接受IA方案化療;④患者病歷資料、實驗室檢查完善。
1.2.2 排除標準:①入組前接受過AML相關治療;②急性早幼粒細胞白血病(M3);③合并嚴重心腦血管疾病、肝腎功能衰竭;④合并其他系統惡性腫瘤,如消化系統、呼吸系統等;⑤合并其他血液系統疾病,如骨髓增生性疾病、慢性白血病、貧血等;⑥存在嚴重感染。
1.3 方法
1.3.1 基線資料收集:查閱患者病歷資料,記錄患者年齡、性別(男、女)、合并癥[糖尿病:空腹血糖≥7.0 mmol/L,和(或)隨機血糖≥11.1 mmol/L;高血壓:舒張壓≥90 mm Hg,和(或)收縮壓≥140 mm Hg]、是否為原發性AML(繼發性AML:在骨髓異常增生綜合征后發生,或有特定的職業、環境接觸史)、AML分型(根據骨髓涂片檢查結果,并參照《內科學》[5]中FAB形態學標準進行分型,包括M2/M4與M0/M1/M5/M6)。
1.3.2 實驗室指標檢測:治療前采集患者空腹靜脈血10 ml,分裝于2支試管中:①血常規指標:使用BT-3000型血細胞分析儀(湖南遠真醫療科技有限公司)測定患者初始白細胞計數(white blood cell count,WBC)、血紅蛋白(hemoglobin,Hb)、血小板計數(platelet count,PLT)。②血管內皮生長因子(vascular endothelial growth factor,VEGF):剩余5 ml血液樣本,離心分離15 min(離心半徑10 cm,離心轉速3 000 r/min),留取血清待檢;采用酶聯免疫吸附法測定血清VEGF水平,試劑盒購自上海仁捷生物科技有限公司。嚴格按照試劑盒要求進行操作。
1.3.3 免疫分型、基因突變類型:采用腰椎穿刺術采集患者骨髓待檢:①免疫分型:取適量骨髓樣本經肝素抗凝后,使用EasyCell 104A0型流式細胞儀(深圳唯公生物科技有限公司)測定患者白細胞中CD11b、CD34;陽性標準:CD11b、CD34≥20%。②基因突變類型:取剩余骨髓樣本提取其中DNA(引物序列:F:GCAATTTAGGTATGAAAGCCAGC;R:CTTTCAGCATTTTGACGGCAACC),使用PCR法擴增Fms樣酪氨酸激酶-3(Fms like tyrosine kinase-3,FLT-3)中的14、15號內部串聯復制(Internal tandem duplication,ITD),使用瓊脂糖凝膠(含Gold View核酸染色劑)進行電泳,檢測FLT-3-ITD突變。
1.4 預后評估及分組 所有患者經IA化療方案治療后均接受12個月隨訪,所有患者于治療結束后3、6、9及12個月回院復診,記錄患者AML復發及病死情況;每次復診時對存活的患者進行生化檢查,若發現異常,及時行骨髓細胞學、形態學檢查明確復發情況;根據患者復發、病死情況,將患者分為預后不良組(復發、病死)與預后良好組。
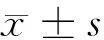
2 結果
2.1 2組基線資料、實驗室指標比較 預后不良組患者初始WBC、VEGF水平高于預后良好組,CD11b陽性、CD34陽性、FLT-3-ITD突變型占比高于預后良好組,差異有統計學意義(P<0.05);組間其他資料比較差異無統計學意義(P>0.05)。見表2。

表2 實驗室指標比較 n=57
2.2 AML患者經IA化療治療預后的單項回歸分析 將AML患者經IA化療治療預后作為因變量(1=預后不良,0=預后良好),將結果2.1中差異有統計學意義的變量納入作為自變量,經單項logistics回歸分析,結果顯示,初始WBC高水平、VEGF高水平、CD11b陽性、CD34陽性、FLT-3-ITD突變型是AML患者經IA方案化療治療預后不良的危險因素(OR>1,P<0.05)。見表2、3。

表2 變量賦值說明

表3 AML患者經IA化療治療預后的單項回歸分析
2.3 AML患者經IA化療治療預后的多項回歸分析 將AML患者經IA化療治療預后作為因變量(1=預后不良,0=預后良好),將結果2.1中差異有統計學意義的變量(將P值放寬至<0.1)納入作為自變量,經多項logistics回歸分析,結果顯示,初始WBC高水平、VEGF高水平、CD11b陽性、CD34陽性、FLT-3-ITD突變型是AML患者經IA方案化療治療預后不良的危險因素(OR>1,P<0.05)。見表4。

表4 AML患者經IA化療治療預后的多項回歸分析
3 討論
IA方案目前已廣泛應用于AML的臨床治療中,但由于多藥耐藥、凋亡通路阻斷等機制,導致部分患者化療后發生白血病復發,影響患者預后[6]。萬偉等[7]研究中84例AML患者經標準化療方案治療后,1年總生存率為35.30%,5年總生存率為12.60%。說明AML患者經標準化了方案治療預后較差。因此,對AML患者經IA方案化療治療預后的影響因素進行分析,對改善患者預后尤為重要。本研究通過對比不同預后AML患者資料,將可能的因素納入,并經Logistic回歸分析結果顯示,初始WBC高水平、VEGF高水平、CD11b陽性、CD34陽性、FLT-3-ITD突變型是AML患者經IA方案化療治療預后不良的危險因素。
3.1 初始WBC高水平 初始WBC升高后會對血管造成浸潤,并破壞血管壁,引起腦出血、消化道出血等嚴重并發癥,增加患者病死風險[8]。同時初始WBC升高還會使患者在化療期間,導致白細胞停滯綜合征的發生,且白細胞易在微循環中形成血栓,阻塞血管,導致臟器缺血,影響患者預后[9]。孟廣強等[10]研究指出老年高白細胞AML患者早期病死率、治療8周病死率均高于非高白細胞AML患者,提示初始WBC升高可增加AML患者病死風險。對此建議,臨床應在疾病早期及化療期間,密切監測AML患者初始WBC,發現異常及時采取治療措施降低患者白細胞,采取個體化的誘導化療,以改善患者預后。
3.2 VEGF高水平 VEGF水平升高可通過自分泌途徑,影響化療藥物對白血病細胞的殺滅作用,提高了白血病細胞的耐藥性,進而影響治療效果,不利于患者預后[11]。同時VEGF還會對內皮細胞產生刺激,并與白血病細胞膜受體結合,促進血管內皮增殖,對白血病的進展起到間接促進作用,增加患者預后不良風險[12]。此外,VEGF還可促進白細胞介素6、粒細胞集落刺激因子等細胞因子分泌,對白血病細胞的增殖產生促進作用,增加疾病復發風險[13]。因此,臨床應在早期檢測患者VEGF水平。
3.3 基因突變類型 FLT-3-ITD屬于FLT-3基因突變類型,當FLT異常活化后,可導致細胞因子非依賴性細胞增殖[14]。同時ITD可對近膜結構域的自抑作用造成影響,并干擾近膜結構域的負調節作用,改變FLT-3受體的結構,信號轉導級聯被激活,進而抑制造血干細胞的增殖、活化,引起疾病復發,患者預后不良[15]。研究指出,與其他基因突變型AML患者相比,FLT-3-ITD基因突變型AML患者經化療后預后相對更差[16]。因此,針對FLT-3-ITD基因突變型AML患者,應采取分層個體化治療,或采用同種異基因造血干細胞移植,以降低患者復發風險,延長患者總生存期。
3.4 免疫表型 免疫學分型能反映AML患者細胞克隆的分化階段,對白血病細胞的系別進行鑒定。其中CD11b主要表達于粒細胞、自然殺傷細胞及白血病原始細胞中,為細胞間黏附分子[17]。CD11b可促使白血病細胞緊密的結合骨髓基質細胞,并促進白血病細胞增殖,進而導致化療治療失敗,增加患者預后不良風險[18]。CD34主要在分化較差的白血病亞型中表達,CD34+細胞多耐藥基因產物可促使化療藥物排除細胞外,導致化療藥物耐藥性增加,影響患者治療效果及預后[19]。此外,CD34還與細胞-基質黏附有關,可增強白血病細胞胞體與基質的黏附能力,增強白細胞細胞的侵襲與轉移,導致化療后復發風險增加,影響患者預后[20,21]。因此,對于高危免疫表型患者,應根據具體情況制定針對性化療方案,同時可采用中醫藥輔助治療,提高患者化療效果,有利于改善患者預后。
綜上所述,AML患者經IA方案化療治療預后不良可能受初始WBC、VEGF水平、免疫表型、基因突變類型的影響,臨床應重點關注上述因素,早期采取相應的治療措施,對降低患者AML復發、提高患者總生存期具有重要臨床意義。

