miR-338-5p調控TRPC1對瘢痕疙瘩成纖維細胞增殖及膠原合成的影響
馬亞軍 吳寶恩 任可一 高秋芳 蘭阿峰
瘢痕疙瘩常生長于正常皮膚上擴張超過原始傷口的邊緣,并伴有疼痛、畸形等癥狀,瘢痕疙瘩復發率高且術后畸形偏多,因而急需研發新型治療方法[1,2]。miRNA可參與瘢痕疙瘩成纖維細胞增殖等生物學過程[3,4]。miR-338-5p通過靶向FERMT2抑制食道鱗狀細胞的細胞增殖、集落形成及遷移[5]。但miR-338-5p對瘢痕疙瘩成纖維細胞生物學行為的影響尚未闡明。Targetscan7.2預測顯示miR-338-5p與TRPC1存在結合位點,研究發現TRPC1在結腸癌中表達水平升高,并可能參與結腸癌發生過程[6]。但miR-338-5p是否可調控TRPC1表達而影響瘢痕疙瘩成纖維細胞增殖以及膠原合成尚未可知。因此,本研究主要探討瘢痕疙瘩成纖維細胞中miR-338-5p與TRPC1的表達及其對瘢痕疙瘩成纖維細胞增殖及膠原合成的影響及其作用機制。
1 材料與方法
1.1 材料與試劑 收集2018年3月至2019年5月于本院皮膚科、眼耳鼻喉科、普外科體表皮膚瘢痕疙瘩30例患者的瘢痕疙瘩標本,同時收集30例皮脂腺囊腫周邊的正常皮膚組織,參照文獻[7]分離培養正常皮膚成纖維細胞NFB與人瘢痕疙瘩成纖維細胞KFB。Lipofectamine2000試劑、Trizol試劑購自美國Invitrogen;反轉錄與SYBR Green試劑購自北京天根生化;miR-NC、miR-338-5p mimics、anti-miR-NC、anti-miR-338-5p購自廣州銳博生物;pcDNA購自上海吉瑪制藥;MTT試劑購自北京索萊寶;兔抗人TRPC1抗體購自武漢艾美捷;兔抗人CyclinD1購自美國Santa Cruz;兔抗人Col-Ⅰ、Col-Ⅲ抗體購自美國Proteintech;二抗購自美國Abcam。
1.2 方法
1.2.1 實驗分組:取對數生長期KFB細胞(2.5×105個/ml)接種于96孔板(100 μl/孔),miR-NC、miR-338-5p mimics、pcDNA-NC、pcDNA-TRPC1、miR-338-5p mimics與pcDNA-NC、miR-338-5p mimics與pcDNA-TRPC1轉染入KFB細胞,于培養箱內繼續培養48 h后收集細胞,分別記為miR-NC組、miR-338-5p組、pcDNA-NC組、pcDNA-TRPC1組、miR-338-5p+pcDNA-NC組、miR-338-5p+pcDNA-TRPC1組。同時將正常培養的KFB細胞作為NC組。
1.2.2 qRT-PCR檢測細胞中miR-338-5p、TRPC1 mRNA的表達水平:采用Trizol法提取NFB、KFB細胞與轉染后的各組KFB細胞總RNA,RNA反轉錄合成cDNA,以cDNA為模板進行qRT-PCR擴增體系按照試劑盒說明書操作,應用美國ABI StepOnePlus實時熒光定量PCR儀檢測miR-338-5p、TRPC1 mRNA相對表達量。
1.2.3 MTT檢測細胞增殖:收集各組KFB細胞(1×105個/ml)接種于96孔板(100 μl/孔),每孔加入20 μl MTT溶液,將其置于培養箱內繼續培養4 h后棄上清,每孔加入150 μl DMSO,室溫避光孵育5 min后應用酶標儀檢測各孔吸光度值(A值)。
1.2.4 雙熒光素酶報告基因檢測miR-338-5p與TRPC1的靶向關系:Targetscan7.2預測顯示miR-338-5p與TRPC1存在結合位點,構建野生型載體TRPC1-3’UTR-WT、突變型載體TRPC1-3’UTR-MUT,miR-NC、miR-338-5p mimics分別與TRPC1-3’UTR-WT、TRPC1-3’UTR-MUT共轉染入KFB細胞,將其置于培養箱內繼續培養24 h后收集細胞并檢測相對熒光素酶活性。
1.2.5 Western blot檢測TRPC1、CyclinD1、Col-Ⅰ、Col-Ⅲ蛋白表達:收集NFB、KFB細胞與轉染后各組KFB細胞加入400 μl RIPA裂解液提取細胞總蛋白,將5×SDS上樣緩沖液加入其中后置于沸水中煮10 min,蛋白變性,取40 μg蛋白樣品進行SDS-PAGE電泳反應,將分離的蛋白凝膠轉移至PVDF膜后使用5%脫脂奶粉封閉2 h,加入1∶1 000稀釋比的一抗與內參一抗(1∶1 000),加入1∶5 000稀釋比的二抗,滴加ECL,暗室內曝光顯影,應用ImageJ軟件分析各條帶灰度值。
2 結果
2.1 人瘢痕疙瘩成纖維細胞中,miR-338-5p、TRPC1的表達情況 與NFB細胞比較,KFB細胞中miR-338-5p的表達水平降低(P<0.05),TRPC1 mRNA及蛋白水平升高(P<0.05)。見圖1,表1。
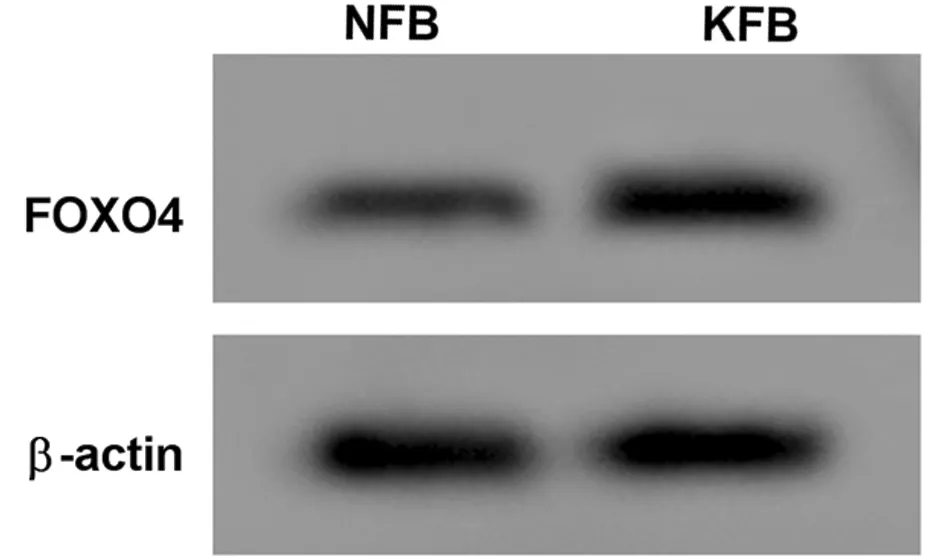
圖1 Western Blot檢測TRPC1
表1 人瘢痕疙瘩成纖維細胞中 miR-338-5p和TRPC1表達量
2.2 高表達miR-338-5p抑制瘢痕疙瘩成纖維細胞增殖和膠原合成 與miR-NC組比較,miR-338-5p組細胞活力降低(P<0.05),CyclinD1、Col-Ⅰ、Col-Ⅲ蛋白水平降低(P<0.05)。見表2,圖2。
表2 低表達miR-338-5p對瘢痕疙瘩成纖維細胞增殖和凋亡的影響
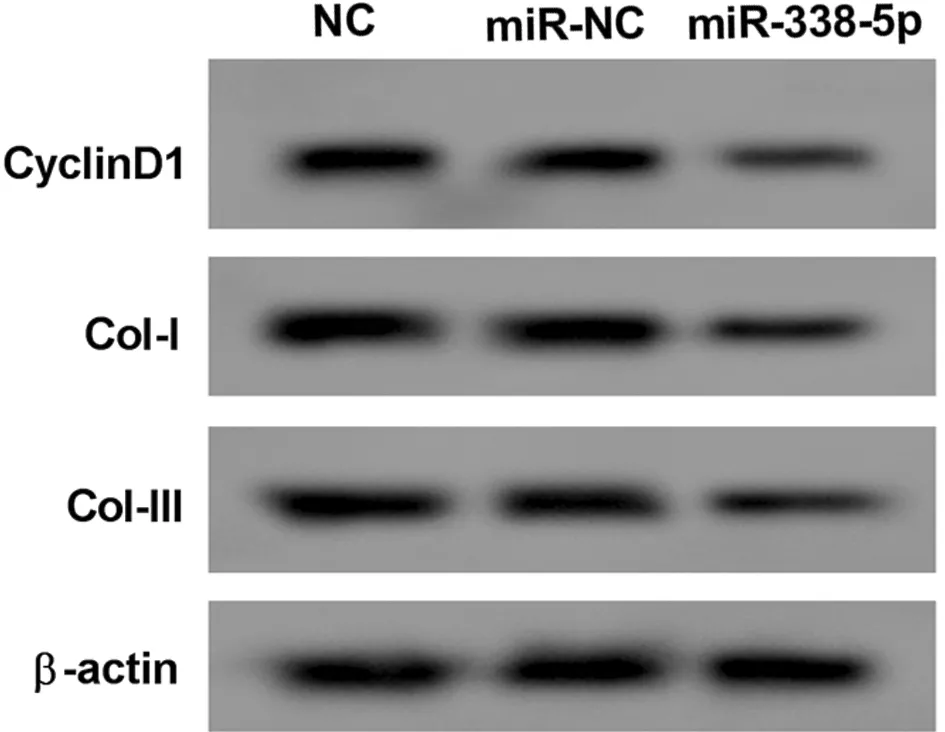
圖2 Western Blot檢測CyclinD1、Col-Ⅰ、Col-Ⅲ蛋白的表達
2.3 高表達TRPC1促進人瘢痕疙瘩成纖維細胞增殖和膠原合成 與pcDNA-NC組比較,pcDNA-TRPC1組細胞活力升高(P<0.05),CyclinD1、Col-Ⅰ、Col-Ⅲ蛋白水平升高(P<0.05)。見圖3,表3。
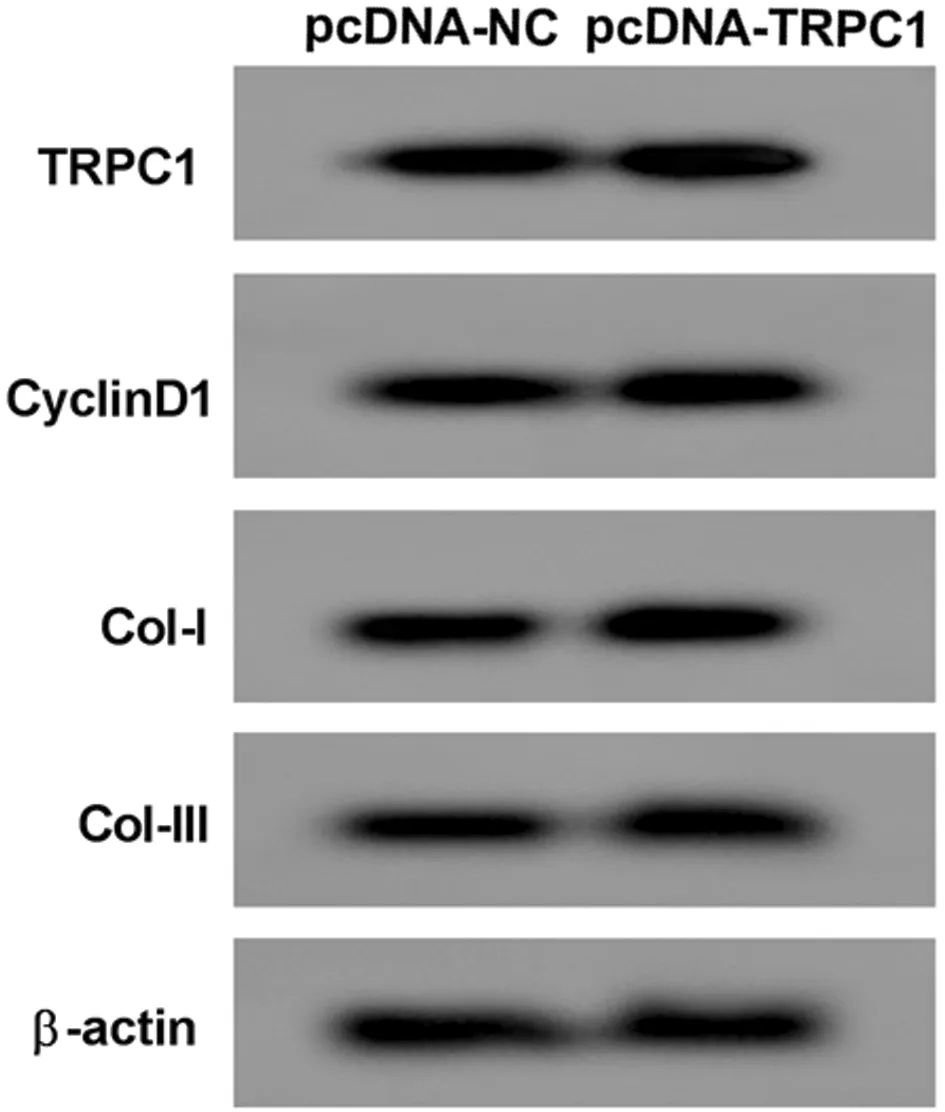
圖3 Western Blot檢測TRPC1、CyclinD1、Col-Ⅰ、Col-Ⅲ蛋白的表達
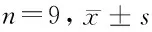
表3 高表達TRPC1促進人瘢痕疙瘩成纖維細胞增殖和膠原合成
2.4 miR-338-5p靶向TRPC1 Targetscan7.2預測顯示miR-338-5p與TRPC1存在結合位點。miR-338-5p過表達可降低野生型載體TRPC1-3’UTR-WT的熒光素酶活性(P<0.05),而對突變型載體TRPC1-3’UTR-MUT的熒光素酶活性無明顯影響(P>0.05)。與miR-NC組比較,miR-338-5p組TRPC1蛋白水平降低(P<0.05);與anti-miR-NC組比較,anti-miR-338-5p組TRPC1蛋白水平升高(P<0.05)。見表4、5,圖4。
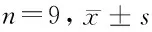
表4 miR-NC或miR-338-5p與TRPC1-3’UTR野生型及突變型報告質粒共轉染瘢痕疙瘩成纖維細胞瘢痕疙瘩成纖維細胞后雙熒光素酶活性檢測
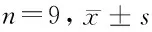
表5 Western Blot檢測TRPC1 的表達
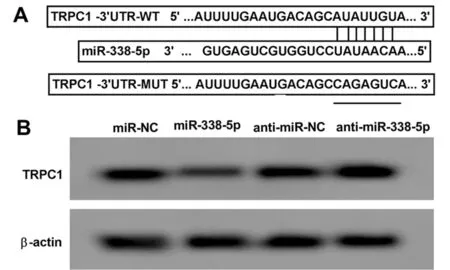
圖4 miR-338-5p靶向TRPC1;A Targetscan7.2對TRPC1和miR-338-5p結合進行預測示意圖;B Western Blot檢測TRPC1蛋白的表達
2.5 高表達TRPC1可以逆轉miR-338-5p高表達對瘢痕疙瘩成纖維細胞增殖和膠原合成的抑制作用 與miR-338-5p+pcDNA-NC組比較,miR-338-5p+pcDNA-TRPC1組細胞活力升高(P<0.05),CyclinD1、Col-Ⅰ、Col-Ⅲ蛋白水平升高(P<0.05)。見圖5,表6。
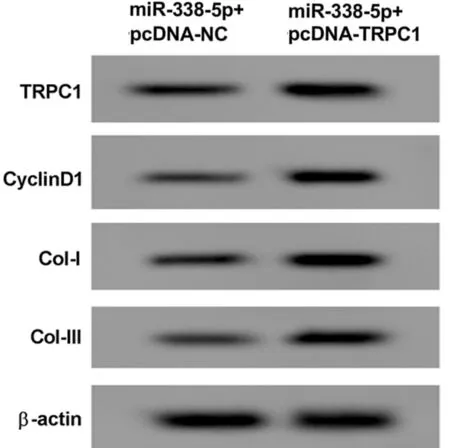
圖5 Western Blot檢測TRPC1、CyclinD1、Col-Ⅰ、Col-Ⅲ蛋白表達
表6 高表達TRPC1可以逆轉miR-338-5p高表達對瘢痕疙瘩成纖維細胞增殖和膠原合成的抑制作用
3 討論
研究證實,miRNA在瘢痕疙瘩中表達異常并可參與瘢痕疙瘩的發生及發展過程,還可能作為瘢痕疙瘩潛在的治療靶標,例如,miR-21通過靶向FasL,通過caspase-8和線粒體介導的凋亡信號通路調節瘢痕疙瘩成纖維細胞的凋亡[8]。miR-181a靶向PHLPP2以增強AKT信號傳導并調節瘢痕疙瘩成纖維細胞的增殖和凋亡[9]。miR-152-5p通過調節Smad3的表達而抑制瘢痕疙瘩成纖維細胞增殖和遷移并促進凋亡[10]。但仍有部分miRNA在瘢痕疙瘩形成過程中的作用機制尚未闡明。
miR-338-5p通過靶向ADAMTS-9而抑制類風濕關節炎滑膜成纖維細胞的增殖和侵襲[11]。miR-338-5p通過直接靶向EFEMP1抑制膠質母細胞瘤細胞的增殖、遷移、侵襲并促進其凋亡[12]。但miR-338-5p在瘢痕疙瘩成纖維細胞中的表達尚未可知。本研究結果提示miR-338-5p在瘢痕疙瘩形成過程中可能發揮調控作用,miR-338-5p過表達可抑制瘢痕疙瘩成纖維細胞增殖。Col-Ⅰ、Col-Ⅲ是細胞外基質的主要成分,抑制Col-Ⅰ、Col-Ⅲ的表達可有效減少細胞外基質的沉積[13,14]。本研究結果顯示miR-338-5p過表達可能通過抑制膠原蛋白合成從而抑制瘢痕疙瘩的形成。
本研究證實miR-338-5p可靶向結合TRPC1,并可負向調控TRPC1的表達。TRPC1/3/6抑制通過Ras/Raf1/ERK信號通路減弱TGF-β1誘導的胃癌上皮-間質轉化[15]。TRPC1在多發性骨髓瘤、嬰兒血管瘤等腫瘤中表達上調,并可能參與腫瘤發生及發展過程[16,17]。本研究結果提示TRPC1過表達可促進瘢痕疙瘩成纖維細胞增殖以及膠原合成。同時本研究采用miR-338-5p過表達與TRPC1過表達聯合處理瘢痕疙瘩成纖維細胞,結果提示TRPC1過表達可明顯逆轉miR-338-5p過表達對瘢痕疙瘩成纖維細胞增殖以及膠原合成的作用。
綜上所述,瘢痕疙瘩成纖維細胞中miR-338-5p的表達水平降低,而TRPC1的表達水平升高,miR-338-5p過表達可通過下調TRPC1表達而抑制瘢痕疙瘩成纖維細胞增殖及膠原蛋白合成從而抑制瘢痕疙瘩的形成,可為進一步揭示瘢痕疙瘩形成的分子機制奠定實驗基礎,miR-338-5p/TRPC1還可能作為瘢痕疙瘩治療的潛在靶標。

