POU3F2在膠質瘤中的表達及其臨床意義
周洛文 王俊文 舒凱 徐鈺
膠質瘤在所有成人顱內惡性腫瘤中的占比接近60%,是最常見的原發性中樞神經系統腫瘤[1]。目前,對膠質瘤的治療主要為以手術切除為主,輔之以放、化療等綜合治療手段。因為膠質瘤的惡性生物學特性,在改善膠質瘤病人的預后方面仍未取得重大突破性進展[2]。POU3F2編碼八聚體結合轉錄因子7(OCT-7),OCT-7是一種中樞神經系統表達特異性轉錄因子,其異常表達與腫瘤干細胞的干細胞樣表型維持有密切關系[2-4]。惡性腫瘤的復發以及其抵抗放化療的能力可能與腫瘤干細胞存在密切關系。有研究指出,有包括 POU3F2 在內的 19種神經發育相關性的轉錄因子參與了維持膠質瘤干細胞的干細胞樣表型并阻止其分化[5-8]。我們以CGGA數據庫作為基礎,分析POU3F2在膠質瘤中的表達并進行驗證,探討其臨床意義。
對象與方法
一、對象
通過CGGA數據庫(http://www.cgga.org.cn/)下載最新的325例膠質瘤mRNAseq的轉錄組數據及臨床信息。其中,WHO Ⅱ級膠質瘤病人109例,Ⅲ級與Ⅳ級分別為72例與144例。臨床樣本來自2018~2020年我院神經外科住院手術的40例膠質瘤病人,其中低級別膠質瘤組(WHO Ⅰ~Ⅱ級)與高級別膠質瘤組(WHO Ⅲ~Ⅳ級)各20例。
二、方法
1.免疫組化染色檢測POU3F2表達:采用免疫組化染色檢測POU3F2蛋白表達,手術切除的腦膠質瘤組織樣本10%甲醛溶液固定,然后脫水,石蠟包埋,切片,切片厚度為600 μm,POU3F2抗體稀釋工作濃度1∶200。結果判讀采用半定量法,每張切片隨機取5個高倍鏡視野,根據細胞核處染色強度取0,1,2的三分制進行評分并取均值,由兩名病理醫生單獨評分。
2.生信數據分析:使用R語言ggpubr包分析POU3F2表達量與膠質瘤WHO分級、膠質瘤分子標志物以及膠質瘤分子亞型的對比組合并繪制箱線圖,使用R語言pROC包對POU3F2預測膠質瘤分子亞型進行分析并繪制ROC曲線,使用R語言survival包對POU3F2高表達組與低表達組病人進行Kaplan-Meier生存分析。
三、統計學方法
POU3F2蛋白表達積分差異采用t檢驗,POU3F2基因表達水平的比較采用Kruskal-Wallis單因素方差分析,采用ROC曲線分析POU3F2基因表達經典型的預測價值,采用Kaplan-Meier生存曲線比較分析POU3F2表達量與膠質瘤預后之間的關系。P<0.05為差異有統計學意義,由R語言編程直接繪圖并完成統計學分析。
結果
1.POU3F2在高級別膠質瘤中表達上調,在1p19q聯合缺失膠質瘤中表達下調:提取CGGA數據庫中POU3F2的基因表達水平的數據,基于數據集提供的臨床信息分為WHO Ⅱ級與WHO Ⅲ級和Ⅳ級,繪制各組中POU3F2表達水平的箱線圖(圖1A)。可見在低級別膠質瘤組(WHO Ⅱ級)中,POU3F2的表達量較之高級別膠質瘤組(WHO Ⅲ~Ⅳ級)相對更低,差異有統計學意義(P<0.01)。POU3F2在不存在染色體1p19q聯合缺失的分組中的表達傾向上調,且與染色體1p19q聯合缺失分組差異顯著,差異有統計學意義(圖1B,P=0.003 1)。
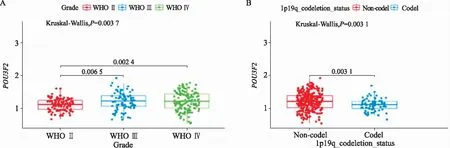
A.POU3F2在低級別膠質瘤組(WHO Ⅱ級)與高級別膠質瘤組(WHO Ⅲ~Ⅳ級)中的表達分布;B.POU3F2在膠質瘤1p19q共缺失組及非共缺失組中的表達分布
對POU3F2蛋白在膠質瘤中的表達進行免疫組化染色檢測,可見低級別組(圖2A)POU3F2蛋白的表達水平低于高級別膠質瘤組(圖2B),半定量分析結果(圖2C)亦提示高級別膠質瘤組切片中POU3F2表達水平半定量得分高于低級別組,差異有統計學意義(P<0.05)。
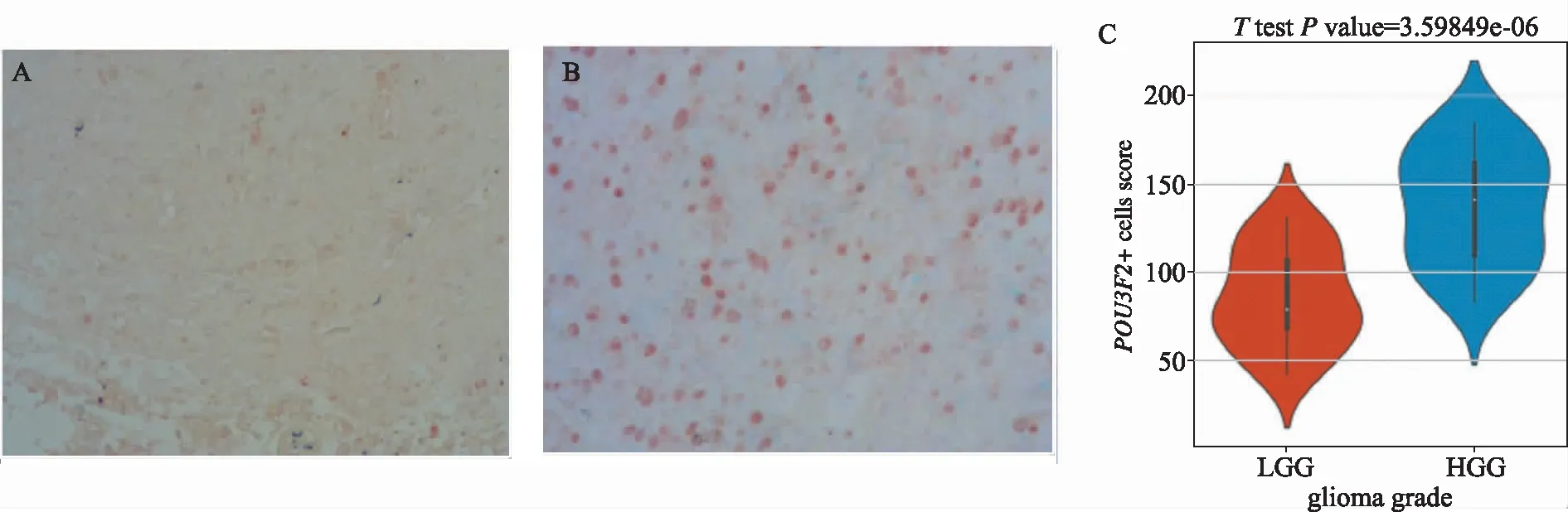
A.低級別膠質瘤組;B.高級別膠質瘤組;C.POU3F2免疫組化半定量分析
2.POU3F2在經典型膠質瘤高表達,與膠質瘤預后相關:基于癌癥基因組圖譜(TCGA)所定義的四種分子亞型:經典型(classical),間質型(mesenchymal),神經元型(neural)以及前神經元型(proneural),對數據樣本進行重分組并繪制箱線圖(圖3A),可見在本組數據集中,POU3F2在經典型膠質瘤中的表達水平最高,且對比其他三種分子亞型差異明顯(P<0.000 1)。繪制POU3F2基因表達預測經典型的ROC曲線(圖3B),以評估POU3F2在此亞型中的預測能力。可見ROC曲線下的面積(Area Under Curve,AUC)為0.784,這提示POU3F2有作為潛在的預測膠質瘤經典型分子標志物的價值。

A.POU3F2在膠質瘤TCGA 4種分子亞型中的表達;B.預測經典型的ROC曲線;C.不同POU3F2表達水平的膠質瘤病人的Kaplan-Meier生存曲線
應用Kaplan-Meier生存分析評估本數據集中POU3F2表達量與膠質瘤預后之間的關系,由Kaplan-Meier生存曲線(圖3C)可以看出,高表達POU3F2的膠質瘤病人總生存期更短(Log rankP=0.016)。
討論
膠質瘤是最常見的中樞神經系統腫瘤,根據WHO的分級可分為Ⅰ~Ⅳ四個等級,其惡性程度隨等級升高而升高。其中,WHO Ⅰ~Ⅱ級通常被歸于低級別膠質瘤組,WHO Ⅲ~Ⅳ級通常被歸于高級別膠質瘤組。高級別膠質瘤的生物學特性常常發生改變,表現出較高的浸潤、轉移、增殖以及血管生成等能力,其預后也較差。這種惡性生物學特性可能與腫瘤干細胞存在密切關系,腫瘤干細胞是誘導膠質瘤發生與發展,造成腫瘤復發及抵抗治療的重要原因之一。有研究發現,POU3F2有誘導已分化的膠質瘤細胞重編程為膠質瘤干細胞的能力。
本研究中,我們發現在高級別膠質瘤組的POU3F2的表達量傾向上調。免疫組化染色亦提示高級別膠質瘤組POU3F2蛋白染色陽性細胞數顯著高于低級別組。1p/19q共缺失被認為是對化療更敏感,預后更好的標志之一[9-13]。我們的研究還發現,POU3F2在1p/19q共缺失組中的表達下調,提示POU3F2的表達水平與膠質瘤的惡性程度存在關系。膠質瘤可以分為四種分子亞型,分別為經典型(classical),間質型(mesenchymal),神經元型(neural)以及前神經元型(proneural)[12-13]。一項941例惡性膠質瘤的研究指出,神經元型和前神經元型主要出現在低級別膠質瘤樣本中,而經典型和間質型更多出現在高級別膠質瘤樣本中,且生存分析發現,經典型膠質瘤的臨床預后最差[14]。本研究發現,POU3F2可用于預測分子亞型為經典型的膠質瘤,與我們對POU3F2參與惡性膠質瘤生物學機制的猜想相符。
對POU3F2的上下游調控關鍵基因進行生物信息學分析發現,SOX2和SOX21基因與POU3F2共表達,這些基因在維持膠質瘤干細胞的去分化狀態中發揮作用[15-20]。SOX2是重要的細胞重編程基因,在膠質瘤干細胞中存在異常高表達,是膠質瘤干細胞的表面分子標志物之一。SOX21則被認為可與SOX2形成復合物共同發揮作用[20]。我們推測,POU3F2基因可能通過與上述基因一起通過對膠質瘤干細胞的作用參與膠質瘤的發病。
本研究表明,膠質瘤組織中POU3F2表達量的增加與其惡性表型存在聯系。POU3F2表達量的增加提示病人預后不佳,POU3F2可望作為膠質瘤診斷和預后指標的分子標志物。POU3F2可能與神經膠質瘤干細胞增殖和維持非分化狀態有關,通過與POU3F4、SOX2、SOX9、SOX21等基因共同作用促進膠質瘤的發生。

