初中化學“溶液的濃度”項目式教學的設計與實施
李俊紅



摘要:確立項目“自制生理鹽水”,規劃4個子任務“定性認識生理鹽水”“定量認識生理鹽水”“自制生理鹽水”“構建配制一定溶質質量分數溶液的思維模型”,引發學生思維進階和遷移。項目融具體知識“溶質的質量分數及其簡單計算”的學習于實際問題的解決過程中,在“做中學”中培養學生的定量思維和實踐能力,促進學生對溶質質量分數概念的學習理解,形成定量觀和科學的物質觀,發展“科學探究”“科學態度”“模型認知”等化學學科核心素養。
關鍵詞:溶液的濃度;項目式教學;自制生理鹽水;定量思維;化學學科核心素養
文章編號:1008-0546(2021)03-0046-05???? 中圖分類號:G632.41???? 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2022.03.010
一、項目背景及內容分析
“溶液的濃度”是人教版九年級《化學》(2011年)(以下簡稱教材)下冊第九單元“溶液”課題3的教學內容,“認識溶質質量分數的含義,能進行溶質質量分數的簡單計算”是義務教育化學課程標準(2011年版)[1](以下簡稱課標)對本節課的要求。福建省近幾年的中考化學試題對學生學習“溶液的濃度”是否達到課標要求進行了考查,例如:2020年福建省中考化學13題的第2小題,題目提供了某84消毒液產品的部分說明,依據信息,要求計算將有效氯的質量分數為6.0%的 84消毒液與水的質量為1 比多少時進行稀釋,即可用于餐具消毒(有效氯的質量分數為0.04%的消毒液),結果顯示:廈門市該小題的均分為0.15分(滿分1 分)。反思平時的教學,學生有可能聽講很認真,但提不出有價值的問題;學生有可能獲得的知識點較為全面,但碰到實際問題仍不會解決;學生有可能掌握了很多解題套路,但遇到陌生情境還是不知道如何遷移應用。因此,教學如何實現知識學習和問題解決的關聯,在解決問題的過程中探查學生對原有知識的掌握程度,促進學生學習更多新的知識,探索將具體知識學習融入到真實世界實際問題解決過程的教學方式,有可能破解以上教學難題。因為學生的學習在經歷和解決真實世界的問題中最容易發生,這是項目化學習秉持的學習理念[2]。
生理鹽水是學生日常生活中熟悉的素材,通過訪談了解到:生活中學生大多見過生理鹽水,知道生理鹽水可用于輸液,想知道生理鹽水更廣泛的用途;知道生理鹽水的定性組成,想知道生理鹽水的定量組成;知道溶液有濃稀,想知道怎樣調控溶液濃稀及其實際意義。基于此,確立項目“自制生理鹽水”,項目貼近生活,真實有意義,學生感興趣,項目完成能驗證學生知道“溶液是由溶質和溶劑組成以及溶質、溶劑的判斷”,驅動學生想知道“溶液組成的定量表示以及如何配制一定溶質質量分數的溶液”,發展學生的定量思維,培養學生的實踐能力,同時完成課標規定的基礎學生實驗“一定溶質質量分數的氯化鈉溶液的配制”[1],項目設計節約教學課時又能賦實驗以實際意義(以前實驗配制的溶液倒掉了,現在配制生理鹽水能實際應用)。此外,本項目承載著“幫助學生從化學的角度認識和理解人與自然的關系,初步形成科學的物質觀和合理利用物質的意識”[1]的素養發展功能。根據學生的認知邏輯和完成項目的路徑,規劃4個子任務“定性認識生理鹽水”“定量認識生理鹽水”“自制生理鹽水”“構建配制一定溶質質量分數溶液的思維模型”,并制訂了具體的教學目標。
二、項目教學目標
1.認識溶質質量分數的含義,定量認識生理鹽水的組成,根據某溫度下物質的溶解度,會算出該物質飽和溶液中溶質的質量分數。發展定量思維和科學的物質觀(重點);
2.根據溶質質量分數的含義,會算出配制一定質
量生理鹽水所需溶質、溶劑的質量和溶劑的體積,會選擇儀器、藥品配制生理鹽水,對實驗結果有評價意識。提高學生運用知識解決實際問題的能力,發展“科學探究”“科學態度”等化學學科核心素養(重點);3.會用較濃的氯化鈉溶液稀釋成一定質量的生理鹽水,構建配制一定溶質質量分數溶液的思維模型。發展定量計算、分析推理能力以及“模型認知”等化學核心素養(難點)。
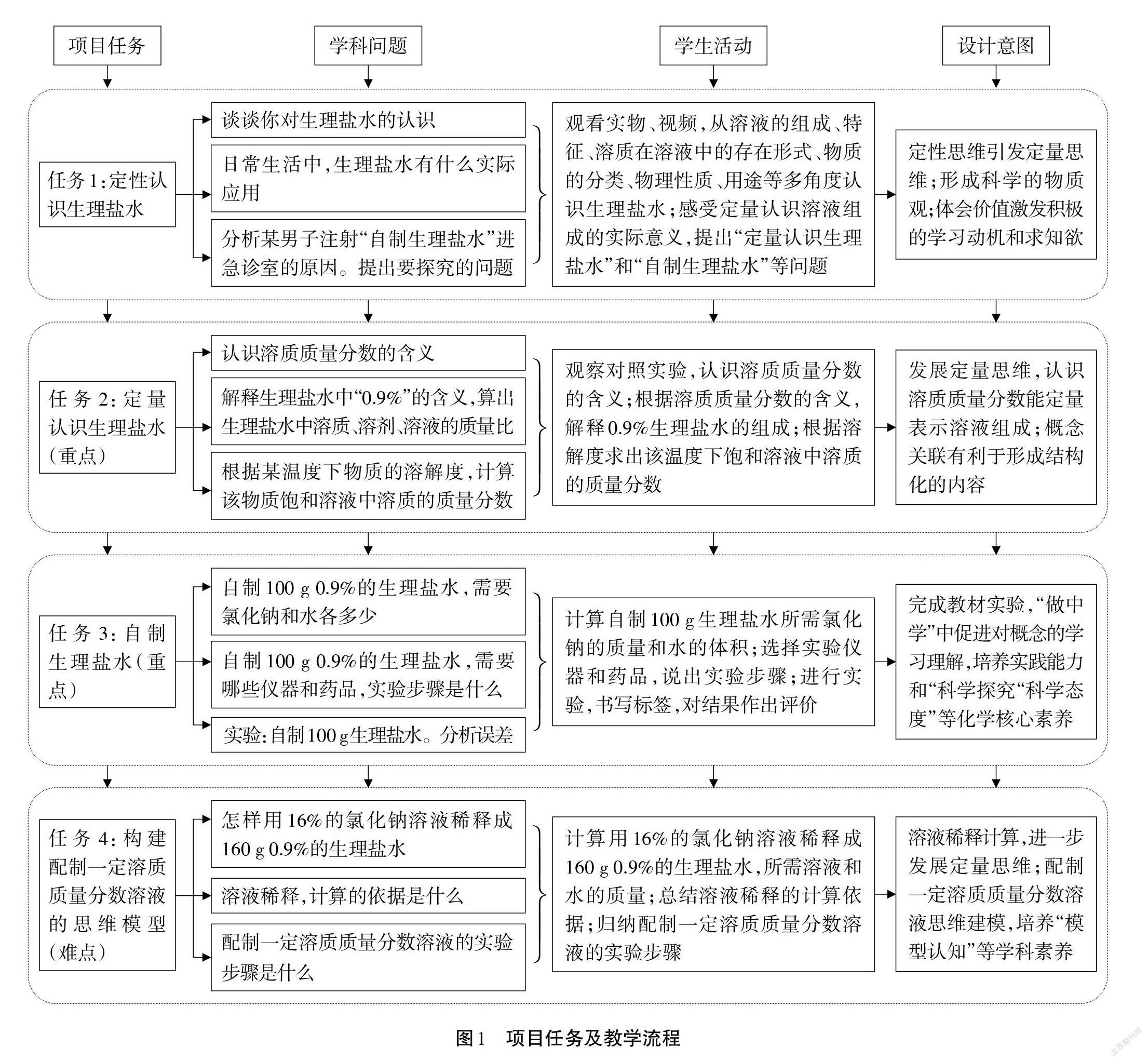
三、項目任務及教學流程
根據本項目要解決的核心問題“自制生理鹽水”,拆解成4個子任務和若干個學科問題。
項目任務、學科問題、學生活動和設計意圖[3]的邏輯關系即教學流程如圖1所示。
四、項目實施過程及學生學習成果
1.任務1:定性認識生理鹽水
【設疑】展示一瓶生理鹽水(見圖2),談談你的認識。
【學生】無色透明液體;溶液;溶質是氯化鈉,溶劑是水;氯化鈉以氯離子和鈉離子形式存在;均一性、穩定性;混合物;用于輸液。
【設疑】播放視頻:生理鹽水的作用和功效。歸納生理鹽水在日常生活中的實際應用。
【學生】用于過敏性鼻炎、慢性鼻炎、鼻竇炎患者清理鼻腔;外傷創口的清潔消毒;祛痘后的美容敷膜;夏天出汗太多補充體液;醫療上作溶劑用等。
【設疑】播放視頻:某男子注射“自制生理鹽水”進急診室。分析原因,提出要探究的問題。
【學生】沒有控制氯化鈉和水的量。提出問題:在家如何調控氯化鈉和水的量到0.9%?0.9%指的是什么?在家里如何自制安全的生理鹽水?
【小結】可見,生活中不僅需要定性認識溶液的組成,還需要定量認識溶液的組成,同一種溶液,溶液濃稀不同,性質不同。溶液中溶質、溶劑的質量決定著物質的使用,物質使用不當,有可能發生安全隱患甚至對生命造成危險。
2.任務2:定量認識生理鹽水
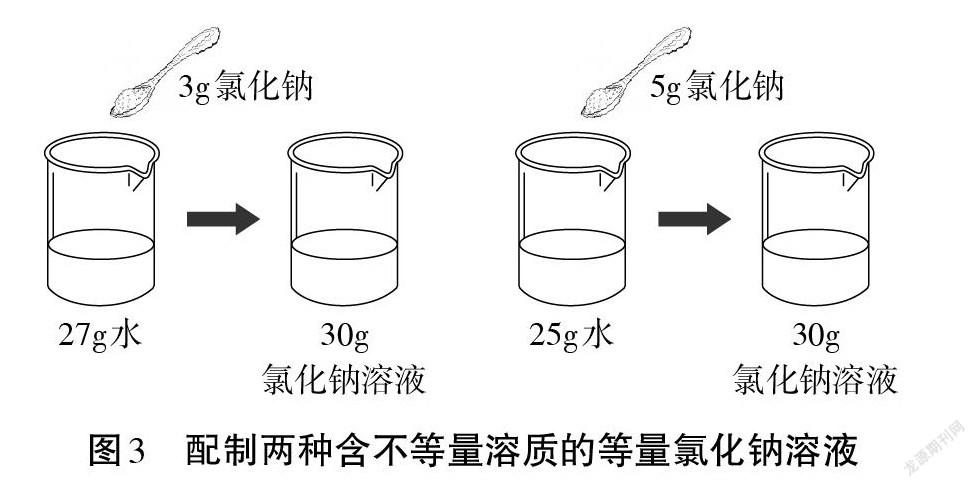
【設疑】演示實驗1(見圖3),哪個更濃?演示實驗2(見圖4),哪個更濃?為什么?
【學生】實驗1加5 g的更濃,因為等量溶液中含溶質越多的越濃。實驗2不能直接比較出溶液濃稀,得算一下溶質和溶液的質量比或溶質和溶劑的質量比。
【小結】表示溶液濃稀即溶液濃度的方法有多種。溶質和溶液質量的比值可以表示溶液的濃稀,比值越大說明溶液中溶質的相對含量越大,溶液越濃。溶質和溶液質量的比值是溶液定量組成的一種表示方法,叫溶質的質量分數。
【追問】生理鹽水(見圖2)標簽上的0.9%,表示氯化鈉溶液的濃度即溶質的質量分數。試從定量表示溶液組成的角度,解釋0.9%的含義,計算生理鹽水中溶質、溶劑、溶液的質量比。
【學生】0.9%是溶質質量和溶液質量之比,指的是每 100 g氯化鈉溶液中含0.9 g氯化鈉,根據溶液的質量=溶質的質量+溶劑的質量,所以100 g氯化鈉溶液中水的質量:100 g-0.9 g=99.1 g,故氯化鈉、水、氯化鈉溶液的質量比=0.9 g∶99.1 g ∶100 g=9∶991∶1000。
【小結】圖2所示氯化鈉溶液中溶質、溶劑、溶液的質量比符合9∶991∶1000,即溶質質量分數為0.9%,符合這種溶液組成的才是生理鹽水,才有生理鹽水的功效,否則就不是生理鹽水。可見,定量認識溶液的組成,能更好地調控溶液中溶質、溶劑的質量,配制出人們需要濃度的溶液,服務生活,造福人類。
【設疑】已知20℃時,氯化鈉的溶解度是36 g。有人說:“20℃時氯化鈉飽和溶液中溶質的質量分數為36%。”請解釋錯誤原因并幫他訂正。
【學生】若溶質質量分數是36%,表示的是溶質質量 36 g 和溶液質量100 g 的比值。而20℃時,氯化鈉的溶解度是36 g,意思是100 g溶劑中含溶質36 g,溶液達到飽和狀態,此時飽和溶液質量是136 g,故錯誤在于把溶劑質量當作溶液質量。應該改為:36 g/136 g×100%≈26.5%。
【設疑】溶質的質量分數=溶質質量/溶液質量×100%,根據溶質質量分數、溶質質量、溶液質量三者的關系,若知道任意2個,可以求出第3個。在家里怎么自制一定質量的生理鹽水呢?
3.任務3:自制生理鹽水
【設疑】某同學鼻炎發作,需要自制100 g 0.9%的生理鹽水清理鼻腔。需要氯化鈉和水的質量各多少?水的體積是多少?
【學生】氯化鈉的質量=溶液質量×溶質質量分數=100 g×0.9%=0.9 g,水的質量=100 g-0.9 g=99.1 g,水的體積=m/ρ=99.1 g/1 g.cm-3=99.1 cm-3。
【設疑】需要哪些儀器和藥品?實驗步驟是什么?
【學生】氯化鈉是固體需要稱量,用托盤天平或電子天平;水是液體,一般用量筒量取,用膠頭滴管定容;藥品放燒杯用玻璃棒攪拌至完全溶解就好了。
【追問】用什么取氯化鈉?量筒用50 mL 還是100 mL 的?這里用到的水是自來水、礦泉水、蒸餾水還是三種都行?為什么?配制好的生理鹽水放在敞口燒杯可以嗎?怎么做更好?
【學生】用藥匙取氯化鈉。為減小實驗誤差,量筒量程選擇用最接近量取體積的規格,即100 mL 量筒。用蒸餾水配溶液,防止其他水中含雜質改變溶液的定量組成,進而改變性質,影響使用功效。溶液敞口放置容易被污染,溶劑水也容易蒸發,會改變溶液組成,所以裝到試劑瓶比較好。
【追問】配好的溶液不僅要裝瓶還要貼標簽,標簽上的信息應怎么寫?
【學生】評價3位同學的標簽,見圖5。a是定性表示溶液,沒有標出溶液濃度;b沒必要寫100 g,因為配制溶液是為了使用,這個數字會變小;c是正確的。
【追問】數字 100 g 是動態變化的,0.9%不會變嗎?為什么?
【學生】不會變,因為溶液具有均一性的特征。
【設疑】為減小實驗誤差,實驗時還應注意什么?
【學生】稱量、量取準確;托盤天平要調零,兩邊放等質量稱量紙;量筒讀數要平視;藥品完全轉移到燒杯;玻璃棒攪拌不碰燒杯壁;藥品全部溶解再裝瓶。
【學生】分組實驗:配制100 g 0.9%的生理鹽水。
【追問】回顧實驗過程,哪些環節可能導致實驗誤差?
【學生】氯化鈉轉移到燒杯時有灑在外面;量筒里的水有殘留,無法全部倒進燒杯;量筒讀數時忘記平放在桌面,拿在手上仰視;配好的溶液裝瓶時有滴灑。
【追問】量筒讀數時仰視,量取水的體積比實際偏大還是偏小?配制溶液的濃度是偏大還是偏小?配好的溶液裝瓶時有滴灑,如何影響所配溶液的濃度?
【學生】仰視,水量多了,濃度偏小;裝瓶時溶液滴灑,只是溶液總質量沒有100 g,溶液濃度不會變。
【小結】實驗誤差來源于實驗步驟的每一個環節,包括溶質、溶劑的選擇、溶質質量、溶劑體積計算是否準確等。可見,實驗過程中,具有像科學家那樣“勤于思考、敢于質疑、嚴謹求實、善于合作”[1]的科學態度和品質是實驗成功的前提和保障。
4.任務4:構建配制一定溶質質量分數溶液的思維模型
【設疑】現用16%的氯化鈉溶液,配制160 g 0.9%的生理鹽水。需要16%的氯化鈉溶液和水的質量各多少?實驗步驟是什么?
【學生】160 g 0.9%的生理鹽水中含溶質:160 g×0.9%=1.44 g。所需 16%氯化鈉溶液的質量:1.44 g/16%=9 g。加水的質量=160 g-9 g=151 g。把9 g 16%的氯化鈉溶液和151 g水放燒杯,攪拌混合均勻即可。
【追問】以上關于溶液稀釋,計算的依據是什么?液體一般量取體積比較方便,把質量折算成體積還缺什么數據?
【學生】加水前后溶質質量不變。缺16%氯化鈉溶液的密度。
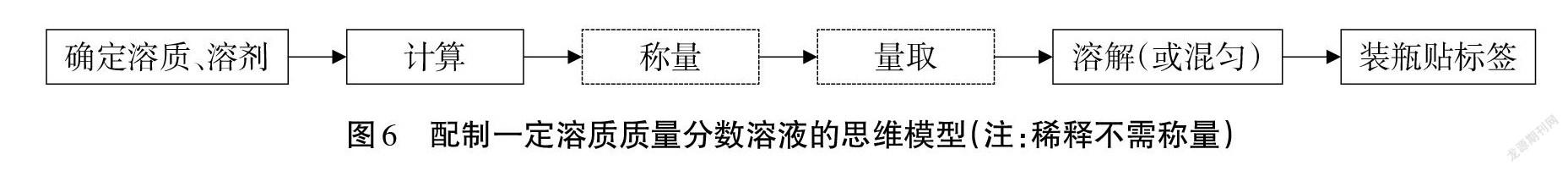
【設疑】體積換算下節課將繼續探討。你認為配制一定溶質質量分數溶液的步驟是什么?
【師生】共同構建配制一定溶質質量分數溶液的思維模型(見圖6)
五、項目教學反思
1.有助于發現學生潛在錯誤和教學盲點
在任務3“自制生理鹽水”計算環節,有的學生認為水的質量就是水的體積,出現算式“99.1 g=99.1 mL”;實驗環節,實驗前師生共同梳理了實驗注意事項,實際操作時,發現學生存在以下錯誤:托盤天平調零后,左盤放了稱量紙,右盤沒放;稱量時氯化鈉放多了,多余的藥品放回原試劑瓶或調節平衡螺母使天平平衡;稱量完畢游碼沒有及時歸零;量筒量水時拿在手上進行讀數;滴管用完直接放桌上;稱好的氯化鈉直接倒進量筒,用玻璃棒攪拌;氯化鈉往燒杯轉移時有滴灑;玻璃棒攪拌聲響較大等。在任務4“溶液稀釋”計算環節,部分學生認為加水的質量為160 g-9 g ×16%=158.56 g。動手做的時候,學生容易暴露原來不易發現的、潛在的錯誤[4],老師據此能及時引導修正,培養定量思維和科學態度。
2.有助于科學精神和人文精神的養成
項目式學習強調在“做中學”中習得新知識,化學學科的“做”多是以化學實驗為主的探究活動。本項目“自制生理鹽水”的完成主要通過學生實驗促進學生理解溶質質量分數的含義并進行溶質質量分數的簡單計算,實驗過程中養成了質疑審辯、合作溝通、勇于創新的科學精神。同時,項目本身蘊含對健康、生命的關懷,通過課堂上師生、生生等多邊互動,讓學生體驗探究活動的樂趣和學習成功的喜悅以及小組表達交流、善于傾聽他人意見的包容開放態度,旨在全面發展的理想人格的肯定和塑造,實現科學精神和人文精神融合的項目式學習基本價值取向[5]。
3.有助于學科素養和跨學科素養的融合
本項目設計一方面基于課標要求,項目涵蓋了課標規定的“溶質質量分數及其簡單計算,配制一定溶 質質量分數的氯化鈉溶液”,項目承載著發展學生定 量觀、科學的物質觀等化學學科觀念和“科學探究”“科學態度”“模型認知”等化學學科核心素養。另一 方面,本項目設計注重學生在解決問題的過程中,從 擁有知識(溶質質量分數及其計算)、運用知識(自制生理鹽水)到創造知識(構建配制配制一定溶質質量分數溶液的思維模型),指向創造性、批判性思維、探究與問題解決、合作等重要的跨學科素養[6]。
當然,本項目教學實施過程中遇到了“時間緊迫與環節優化”“項目評價與時機反饋”“小組合作與改進優化”等問題,還需要進一步學習項目學習理論,在教學實踐中持續研究并改進。
參考文獻
[1] 中華人民共和國教育部.義務教育化學課程標準(2011版)[S].北京:北京師范大學出版社,2012.
[2] 夏雪梅.項目化學習:連接兒童學習的當下與未來[J].人民教育,2017(23):58-61.
[3] 江合佩,劉炯明,張賢金.“發展中的化學科學”項目式教學設計與實施—以“碳氮偶聯合成尿素研究”為例[J].化學教學,2021(6):42-48.
[4] 王潔.體驗“做數學”—“測量學校綠地面積”的項目學習[J].人民教育,2003(15-16):17-21.
[5] 胡紅杏.項目式學習:培養學生核心素養的課堂教學活動[J].蘭州大學學報,2017,45(6):165-172.
[6] 夏雪梅.學科項目化學習設計:融通學科素養和跨學科素養[J].人民教育,2018(1):61-66.
3684500338289

