首烏提取物抑制人血清蛋白糖基化反應研究
謝作樺 姜周 盛文勝 黃國太 王愛貴 周麗紅





摘要 [目的]研究首烏提取物對人血清蛋白糖基化的抑制效果。[方法]選擇不同濃度的首烏提取物混入人血清蛋白-葡萄糖反應體系中得到不同的糖基化產物。[結果]加入首烏提取物抑制劑的糖基化人血清蛋白的自由氨基含量減少緩慢,空間結構發生改變,疏水基團也不易暴露;從抗氧化性角度而言,ABTS+·、DPPH·、超氧陰離子自由基清除能力和還原能力均降低,說明糖基化后期產物生成量減少。[結論]該研究為首烏提取物在人類醫藥健康領域的開發利用提供理論依據。
關鍵詞 首烏提取物;人血清蛋白;糖基化反應;結構;抗氧化活性
中圖分類號 R 285文獻標識碼 A
文章編號 0517-6611(2022)04-0172-04
doi:10.3969/j.issn.0517-6611.2022.04.045
開放科學(資源服務)標識碼(OSID):
Study on Inhibition of Glycosylation of Human Serum Protein by Extract of Radix Polygoni Multiflori
XIE Zuo-hua1,JIANG Zhou2,SHENG Wen-sheng1 et al (1.Jiangxi Deshang Pharmaceutical Research Institute Co.,Ltd.,Zhangshu,Jiangxi 331200;2.Shandong Hongye Food Co.,Ltd.,Rongcheng,Shandong 264300)
Abstract [Objective]To study the inhibitory effect of extract of radix polygoni multiflori on the glycosylation of human serum protein.[Method] The extracts of radix polygoni multiflori with different concentrations were mixed into the human serum protein-glucose reaction system to obtain different glycosylation products.[Result]The free amino group content of glycosylated human serum protein added with radix polygoni multiflori extract inhibitor decreased slowly,the steric structure was changed,and the hydrophobic group was not easily exposed.From the perspective of antioxidant properties,ABTS+·,DPPH·,superoxide anion radical scavenging ability and reducing ability were all reduced,indicating that the production of late glycosylation products was reduced.[Conclusion]This study provides theoretical basis for the development and utilization ofextract of radix polygoni multiflori in the field of human medicine and health.
Key words Extract of radix polygoni multiflori;Human serum protein;Glycosylation reaction;Structure;Antioxidant activity
作者簡介 謝作樺(1983—),男,江西新干人,工程師,從事食品、保健食品和中藥新產品研究。
收稿日期 2021-05-18;修回日期 2021-06-29
在體液中人血清蛋白可以運輸脂肪酸、膽色素、氨基酸、類固醇激素、金屬離子和許多治療分子等,同時是維持血液正常滲透壓的重要物質[1-4]。人血清蛋白的改變將影響機體的正常代謝。糖基化反應是機體中容易發生的一種蛋白修飾反應,它將引起人血清蛋白的結構發生改變從而影響其功能性質擾亂機體中各種物質的運輸。
首烏提取物是蓼科植物何首烏的干燥塊根,主要功能成分是卵磷脂、大黃素、大黃酸和其他成分,具有抗衰老、調節免疫系統、降血脂及抗動脈粥樣硬化的作用[5]。首烏提取物中的單體成分可以激活酪氨酸酶,起到防止白發脫發的目的,另外,其中含有大量的大黃素、二苯乙烯苷等抗氧化成分,可以保護細胞免于氧化損傷,從而起到保護黑素細胞的作用。為了進一步探索首烏提取物的功效和活性,筆者以抑制人血清蛋白糖基化程度為主要目的,選擇不同濃度的首烏提取物混入人血清蛋白-葡萄糖反應體系中得到不同的糖基化產物,并進一步探討首烏提取物對人血清蛋白糖基化反應的抑制機制,為首烏提取物在人類醫藥健康領域的開發利用提供一定的理論依據。
1 材料與方法
1.1 試材 首烏提取物為首烏在乙酸乙酯條件下提取2 h后的提取物;人血清蛋白購于美國Sigma;葡萄糖、半乳糖和果糖購于上海阿拉丁試劑有限公司;鄰苯二甲醛、1,1-二苯基-2-三硝基苯肼(DPPH)、2 ,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽(ABTS)、鄰苯三酚和菲洛嗪購于美國Sigma。
1.2 儀器 電熱鼓風干燥箱(上海恒科學儀器有限公司);Leader-A1型超純水儀(上海領德儀器有限公司);冷凍干燥機(北京亞泰科隆儀器技術有限公司);Synergy H1型酶標分析儀(美國Bio Tek公司);F-7000型熒光光譜儀(日本日立公司)。
1.3 試驗方法
1.3.1 人血清糖基化產物的制備。
糖基化反應參照Yang等[6]的方法并略微改動。用PBS緩沖液(pH 7.4,10 mmol/L)將人血清蛋白配制成10 mg/mL的溶液,并加入質量比為1∶1的葡萄糖混勻,然后分別加入0、10、20、40、80、160 μg/mL的首烏提取物混勻,凍干48 h后將樣品置于37 ℃烘箱中反應2 d。反應結束后,經透析除去多余的糖和首烏提取物,而后凍干得到人血清糖基化產物,以未處理人血清蛋白(HSA)樣品以及未加首烏提取物的人血清蛋白和葡萄糖(HSA+G)混合物為參照。
1.3.2 自由氨基測定。參照Nielsen等[7]的方法并略微修改。分別稱取9.525 g硼砂(Na2B4O7·10H2O,十水合四硼酸二鈉)和0.25 g十二烷基硫酸鈉(SDS)于一小燒杯中,并用150 mL蒸餾水使其完全溶解;再分別稱取200 mg 鄰苯二甲醛(OPA)和0.264 g二硫蘇糖醇(DTT,99%)溶于5.0 mL乙醇(95%);最后用蒸餾水定容到250 mL(棕色容量瓶避光),且OPA溶液在2 h之內使用。取200 μL樣品溶液(1 mg/mL),加入配制好的OPA溶液4 mL,室溫下避光靜置反應2 min,于340 nm處測定吸光度。向濃度梯度為0、0.1、0.2、0.3、0.4、0.5、0.6 mg/mL的賴氨酸溶液中分別加4 mL的OPA溶液,以濃度為橫坐標、吸光度為縱坐標繪制標準曲線,然后根據標準曲線計算各糖基化產物中自由氨基含量。
1.3.3 內源熒光測定。
用超純水將糖基化產物溶解至質量濃度為0.1 mg/mL,對樣品進行內源熒光分析。內源熒光測定條件:激發波長為280 nm,發射波長為300~450 nm,激發和發射的狹縫寬度均為5 nm,掃描速度為1 200 nm/min。
1.3.4 表面疏水性測定。
測定方法參照Xiang等[8]并略微修改。采用8-苯胺基-1-萘磺酸鈉(ANS)作為熒光探針,測定各人血清蛋白糖基化產物的表面疏水性。首先將人血清蛋白糖基化產物稀釋為0.05、0.10、0.20、0.40、0.80 mg/mL,然后分別取6 mL稀釋的樣品與40 μL ANS溶液(8 mmol/L)混合,測定其熒光強度。測定條件設置為:發射波長為400~600 nm,激發波長為390 nm,發射和激發的狹縫寬度均為2.5 nm,掃描速度為1 200 nm/min,電壓為400 V。以人血清蛋白樣品質量濃度 (mg/mL) 為橫坐標、熒光強度為縱坐標繪圖,對曲線采用線性回歸分析進行擬合,通過計算得到曲線斜率,即為各人血清蛋白糖基化產物的表面疏水性。
1.3.5 ABTS+·清除能力測定。
參照Hwang等[9]的方法,測定人血清蛋白糖基化產物的ABTS+·清除能力。將ABTS+·溶解于70%乙醇溶液中并稀釋至其在734 nm時的吸光度為0.7左右備用。取100 μL 樣品與3.9 mL的ABTS+·溶液混勻,常溫下反應10 min,于734 nm處測定其吸光度。各人血清蛋白糖基化產物的ABTS+·清除能力計算公式如下:
清除率=A0-AsA0×100%(1)
式中,A0為超純水替代樣品測定的吸光度,As為各人血清蛋白糖基化產物與ABTS+·溶液反應后的吸光度。
1.3.6 DPPH·清除能力測定。
根據胡月明[10]的方法測定人血清蛋白糖基化產物的DPPH·清除能力。以70%的乙醇溶液配制濃度為0.25 mmol/L的DPPH·溶液,取100 μL稀釋的樣品溶液與100 μL DPPH·溶液于酶標板(96孔)上混勻,室溫下避光反應30 min,于517 nm處測定吸光度。各人血清蛋白糖基化產物的DPPH·清除率計算公式如下:
清除率=A0-AsA0×100%(2)
式中,As為100 μL糖基化樣品與100 μL DPPH·溶液混合測得的吸光度,A0為100 μL樣品與100 μL 70%的乙醇混合后的吸光度。
1.3.7 超氧陰離子自由基清除能力測定。
向稀釋的各人血清蛋白糖基化產物溶液中加入40 μL鄰苯三酚(25 mmol/L),混勻后室溫下反應3 min,快速加入50 μL二硫蘇糖醇溶液(50 mg/mL),混勻后室溫反應15 min,于325 nm處測定吸光度[10]。各人血清蛋白糖基化產物超氧陰離子自由基清除能力計算公式如下:
清除率=A0-AsA0×100%(3)
式中,A0為超純水代替樣品測定的吸光度,As為加入樣品測定的吸光度。
1.3.8 還原力測定。按1∶1∶2的比例混合適當濃度的各人血清蛋白糖基化產物、FeCl2 (2 mmol/L)和菲洛嗪溶液(5 mmol/L),常溫下反應10 min后于562 nm處測定其吸光度。各人血清蛋白糖基化產物的還原力計算公式如下:
還原力=A0-AsA0×100%(4)
式中,As為加入樣品測定的吸光度,A0為PBS溶液代替樣品測定的吸光度。
2 結果與分析
2.1 自由氨基含量
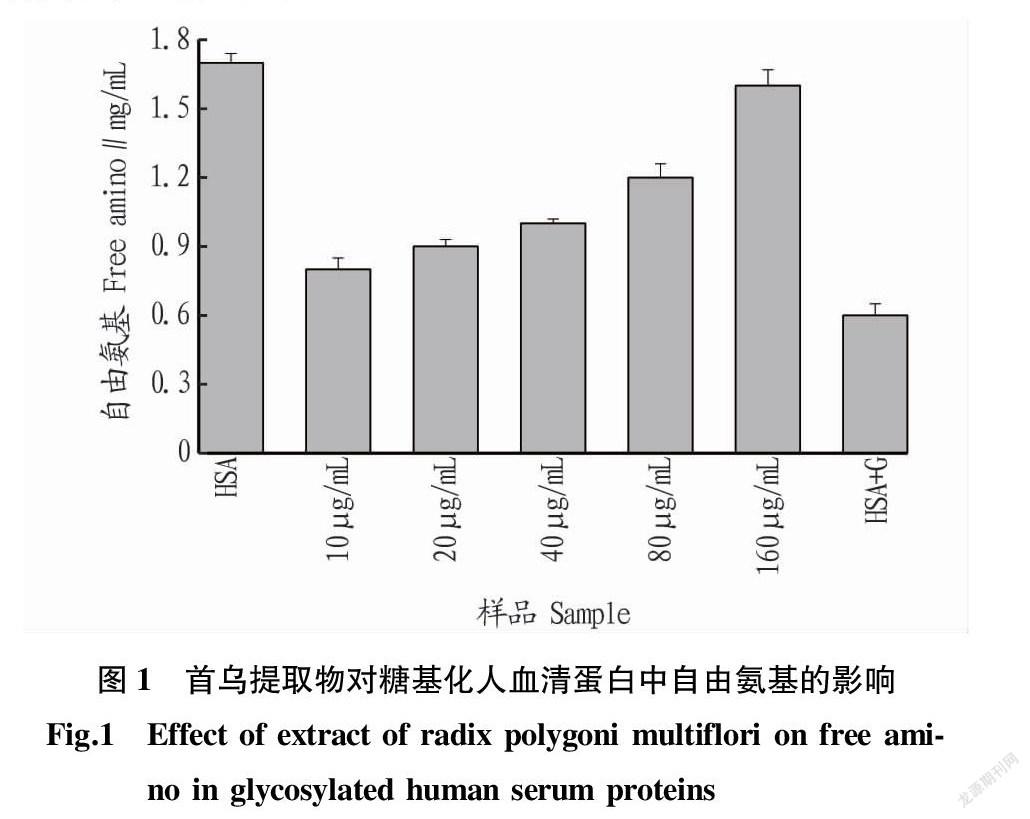
糖基化反應實質是蛋白質分子上的氨基與還原糖中羰基的結合[11]。因此,通過蛋白質分子中自由氨基含量的變化可以判斷糖基化反應程度。由圖1可知,隨著首烏提取物濃度的增大,人血清蛋白中自由氨基也逐漸增多。這表明首烏提取物能夠抑制葡萄糖與人血清蛋白中自由氨基的反應。
2.2 內源熒光分析
芳香族氨基酸尤其是色氨酸是引起蛋白質發內源熒光的原因,而蛋白質結構的改變會引起色氨酸的暴露或者隱藏,從而影響蛋白質的內源熒光強弱[12]。當人血清蛋白與葡萄糖發生糖基化反應時,其空間結構會發生改變,從而引起內源熒光改變[13]。通過對其內源熒光的分析可以推測其構象變化。由圖2可知,未加入任何試劑的人血清蛋白其熒光強度最高,加入葡萄糖后,其熒光強度明顯降低,但是隨著首烏提取物濃度的增大,其熒光強度逐漸增大。這說明葡萄糖與人血清蛋白發生糖基化反應后,可能由于空間位阻或者能量再吸收使得人血清蛋白的熒光強度降低,但是當首烏提取物加入反應體系后,能夠有效地抑制糖基化反應,從而維持人血清蛋白的空間構象,使其熒光強度降低較小。
2.3 表面疏水性分析
表面疏水性主要用于評價蛋白質疏水基團在其三級結構的分布情況[14-15]。從圖3可以看出,經過糖基化處理后,人血清蛋白的表面疏水性增大明顯,這表明葡萄糖的接入使得人血清蛋白的內部疏水區域展開,導致疏水基團的暴露而使表面疏水性增大。而首烏提取物的加入使其表面疏水性逐漸降低,且首烏提取物濃度越大,表面疏水性越低,這更加進一步證明首烏提取物對維持人血清蛋白的空間構象具有積極作用。
2.4 ABTS+·清除能力
ABTS可被K2S2O8氧化成藍色自由基ABTS+,當存在抗氧化劑時,ABTS+·能被還原成沒有顏色的ABTS[16]。因此可以根據顏色的深淺判斷樣品的抗氧化能力。由圖4可知,糖基化后的人血清蛋白其ABTS+·清除率大大增加,這是因為糖基化反應會產生許多抗氧化物質。隨著首烏提取物濃度的不斷加大,糖基化人血清蛋白的ABTS+·清除能力在不斷降低,這表明產生的糖基化抗氧化物質的減少,也說明首烏提取物的抗氧化性不明顯。
2.5 DPPH·清除能力
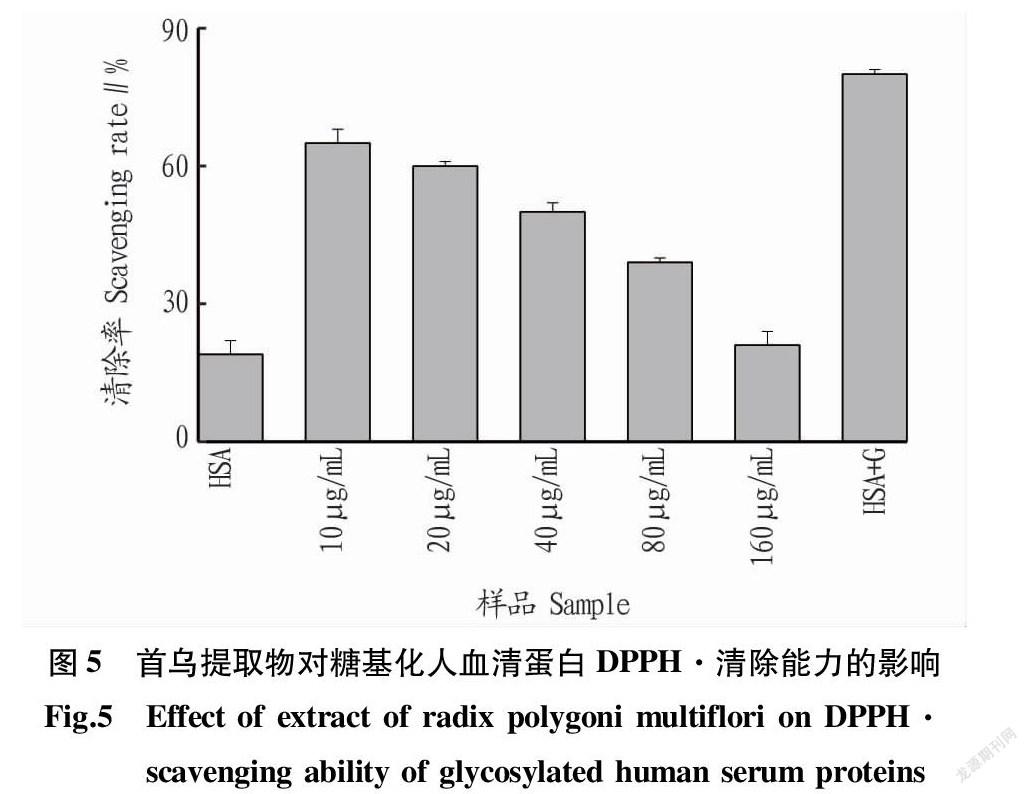
DPPH·是一種在517 nm處具有強吸收的穩定的單電子自由基。當DPPH·被清除后顏色會從深紫色變為黃色或無色[17]。由圖5可知,糖基化后的人血清蛋白其DPPH·清除率大大增加,這是因為糖基化反應會產生許多抗氧化物質。隨著首烏提取物濃度的不斷加大,糖基化人血清蛋白的DPPH·清除率在不斷降低,這表明產生的糖基化抗氧化物質的減少。這與ABTS+·清除能力的結果一致。
2.6 超氧陰離子自由基清除能力
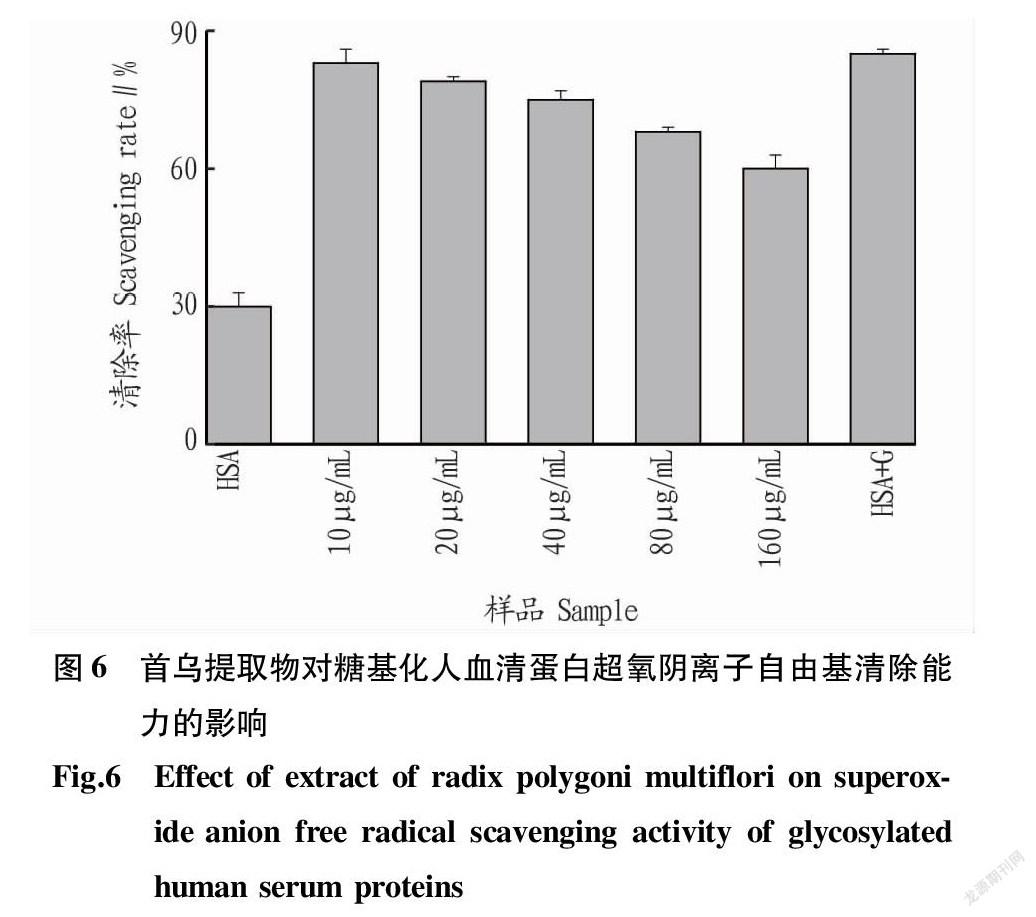
體內的超氧陰離子自由基容易引起體內脂質的氧化[18],加快從皮膚到器官的衰老進程,嚴重可能引起皮膚病變和癌癥等[19]。因此,研究超氧陰離子自由基的清除能力對研究機體抗衰老具有重要意義。由圖6可知,糖基化后的人血清蛋白其超氧陰離子自由基清除率大大增加。隨著首烏提取物濃度的不斷加大,糖基化人血清蛋白的超氧陰離子自由基清除率在不斷降低,這表明產生的糖基化抗氧化物質的減少。這與ABTS+·清除能力和DPPH·清除能力的結果一致。
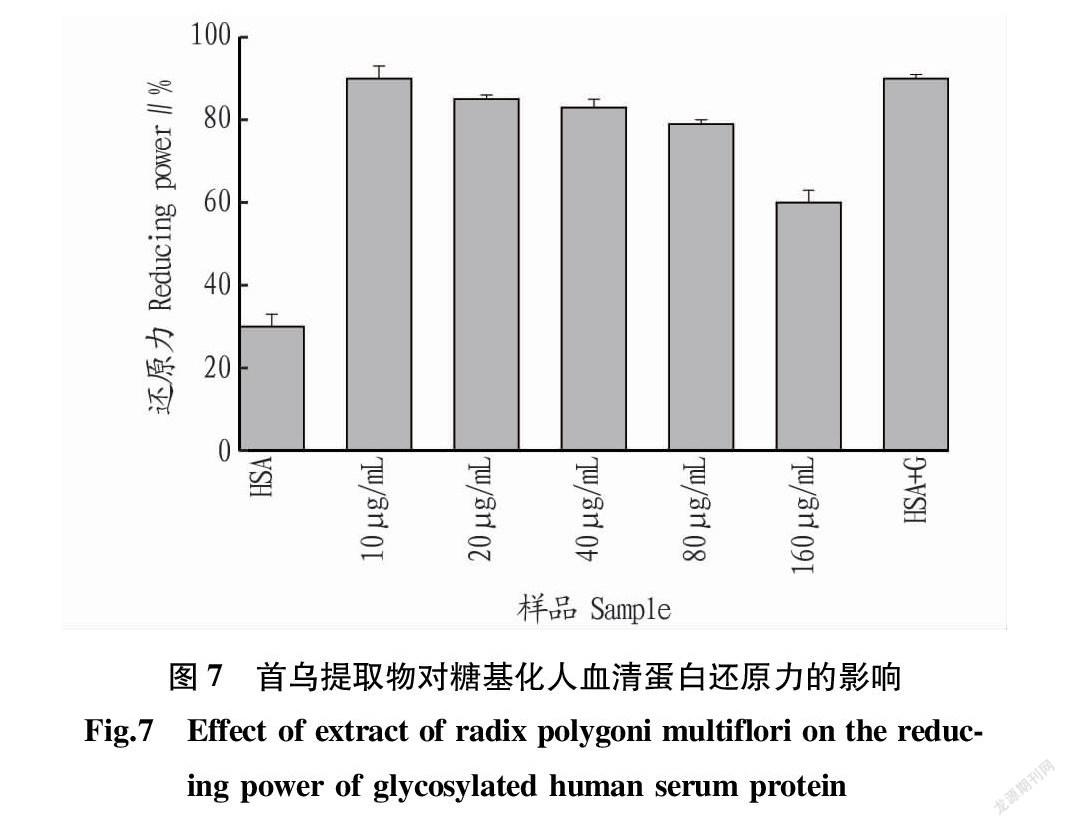
2.7 還原力 從圖7可以看出,
還原力的結果趨勢與ABTS+·、DPPH·和超氧陰離子自由基的清除能力一致,但是還原力相對較高。這并不是因為首烏提取物對糖基化反應的抑制效果差,可能是因為首烏提取物也具有一定的還原能力[20]。
3 結論
糖基化反應是發生在人體內的常見反應,是引起組織器官衰老的主要原因之一,該研究結果表明,不同濃度的首烏提取物與人血清蛋白和葡萄糖同時反應后,其自由氨基含量增多、內源熒光增強,表面疏水性降低,抗氧化能力也有所降低,且隨著首烏提取物濃度的增大,其對人血清蛋白糖基化的抑制效果越明顯。這將為首烏提取物在抑制人機體糖基化反應方面提供重要的研究基礎。
參考文獻
[1]
LI J F,LI J Z,JIAO Y,et al.Spectroscopic analysis and molecular modeling on the interaction of jatrorrhizine with human serum albumin (HSA)[J].Spectrochimica cta art A:Molecular and biomolecular spectroscopy,2014,118:48-54.
[2] TABASSUM S,AL-ASBAHY W M,AFZAL M,et al.Synthesis,characterization and interaction studies of copper based drug with Human Serum Albumin (HSA):Spectroscopic and molecular docking investigations[J].Journal of photochemistry and photobiology B,2012,114:132-139.
[3] DREIS S,ROTHWEILER F,MICHAELIS M,et al.Preparation,characterisation and maintenance of drug efficacy of doxorubicin-loaded human serum albumin (HSA) nanoparticles[J].International journal of pharmaceutics,2007,341(1/2):207-214.
[4] ANRAKU M,YAMASAKI K,MARUYAMA T,et al.Effect of oxidative stress on the structure and function of human serum albumin[J].Pharmaceutical research,2001,18(5):632-639.
[5] 王浩,楊健,周良云,等.何首烏化學成分與藥理作用研究進展[J].中國實驗方劑學雜志,2019,25(13):192-205.
[6] YANG W H,TU Z C,WANG H,et al.Glycation of ovalbumin after high-intensity ultrasound pretreatment:Effects on conformation,immunoglobulin IgG/IgE binding ability and antioxidant activity[J].Journal of the science of food and agriculture,2018,98(10):3767-3773.
[7] NIELSEN P M,PETERSEN D,DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].Journal of food science,2001,66(5):642-646.
[8] XIANG B Y,NGADI M O,OCHOA-MARTINEZ L A,et al.Pulsed electric field-induced structural modification of whey protein isolate[J].Food and bioprocess technology,2011,4(8):1341-1348.
[9] HWANG J Y,SHUE Y S,CHANG H M.Antioxidative activity of roasted and defatted peanut kernels[J].Food research international,2001,34(7):639-647.
[10] 胡月明.微波場內卵清蛋白糖基化反應的研究[D].南昌:南昌大學,2014.
[11] ZHANG M,ZHENG J Y,GE K S,et al.Glycation of α-lactalbumin with different size saccharides:Effect on protein structure and antigenicity[J].International dairy journal,2014,34(2):220-228.
[12] PALLARS I,VENDRELL J,AVIL S F X,et al.Amyloid fibril formation by a partially structured intermediate state of α-chymotrypsin[J].Journal of molecular biology,2004,342(1):321-331.
[13] ANGUIZOLA J,MATSUDA R,BARNABY O S,et al.Review:Glycation of human serum albumin[J].Clinica chimica acta,2013,425:64-76.
[14] CHANDRAPALA J,ZISU B,PALMER M,et al.Effects of ultrasound on the thermal and structural characteristics of proteins in reconstituted whey protein concentrate[J].Ultrasonics sonochemistry,2011,18(5):951-957.
[15] CARDAMONE M,PURI N K.Spectrofluorimetric assessment of the surface hydrophobicity of proteins[J].Biochemical journal,1992,282(Pt2):589-593.
[16] THAIPONG K,BOONPRAKOB U,CROSBY K,et al.Comparison of ABTS,DPPH,FRAP,and ORAC assays for estimating antioxidant activity from guava fruit extracts[J].Journal of food composition and analysis,2006,19(6/7):669-675.
[17] SHARMA O P,BHAT T K.DPPH antioxidant assay revisited[J].Food chemistry,2009,113(4):1202-1205.
[18] ZHANG J J,TU Z C,WANG H,et al.Mechanism of the effect of 2,2′-azobis (2-amidinopropane) dihydrochloride simulated lipid oxidation on the IgG/IgE binding ability of ovalbumin[J/OL].Food chemistry,2020,327[2021-01-17].https://doi.org/10.1016/j.foodchem.2020.127037.
[19] MOSKOVITZ J,YIM M B,CHOCK P B.Free radicals and disease[J].Archives of biochemistry and biophysics,2002,397(2):354-359.
[20] 辛燕花,張鐵丹,張建華,等.靈芝-何首烏雙向液體發酵菌質抗氧化活性研究[J].食用菌學報,2018,25(3):63-71.
3619500338240

